猪TREX1基因的真核表达及其在JEV感染中的作用研究
Safdar Anum,李 慧,李壮壮,相 笑,魏建超,刘 珂,邵东华,李蓓蓓,马志永,邱亚峰
(中国农业科学院上海兽医研究所,上海 200241)
人TREX1(three prime repair exonuclease 1)于1999年首次被发现,由314个氨基酸组成(分子量约为32 kDa),分为两个功能域:N末端包含核酸外切酶活性的元件;C末端与细胞质的定位相关[1]。TREX1是哺乳动物细胞中重要的3′-5′的核酸外切酶,广泛地表达于各种细胞,在细胞中该蛋白主要分布于细胞质中[2]。在细胞内,TREX1通过核酸外切酶的活性清理残留的DNA片段,发挥调控细胞内DNA稳态的作用。相反,TREX1基因突变或缺失导致TREX1功能减弱或消失,从而促进DNA片段的沉积。现有研究显示,TREX1功能缺陷与自身免疫病如系统性红斑狼疮(Systemic Lupus Erthematosus,SLE)[3]和阿拉吉耶综合征(Alagiye syndrome,AGS)[4]等相关,这与TREX1负调控Ⅰ型干扰素的产生相关[5]。在正常情况下,TREX1抑制Ⅰ型干扰素的产生,其具体的机制为:TREX1降解细胞质中的DNA,继而抑制模式识别受体(pattern recognition receptors,PRR)的激活,从而抑制Ⅰ型干扰素的产生[6]。
尽管TREX1负调控Ⅰ型干扰素的产生是其抑制自身免疫病的重要机制,但是,Ⅰ型干扰素在抗病毒反应中起着重要的作用[7-9]。已有研究显示,TREX1抑制HIV感染导致的干扰素[10]。除此之外,TREX1还参与其他病毒的感染,如流感病毒、仙台病毒和西尼罗热病毒,有意思的是,TREX1可通过Ⅰ型干扰素非依赖的途径抑制这些RNA病毒的感染[11]。因此,TREX1通过干扰素依赖的和非依赖的途径参与宿主先天性抗病毒反应的调控。
我们感兴趣于猪TREX1在病毒感染中的作用,同时,实验室前期的研究结果显示,JEV感染上调TREX1的表达。因此,已发表的结果以及我们的前期结果促使我们假想猪TREX1在JEV感染中起着重要的作用。然而,目前关于猪TREX1的研究还非常有限,对于其表达特征以及生物学功能还不清楚。本研究聚焦于猪TREX1的真核表达以及其在JEV感染中的作用研究,以期揭示TREX1在JEV感染中的作用,也为研究猪TREX1在其他病毒感染中的作用奠定基础。
1 材料与方法
1.1 材料 真核表达载体p3xFlag-CMV-14、293T细胞、PIEC细胞、BHK-21细胞由本实验室保存;DNA marker、DH5α购自天根生化科技(北京)有限公司;蛋白预染marker、鼠抗Flag一抗、辣根过氧化物酶(HRP)标记的羊抗鼠二抗购自Abcam公司;Lipofectamine 2000、胎牛血清、双抗、DMEM购自赛默飞世尔科技(中国)有限公司;质粒提取试剂盒购自QIAGEN;TRIzol试剂、PrimeScript™ RT Master Mix (Perfect Real Time)、TB Green™ Premix Ex Taq™ Ⅱ (Tli RNaseH Plus)、限制性内切酶均购自宝日医生物技术有限公司。
1.2 真核表达载体的构建、转染及表达鉴定
1.2.1 真核表达载体的构建 根据猪TREX1基因的序列(GenBank登录号:XM_021070628.1)设计引物(Sense:5′-TATAAAGCTTATGGGCTCGCAGGCC CTGCC-3′;Anti-sense:5′-AGTCGGATCCATGCC CAGGTATGGCTATGG-3′),以猪肺泡巨噬细胞的总RNA为模板,通过RT-PCR扩增获得猪TREX1基因的ORF(去掉终止密码),利用HindⅢ和BamHⅠ为酶切位点将其克隆入p3xFlag-CMV-14真核表达载体中,构建重组表达质粒pFlag-pTREX1。
1.2.2 重组质粒的瞬时转染 质粒提取以及瞬时转染方法参见参考文献[12]。利用QIAGEN plasmid Midi kit制备p3xFlag-CMV-14和pFlag-pTREX1,并用于后续的转染。于转染前1 d,将293T细胞铺到6孔板中,当细胞长至70%~80%满时,利用Lipofectamine 2000将p3xFlag-CMV-14和pFlag-pTREX1分别瞬时转染入293T细胞,于转染24 h后收取细胞样品,用于后续实验。
1.2.3 Western blot检测 配制12%聚丙烯酰胺凝胶进行SDS-PAGE,湿转2 h转印至NC膜,5%脱脂乳室温摇床封闭1 h,弃去封闭液TBST漂洗后加入稀释好的鼠抗Flag抗体(1∶3000),4℃摇床孵育过夜,回收抗体后加TBST置室温摇床漂洗10 min,重复洗3次,加入HRP标记的羊抗鼠二抗(1∶5000),室温摇床孵育1 h,弃去抗体加TBST置室温摇床漂洗10 min,重复洗3次,暗室中进行显影。
1.2.4 过表达与TCID50分析 PIEC细胞长至70%~80%满时,根据上述的方法将p3xFlag-CMV-14和pFlagpTREX1转染如PIEC中,于转染后12 h,感染JEV(1 MOI),于感染后24 h收获细胞上清液和细胞。细胞样品根据上述的Western blot方法进行蛋白分析;细胞上清液进行TCID50分析[13]。
1.2.5 RNA干扰与荧光定量PCR 根据猪TREX1基因的序列进行设计,共获得3条特异的siRNA,利用LipofectamineTMRNAiMAX进行转染,于转染后48 h感染JEV NJ2008毒株[14](1 MOI),于感染后24 h收获细胞上清液和细胞。利用TRIzol试剂裂解细胞,根据说明书进行总RNA的提取,利用反转录试剂盒制备cDNA。参考文献[12]方法进行荧光定量PCR分析[12],相对表达量通过与内标GAPDH进行比对获得。
2 结果
2.1 表达猪TREX1基因的真核表达载体的构建及表达检测 将RT-PCR产物经HindⅢ和BamHⅠ双酶切后克隆到p3xFlag-CMV-14真核表达载体中,获得的重组质粒pFlag-pTREX1。利用HindⅢ和BamHⅠ进行双酶切鉴定,可见两条大小分别约为6300 bp及950 bp的片段,与预期结果一致(图1)。此外,对阳性质粒进行测序验证,结果显示猪TREX1基因成功插入p3xFlag-CMV-14真核表达载体中。随后,利用Western blot对Flag-pTREX1的表达进行了分析,具体为将重组表达质粒pFlag-pTREX1与pFlag-vector分别转染293T细胞,24 h后收取细胞总蛋白进行Western blot分析,利用抗Flag标签抗体鉴定Flag-pTREX1的表达。结果显示,转染pFlag-pTREX1的样品组在约35 kDa处出现特异性的条带(图2),Flag-vector的样品组没有出现条带。说明重组蛋白Flag-pTREX1获得成功表达。

图1 pFlag-pTREX1重组载体的双酶切鉴定Fig.1 Double enzyme digestion of pFlag-pTREX1

图2 真核表达载体pFlag-pTREX1的Western blot表达鉴定Fig.2 Western blot of expression of pFlag-pTREX1
2.2 过表达猪TREX1基因对JEV感染的影响 为了探讨猪TREX1在JEV感染中的作用,首先,通过过表达Flag-pTREX1分析猪TREX1对JEV感染的影响,Western blot的结果显示,pFlag-pTREX1在PIEC上获得有效表达,同时,与vector组相比,过表达猪TREX1增加JEV NS3的表达(图3A)。进一步,利用TCID50对病毒的滴度进行了分析,结果显示,与vector组相比,过表达猪TREX1增加JEV感染(图3B),这与Western blot的结果相符。因此,过表达猪TREX1促进JEV的感染。
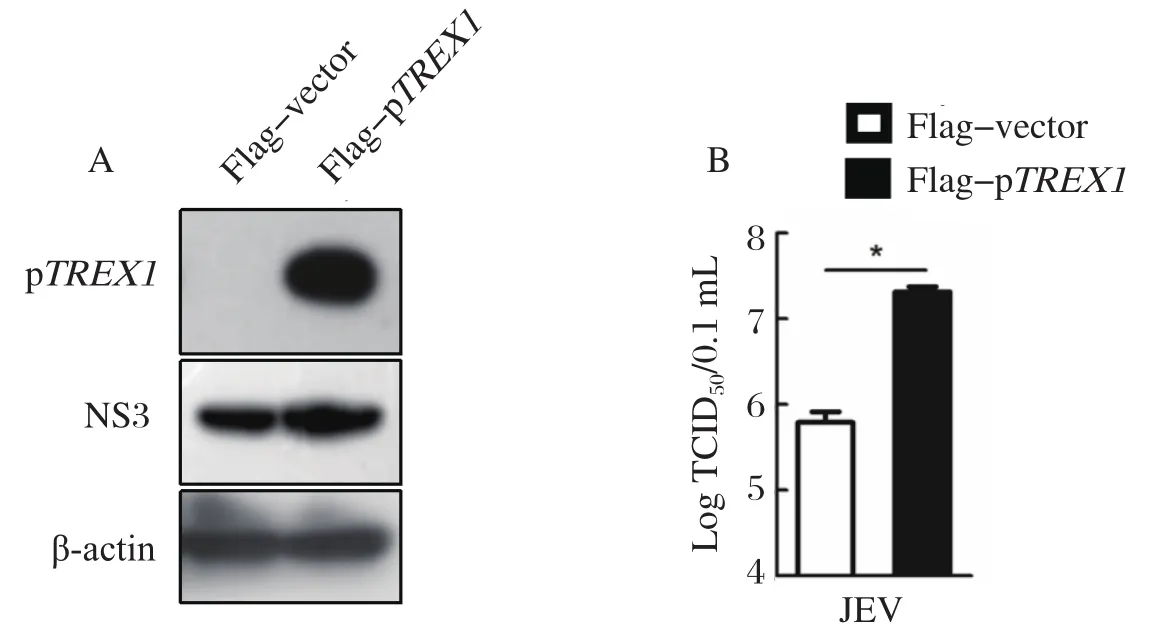
图3 过表达猪TREX1对JEV感染的影响分析Fig.3 Analysis of the effect on JEV infection by overexpression of porcine TREX1
2.3 猪TREX1基因knock-down对JEV感染的影响 为了进一步探讨TREX1在JEV感染中的作用,我们利用RNA干扰技术沉默TREX1基因的表达,验证TREX1在JEV感染中的作用。qPCR检测的RNA干扰效率结果显示,在病毒感染组,基因特异的siRNA可以有效地沉默TREX1基因的表达(图4A)。另外,JEV感染可以有效增加TREX1基因的表达(图4A),这与我们前期观察到的结果相符。此外,对病毒感染情况的分析结果显示,与感染的NC组相比,沉默TREX1基因的表达显著抑制JEV E基因的表达(图4B)。以上结果表明,沉默猪TREX1基因的表达抑制JEV在PIEC上的感染。
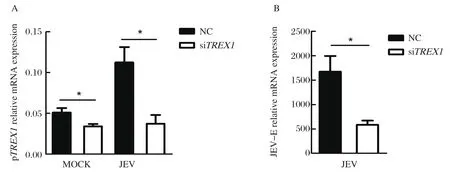
图4 沉默猪TREX1基因对JEV感染的影响分析Fig.4 Analysis of the effect of porcine TREX1 on JEV infection by RNA interference
3 讨论
本研究率先利用真核表达系统研究了猪TREX1基因的表达特点,并初步鉴定了猪TREX1能促进JEV的感染。首先,我们将编码314氨基酸的猪TREX1基因克隆入真核表达载体p3xFlag-CMV-14中,通过瞬时转染及Western blot检测猪TREX1的表达特点。随后,通过过表达揭示了猪TREX1有利于JEV的感染。最后,通过RNA干扰揭示了JEV通过上调猪TREX1基因的表达促进JEV的感染。
根据我们克隆的猪TREX1基因的序列,推导获得氨基酸的序列。首先,序列分析的结果显示猪TREX1中也包含有3个核酸外切酶保守的基序即ExoⅠ、ExoⅡ及Exo Ⅲ(数据未显示)[1]。进一步,对编码的蛋白分子量预测,结果显示猪TREX1约为33 kDa。分析结果显示重组融合蛋白Flag-pTREX1的分子量约为35 kDa(图2),这与预测的结果吻合。由于目前还没有针对猪TREX1的特异抗体,因此,猪TREX1在不同组织中的表达特征需要进一步研究。
TREX1作为3′-5′核酸外切酶,通过降解细胞质中的DNA负调控先天性免疫反应,即TREX1可以通过干扰素依赖的或非依赖的途径负调控先天性抗病毒反应[10-11]。前期研究结果显示JEV感染上调TREX1的表达,本研究结果进一步证实JEV感染增加猪TREX1的表达。虽然目前关于猪TREX1是否参与JEV感染还不清楚,但本研究结果显示,过表达猪TREX1促进JEV的感染,相反,沉默猪TREX1基因的表达抑制JEV的感染,本研究结果提示,猪TREX1基因可能通过负调控先天性抗病毒反应促进JEV的感染。总之,本研究初步鉴定了猪TREX1基因的表达特点,并揭示了猪TREX1促进JEV的感染。然而目前,对猪TREX1促进JEV感染的机制不清楚,这需要将来进一步的研究。此外,除了JEV外,是否猪TREX1也参与其他病毒的感染,也需要进一步的研究。因此,本研究不仅为揭示猪TREX1基因在病毒感染中的作用奠定基础,而且为理解病毒和宿主的相互作用奠定基础。

