蛹虫草利用玉米芯发酵生产虫草素
王 咏 丽, 李 倩, 李 成, 王 际 辉,3, 王 亮
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.大连大学 生命科学与技术学院, 辽宁 大连 116622;3.东莞理工学院 化学工程与能源技术学院, 广东 东莞 523808 )
0 引 言
蛹虫草,又名北冬虫夏草,是一种药用真菌。其子实体具有虫草素、多糖等多种生物活性化合物[1]。虫草素(3′-脱氧腺苷)作为蛹虫草的主要活性成分,是一种核苷类物质,具有抗肿瘤[2]、抗病毒[3]、抗菌[4]和抑制炎症等[5]药理活性。虫草素的化学结构与腺苷相似,但缺乏3′-OH,正是由于这种结构不同,使其抑制癌细胞mRNA的多腺苷化,从而显示出抗癌作用[6-7]。
虫草素在医药领域有着良好应用前景。虽然虫草素可通过化学法合成,但原料成本高、工艺烦琐、产物收率低,限制了其应用[8]。目前,虫草素主要来源两种方式:一是直接从天然或人工培育的蛹虫草子实体中提取,但子实体培养周期长(约60 d)、培养条件复杂、不易控制,且虫草素产量较低,不能满足工业原料需求;二是经过液体发酵,从蛹虫草丝体和发酵液中提取虫草素,液体发酵生产周期短(约15 d),发酵过程易于控制,产物生成目的性强[9],目前多采用深层液体发酵技术生产虫草素。
玉米芯作为玉米种植的副产物,含有丰富的纤维素和半纤维素,且木质素含量低。Zheng等[10]通过γ-戊内酯/1-甲基-3-甲基咪唑二甲基亚磷酸酯预处理结合纤维素酶水解玉米芯原料,得到94.9%来自纤维素的葡萄糖和53.3%来自木聚糖的木糖,利用水解液开展酪丁酸梭菌(Clostridiumtyrobutyricum)液体发酵,丁酸产量达0.47 g/(L·h),产物得率为0.45 g/g。
本实验比较了葡萄糖和木糖两种碳源对蛹虫草菌菌体生长和虫草素代谢的影响,尝试以玉米芯为发酵原料,以期探究用蛹虫草菌液体发酵生产虫草素的可行性。
1 材料与方法
1.1 材 料
1.1.1 菌 株
蛹虫草C.militarisFFCC 5101,大连工业大学生物工程学院选育保藏。
1.1.2 培养基
斜面培养基(g/L):葡萄糖30,蛋白胨10,磷酸二氢钾1,七水硫酸镁0.5,琼脂30;自然pH,121 ℃灭菌20 min。
发酵培养基(g/L):葡萄糖(或木糖)20~40,硫酸铵5,磷酸氢二钾1,磷酸二氢钾1,七水硫酸镁0.5,七水硫酸锌0.86,维生素B10.2,甘氨酸5,天冬氨酸0.5,谷氨酰胺1,酪氨酸0.1,半胱氨酸0.1,亮氨酸0.5,赖氨酸1,苯丙氨酸0.2,自然pH。其中氨基酸和维生素经无菌滤膜过滤除菌,其他组分121 ℃灭菌20 min。
1.2 方 法
1.2.1 制备孢子悬液
将C.militarisFFCC5101接种至100 mL斜面培养基的茄子瓶中,于25 ℃恒温培养15 d产生孢子。在无菌操作条件下取适量生理盐水用玻璃棒刮洗孢子并经三层纱布过滤得到孢子悬液,显微镜计数并稀释至1×107CFU/mL[11]。
1.2.2 葡萄糖/木糖为碳源的液体发酵
将C.militarisFFCC5101接种于以葡萄糖或木糖为碳源的液体发酵体系,包括单一碳源和混合碳源液体发酵。单一碳源发酵体系,葡萄糖或木糖质量浓度分别为20、30和40 g/L;混合碳源实验组,葡萄糖与木糖质量浓度比分别为1∶2、1∶1和2∶1,总糖质量浓度为30 g/L。液体发酵接种量为1%,160 r/min、25 ℃条件下培养20 d,每组实验设置3个平行。每隔5 d取样,测定生物量、残糖量和虫草素产量。
1.2.3 两阶段液体发酵
将C.militarisFFCC5101按1%接种量接种于以30 g/L葡萄糖为唯一碳源的液体培养基中,25 ℃、160 r/min振荡培养5 d,离心收集菌体,重悬于20 g/L木糖为唯一碳源的液体发酵培养基中继续培养15 d,每组设置3个平行。每隔5 d取样,测量生物量、残糖量和虫草素产量。
1.2.4 玉米芯为碳源的液体发酵
称取10 g干燥玉米芯粉(玉米芯粉碎并过80目筛)于250 mL三角瓶中,加入100 mL 10%的NaOH溶液,25 ℃静置24 h,经三层纱布过滤后用去离子水清洗固体残渣直至中性,将碱预处理的玉米芯置于60 ℃烘干备用[12]。
称取1 g经碱预处理的玉米芯,置于250 mL三角瓶中,按固液比1∶20分别加入100、200、300、400和500 U的纤维素酶液(复合酶,包含外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶等),37 ℃酶解48 h收集酶解液,利用DNS法测定还原糖含量,确定最佳酶用量。
按固液比1∶20加入最佳纤维素酶用量,37 ℃ 条件下酶解72 h,每隔12 h取样,利用DNS法测定还原糖含量,确定最佳酶解时间。
取适量玉米芯酶解获得100 mL酶解液,配制成发酵培养基,121 ℃灭菌20 min。液体发酵接种量为1%,160 r/min、25 ℃条件下培养20 d,每隔5 d取样,测定生物量、残糖量和虫草素产量。
1.4.1 生物量的测定
取2 mL发酵液,12 000 r/min离心5 min,弃上清收集菌体,用无菌去离子水清洗2遍收集菌体,80 ℃烘干至恒重,计算生物量。
1.4.2 残糖量的测定
采用DNS法测定发酵液及玉米芯酶解液中还原糖浓度[13]。采用间苯三酚比色法测定玉米芯酶解液中木糖浓度[14]。
1.4.3 虫草素产量的测定
采用HPLC法检测发酵液中虫草素产量[11]。高效液相色谱Waters e2695,紫外检测波长260 nm,色谱柱Venusil MP C18 (2)(4.6 mm×250 mm),柱温25 ℃,进样量10 μL,体积流量0.8 mL/min,流动相为体积比20∶80的甲醇-水溶液。
1.4.4 得率系数的计算
Y1=ρx/ρs
(1)
Y2=ρp/ρs
(2)
Y3=ρp/ρx
(3)
Q=ρp/t
(4)
式中:Y1为基于底物消耗的细胞得率,g/g;Y2为基于底物消耗的虫草素得率,mg/g;Y3为基于细胞生长的虫草素得率,mg/g;ρx和ρs分别为发酵液中的生物量和底物(葡萄糖或木糖)质量浓度,g/L;ρp为发酵液中的虫草素质量浓度,mg/L;Q为虫草素生产强度,mg/(L·d);t为发酵时间,d。
2 结果与讨论
2.1 葡萄糖/木糖为单一碳源的虫草素液体发酵
虽然蛹虫草中虫草素生物合成机制仍未明确阐述,但基于Lennon[15]和Xia[16]等推测的虫草素合成途径可知,底物进入细胞后,经过糖酵解途径(EMP)、磷酸戊糖途径(PPP)进入嘌呤代谢途径,最终由虫草素生物合成基因cns1、cns2和cns3编码的氧化还原酶、磷酸水解酶和ATP依赖的磷酸转移酶合成虫草素。在蛹虫草中,葡萄糖和木糖均可被细胞利用合成虫草素,两种底物经一系列酶催化生成R5P,经过PPP途径及嘌呤代谢,进而参与虫草素生物合成。对于蛹虫草代谢,葡萄糖通过EMP途径保证细胞能量供应有利于细胞生长,而木糖则可促进虫草素合成前体的积累。
分别以20、30和40 g/L葡萄糖或木糖为碳源进行深层液体发酵,检测了残糖量、生物量和虫草素产量等参数,结果如图1和图2所示。

(a) 残糖量

(a) 残糖量
由图1可以看出,蛹虫草在40 g/L葡萄糖体系生长较好,5 d生物量较30和20 g/L葡萄糖体系分别提高15.59%和32.77%。40 g/L葡萄糖体系虫草素发酵产量最高,15 d虫草素产量比30和20 g/L体系分别高1.22%和55.23%。如表1所示,虽然30和40 g/L葡萄糖体系的虫草素产量接近,但前者Y3为(11.27±2.19) mg/g,而后者仅为(9.87±0.86) mg/g。可见,当以葡萄糖作为唯一碳源进蛹虫草深层液体发酵生产虫草素,30 g/L为最适碳源质量浓度。

表1 不同液体发酵体系蛹虫草得率系数及生产强度比较Tab.1 Comparison of yield coefficient and productivity in different fermentation systems with C. militaris.
如图2所示,20 g/L木糖体系生物量最高,10 d生物量较30和40 g/L木糖体系分别提高了50.80%和13.04%,其生物量积累速率显著低于葡萄糖体系。木糖发酵体系底物消耗速率也明显低于葡萄糖发酵体系,30和40 g/L木糖体系的残糖均需要15 d才基本耗尽,这与细胞生长延迟有关。20 g/L木糖体系虫草素产量最高,20 d虫草素产量较30和40 g/L木糖体系分别提高了135.01%和69.69%。如表1所示,当木糖为20 g/L 时,Y2和Y3较30和40 g/L木糖体系分别提高233.33%、55.65%和244.77%、49.79%。综上,当以木糖作为唯一碳源进行液体发酵,最适质量浓度为20 g/L。
由图2和图3可知,以木糖作为唯一碳源时,蛹虫草菌体生长明显滞后,同时虫草素产量和合成速率也低于葡萄糖发酵体系,20 g/L木糖体系的最高虫草素产量仅为30 g/L葡萄糖体系的34.99%,且前者Y3也仅为后者的31.77%。由此可见,葡萄糖较木糖更有利于蛹虫草细胞生长及虫草素积累,这可能是由于木糖进入细胞后消耗还原力NADPH影响细胞生长,同时弱化了氧化还原酶(虫草素合成关键基因cns1编码)催化生成虫草素的反应[10]。
2.2 混合碳源的虫草素液体发酵
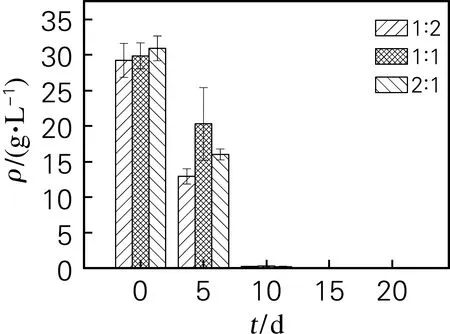
以不同葡萄糖与木糖质量比(1∶2、1∶1和2∶1)的混合碳源(总糖质量浓度30 g/L)进行蛹虫草深层液体发酵,结果如图3所示。
如图3所示,混合碳源对虫草素产量影响较大,当葡萄糖和木糖质量比为1∶2时,20 d虫草素产量最高,较1∶1和2∶1发酵体系分别提高了42.22%和12.45%。比较混合碳源(1∶2)与20 g/L木糖体系发现,补充10 g/L葡萄糖可以显著缩短菌体生长延滞期,且明显提升虫草素产量,20 d虫草素产量较木糖体系提高了39.54%。
(a) 残糖量
由表1可知,混合碳源较单一木糖发酵体系的Y1、Y3和Q均显著提高,表明混合碳源较单一木糖碳源更适合于蛹虫草液体发酵生产虫草素。
2.3 基于碳源策略的两阶段发酵
首先以葡萄糖为唯一碳源进行蛹虫草液体培养,5 d后切换木糖发酵培养基继续发酵15 d,发酵过程中测定生物量、残糖质量浓度及虫草素产量。如图4所示,以木糖为碳源后,生物量积累不显著,10 d后生物量稍有下降,可能与由底物耗尽导致的细胞衰亡相关。虫草素产量较单独以20 g/L木糖为碳源的发酵体系提高了5.26%。如表1所示,两阶段发酵体系中,第二阶段(木糖发酵阶段)Y1和Q分别较20 g/L木糖体系提高了146.30%和40.32%。
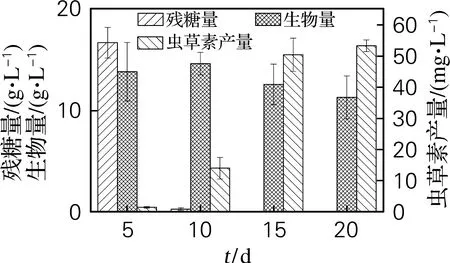
图4 蛹虫草两阶段发酵生产虫草素
在C.militarisTBRC7358液体静态发酵体系中,Wongsa等[17]比较了葡萄糖和木糖作为碳源的发酵参数,发现木糖发酵体系的Y3是葡萄糖发酵体系的1.92倍。由此赵星月等[6]提出,在发酵前期利用葡萄糖培养提供菌体生长所需营养物质,后期切换为木糖促进虫草素合成的两阶段发酵策略。
2.4 以玉米芯为原料进行虫草素液体发酵
玉米芯含有大量纤维素和半纤维素,经过酸、碱及纤维素酶处理降解为小分子糖(主要包括葡萄糖和木糖),能够满足微生物生长和发酵生产。蛹虫草能够同时利用葡萄糖和木糖,因此本研究选用玉米芯作为发酵原料,考察其水解糖作为碳源应用于虫草素发酵的可行性。
如图5所示,当纤维素酶用量为300 U时,1 g 玉米芯酶解48 h后酶解的还原糖量最高。称取等量玉米芯原料酶解不同时间(12~72 h),结果显示,36 h为最适酶解时间。酶解超过36 h,酶解液中残糖量有所下降,推测可能由于长时间酶解反应导致微生物生长消耗了部分还原糖。综上可知,纤维素酶用量300 U、酶解时间36 h是玉米芯原料的最佳酶解条件。

(a) 纤维素酶用量

(b) 酶解时间
在优化后的酶解条件下处理5 g玉米芯原料(还原糖质量浓度(25.56±1.30) g/L,其中木糖质量浓度(8.68±1.01) g/L)。如图6所示,该体系生物量较30 g/L葡萄糖体系及20 g/L木糖体系分别提高31.96%和15.99%,表明酶解后的玉米芯释放的小分子糖(葡萄糖/木糖混合碳源)对菌体生长具有促进作用。5 d发酵液中残糖量为(4.41±0.37) g/L,较木糖为唯一碳源的发酵体系,木糖利用率显著提高。玉米芯发酵体系虫草素产量仅为20 g/L木糖体系的50.44%,这可能是由于玉米芯在碱处理过程中产生了酚类、醛类或乙酸等物质[18],对虫草素代谢相关酶产生了抑制。

图6 蛹虫草菌利用玉米芯发酵生产虫草素Fig.6 Cordycepin fermentation of C. militaris FFCC5101with corncob
4 结 论
以蛹虫草深层液体发酵体系为研究对象,考察了葡萄糖和木糖作为碳源对虫草素发酵的影响。结果表明,葡萄糖和木糖均能作为唯一碳源进行蛹虫草的虫草素发酵,葡萄糖发酵体系的虫草素得率显著高于木糖发酵体系。当利用单一碳源时,30 g/L葡萄糖或20 g/L木糖为最适浓度。本研究还提出了葡萄糖-木糖两阶段液体发酵策略,应用该发酵策略,基于木糖代谢的虫草素生产强度显著提高。利用玉米芯酶解液进行蛹虫草深层液体发酵,虫草素产量达到(25.53±3.27) mg/L。

