L-天冬氨酸α-脱羧酶异源表达和转化条件的优化
任 彬, 李 博, 范 超,, 洪 皓, 张 春 枝
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.大连医诺生物股份有限公司, 辽宁 大连 116600 )
0 引 言
β-丙氨酸是泛酸合成的前体,是机体内合成肌肽的限速前体,在生物中具有重要的生理功能;同时也是食品添加剂、药品和含氮化学品的中间体,在工业中发挥着重要作用[1-2]。β-丙氨酸的合成方法主要有两种,即化学合成法和生物转化法。化学合成法反应条件苛刻,副产物分离纯化复杂,对环境污染严重[3]。利用L-天冬氨酸α-脱羧酶将L-天冬氨酸转化生成β-丙氨酸的生物转化法具有副产物少、成本低、环境友好等优点,更具备发展前景[4]。
近年来,国内学者着力于性能良好的L-天冬氨酸α-脱羧酶基因(panD)的挖掘,以及对L-天冬氨酸α-脱羧酶(PanD)酶学性质和生物转化等方面的研究。陈涛等将结核杆菌中的基因克隆后在大肠杆菌中进行重组表达,并对其诱导条件进行优化,将酶活提高约70%。邓思颖等[6]分别对来源于大肠杆菌、谷氨酸棒状杆菌及枯草芽孢杆菌的PanD进行比较,发现来源于枯草芽孢杆菌的PanD重组酶最适pH为6.5,最适温度为65 ℃,具有更好的活性和稳定性,并且根据反应温度越高酶活越高PanD失活越快,推测其可能和S-腺苷甲硫氨酸脱羧酶具有同样的失活机理。陈夏林等[7]对单核增生李斯特菌和杰氏棒杆菌的panD进行密码子优化并构建了重组基因工程菌,对其酶学性质研究,发现两种酶的最适反应温度为55 ℃,最适pH分别为7.0和6.0,同时它们均在30~50 ℃和酸性条件下稳定。
本研究使用实验室构建的基因工程菌异源表达L-天冬氨酸α-脱羧酶,使用粗酶液催化L-天冬氨酸生产β-丙氨酸。对酶蛋白诱导表达和粗酶液转化的条件进行优化,提高表达量和转化效率,初步确立了生产条件。
1 材料与方法
1.1 材 料
菌株:E.coliBL21(DE3)/pET30a(+)-panDI88M,实验室构建。
LB液体培养基:蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠10 g/L,pH 7.5。
LB固体培养基:蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠10 g/L,pH 7.5,琼脂20 g/L,121 ℃ 灭菌20 min,倒平板前加入卡那霉素至终质量浓度50 μg/mL。
主要试剂与仪器:蛋白胨、酵母浸粉,北京奥博星生物技术有限责任公司;氯化钠、正丁醇、冰醋酸、氢氧化钠、氨水,天津市科密欧化学试剂有限公司;IPTG,上海阿拉丁生化科技股份有限公司;L-天冬氨酸、β-丙氨酸,张家港华昌药业有限公司;苯骈戊三酮(茚三酮),国药集团化学试剂有限公司;硫酸铜、无水乙醇,天津市大茂化学试剂厂;1号新华滤纸,杭州沃华滤纸有限公司;V-1100D型紫外可见分光光度计,上海美谱达仪器有限公司。
1.2 方 法
1.2.1 粗酶液的制备
取实验室-80 ℃保藏甘油管,在含有卡那霉素的LB固体培养基平板上划线。于37 ℃恒温培养箱中过夜活化培养,次日挑单菌落至50 mL含有50 μg/mL卡那霉素的液体LB培养基中,37 ℃、180 r/min下摇床培养过夜得到种子液。将种子液按2%接种量接种于100 mL含有50 μg/mL 卡那霉素的液体LB培养基中,37 ℃、180 r/min培养120~180 min至OD600达到0.6左右时,加入IPTG至终浓度达到0.3~0.7 mmol/L,在15、20、25、30、35 ℃下诱导12~20 h。4 ℃、4 000 r/min离心10 min收集菌体,使用pH 7.5磷酸盐缓冲液10 mL重悬菌体超声破壁,4 ℃低温离心,上清即为粗酶液。
1.2.2 酶活力测定
取1.5 mL酶液,加入250 g/L的L-Asp 3 mL 和pH 7.5的磷酸盐缓冲液5.5 mL,在37 ℃ 下反应1 h,取1 mL反应溶液加1 mol/L氢氧化钠溶液0.1 mL终止反应。
酶活定义:在37 ℃,pH 7.5条件下,每小时转化生成产物β-丙氨酸1 μmol所需的酶量为一个酶活单位(U)。
1.2.3 β-丙氨酸含量分析
使用纸层析-分光光度法测定β-丙氨酸含量。展开剂为体积比4∶1∶1的正丁醇-冰醋酸-水溶液,0.5%茚三酮。层析结束后,将滤纸置于110 ℃ 烘箱中2 min,出现紫红色斑点即可。将样品点剪下,置于比色管中,加入洗脱液,洗脱液成分为体积比19∶17的5%乙醇和0.2%硫酸铜水溶液,于30 ℃下洗脱20 min。利用紫外可见分光光度计于510 nm处测定吸光度,计算出样品中β-丙氨酸含量[8]。
使用HPLC法分析β-丙氨酸含量。利用PITC进行柱前衍生:取样品800 μL,加入衍生剂A和B各400 μL,充分振荡3 min,静置1 h。加入等体积的正丁醇萃取,进行HPLC检测。使用C18色谱柱(4.6 mm×250 mm),流动相A,体积比93∶7的乙酸钠和乙腈;流动相B,体积比为4∶1 的乙腈和水,体积流量1 mL/min,进样量10 μL,检测波长254 nm,梯度洗脱[9]。
1.2.4 数据处理
使用Oringin2018软件处理实验数据,并绘制图表。所用数据均为3次测定的(平均值±标准误差值)。
2 结果与讨论
2.1 L-天冬氨酸α-脱羧酶诱导条件的确定
2.1.1 LPTG添加时间对酶活的影响
在接种量2%、37 ℃摇床培养180 min,分别在菌体生长的不同时间加入IPTG,结果如图1所示。OD600达到0.6左右时,添加IPTG进行诱导,酶的表达量最高,酶活力达到249.2 U/mL。原因可能是菌体处于对数生长中期,代谢旺盛。如IPTG加入过早,菌种代谢负担大,影响菌体生长繁殖,菌体生长量不足影响酶蛋白的表达量;而IPTG加入过晚,菌体代谢速度降低,甚至出现菌种老化,不利于酶蛋白表达,还有可能出现包涵体。
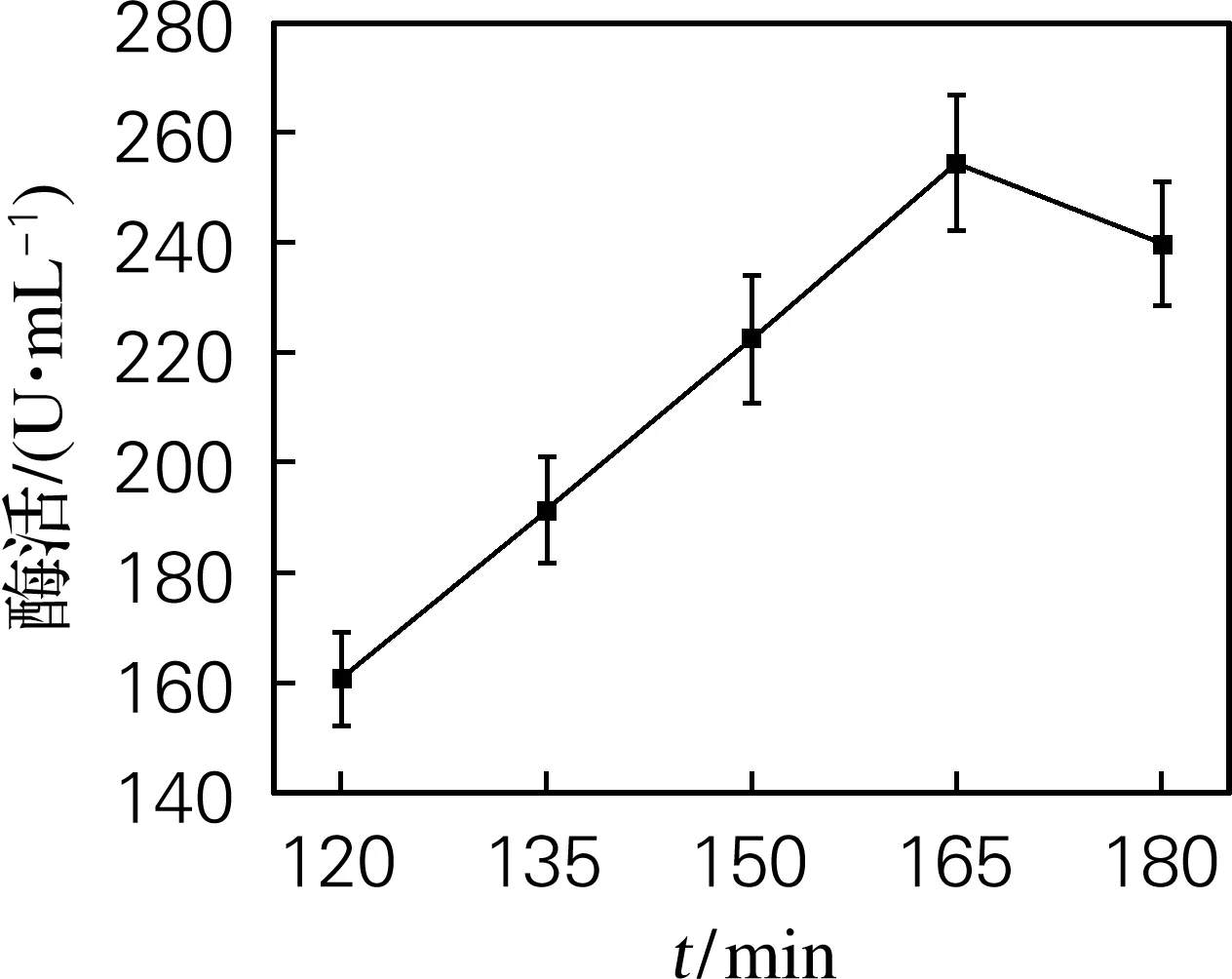
图1 诱导剂添加时间对酶活的影响Fig.1 Effect of adding time of inducer on enzyme activity
2.1.2 IPTG终浓度对酶活的影响
如图2所示,当IPTG浓度达到0.5 mmol/L时,酶表达量最高,酶活达到170.1 U/mL;如果浓度继续升高,由于IPTG对菌体有一定的毒性,蛋白的表达水平会受到影响,过高的IPTG浓度甚至可能会导致包涵体生成。
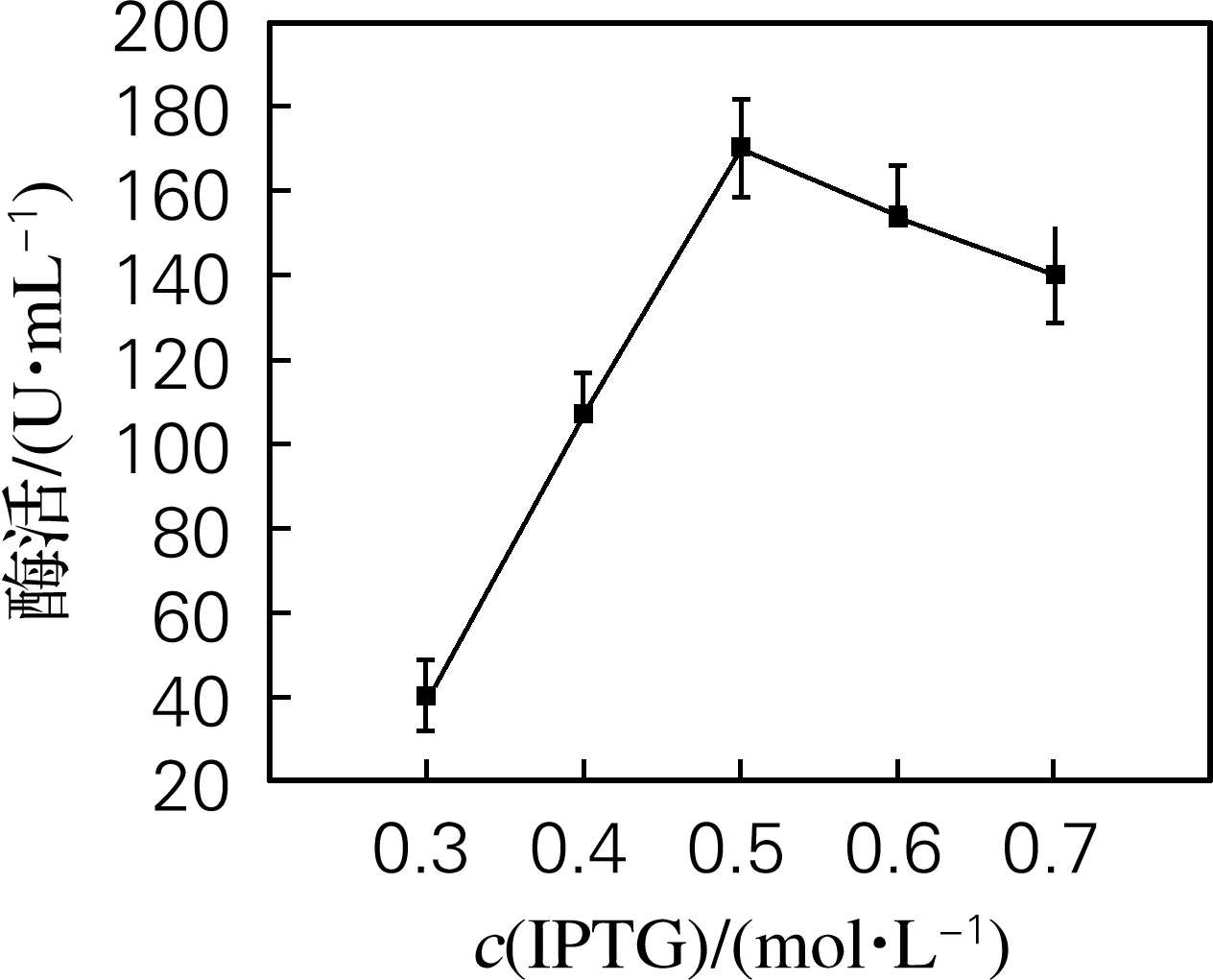
图2 IPTG终浓度对酶活的影响Fig.2 Effect of IPTG concentration on enzyme activity
2.1.3 诱导温度对酶活的影响
如图3所示,当诱导温度在15~35 ℃,酶表达量先上升后下降,诱导温度为25 ℃时,酶活力达到最大,为203.7 U/mL。诱导温度过低可能导致菌体代谢慢,生长缓慢,酶表达量降低;诱导温度过高,菌体代谢旺盛,生长速度过快,蛋白可能被错误折叠形成没有活性的包涵体。
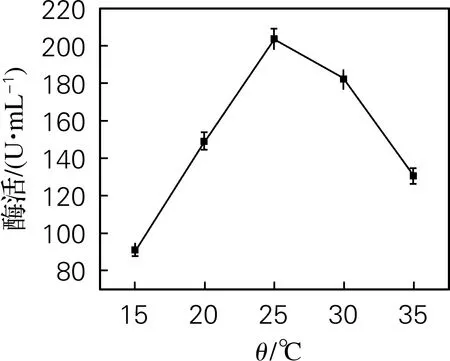
图3 诱导温度对酶活的影响Fig.3 Effect of induction temperature on enzyme activity
2.1.4 诱导时长对酶活的影响
如图4所示,诱导18 h后,酶表达效果最好,酶活达251.2 U/mL。诱导表达时间过短,酶表达量较低;而超过18 h,会因为诱导时间过长会导致菌种老化和包涵体的生成,延长生产周期,成本增加。
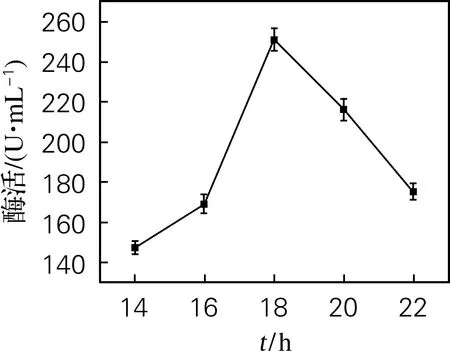
图4 诱导时长对酶活的影响Fig.4 Effect of induction duration on enzyme activity
2.2 L-天冬氨酸α-脱羧酶转化条件的确定
2.2.1 温度对转化反应的影响
如图5所示,在最适转化温度之前,随着转化反应温度的升高,反应速度加快,产物β-丙氨酸产量呈上升趋势。但当温度超过60 ℃时,过高的反应温度会导致酶失活变性,降低转化反应速度,产物β-丙氨酸产量呈下降趋势。因此,确定L-天冬氨酸α-脱羧酶的最适转化温度为60 ℃。
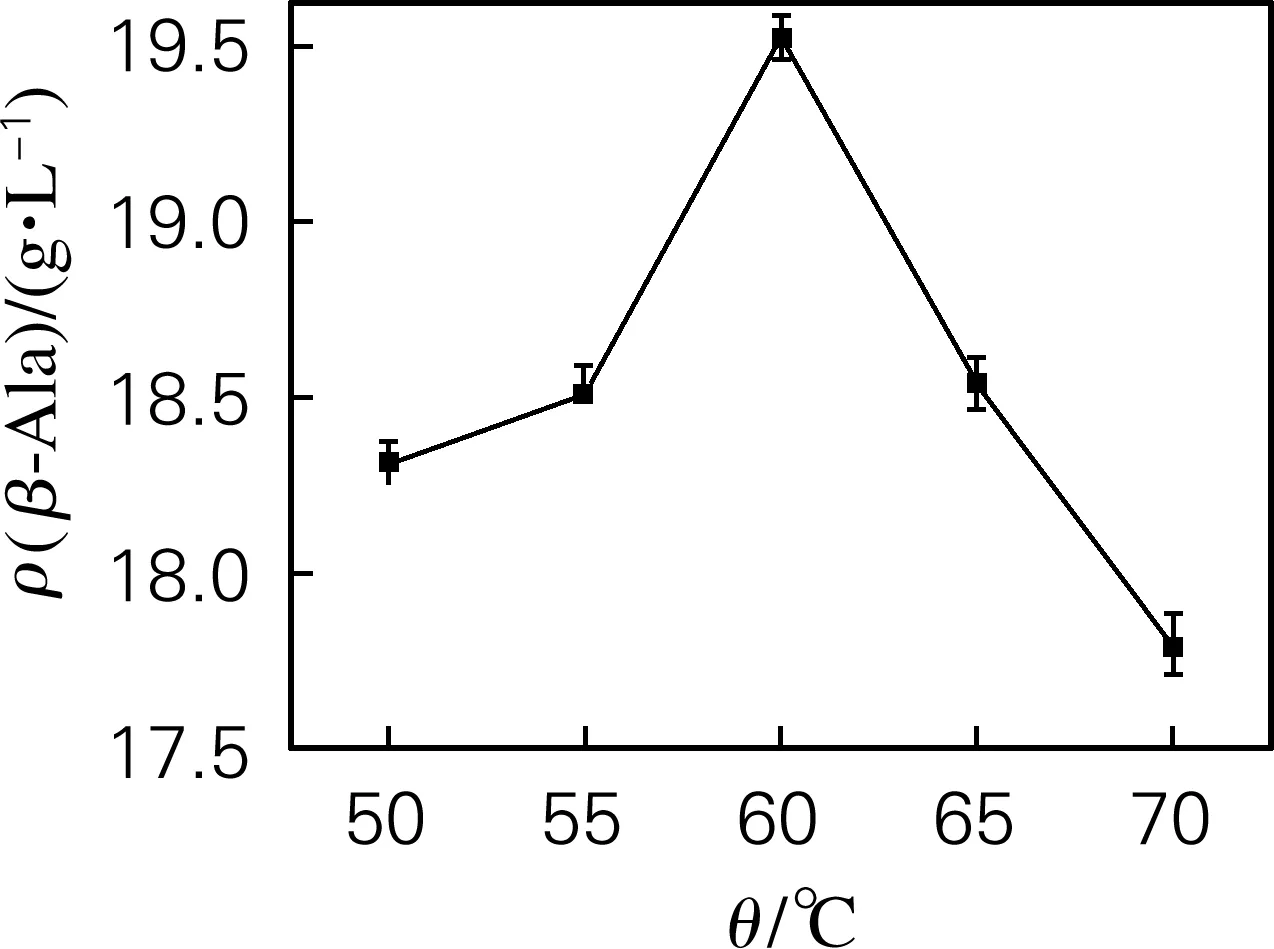
图5 温度对转化反应的影响Fig.5 Effect of temperature on the conversion reaction
2.2.2 pH对转化反应的影响
用6 mol/L盐酸将反应体系pH分别调至6.5、7.0、7.5、8.0、8.5,1 h后终止反应,样测定β-丙氨酸产量。如图6所示,在pH 6.5~8.5,随着pH的上升, β-丙氨酸产量也呈现先上升后下降的趋势,pH为7.5时,β-丙氨酸产量达到最高。
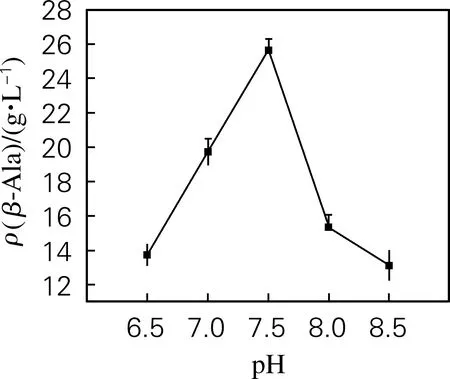
图6 pH对转化反应的影响Fig.6 Effect of pH on the conversion reaction
2.2.3 底物质量浓度对转化反应的影响
如图7所示,当底物L-Asp质量浓度低于90 g/L 时,β-丙氨酸产量随底物质量浓度的升高而升高。而当底物质量浓度高于90 g/L时,β-丙氨酸产量呈下降趋势。
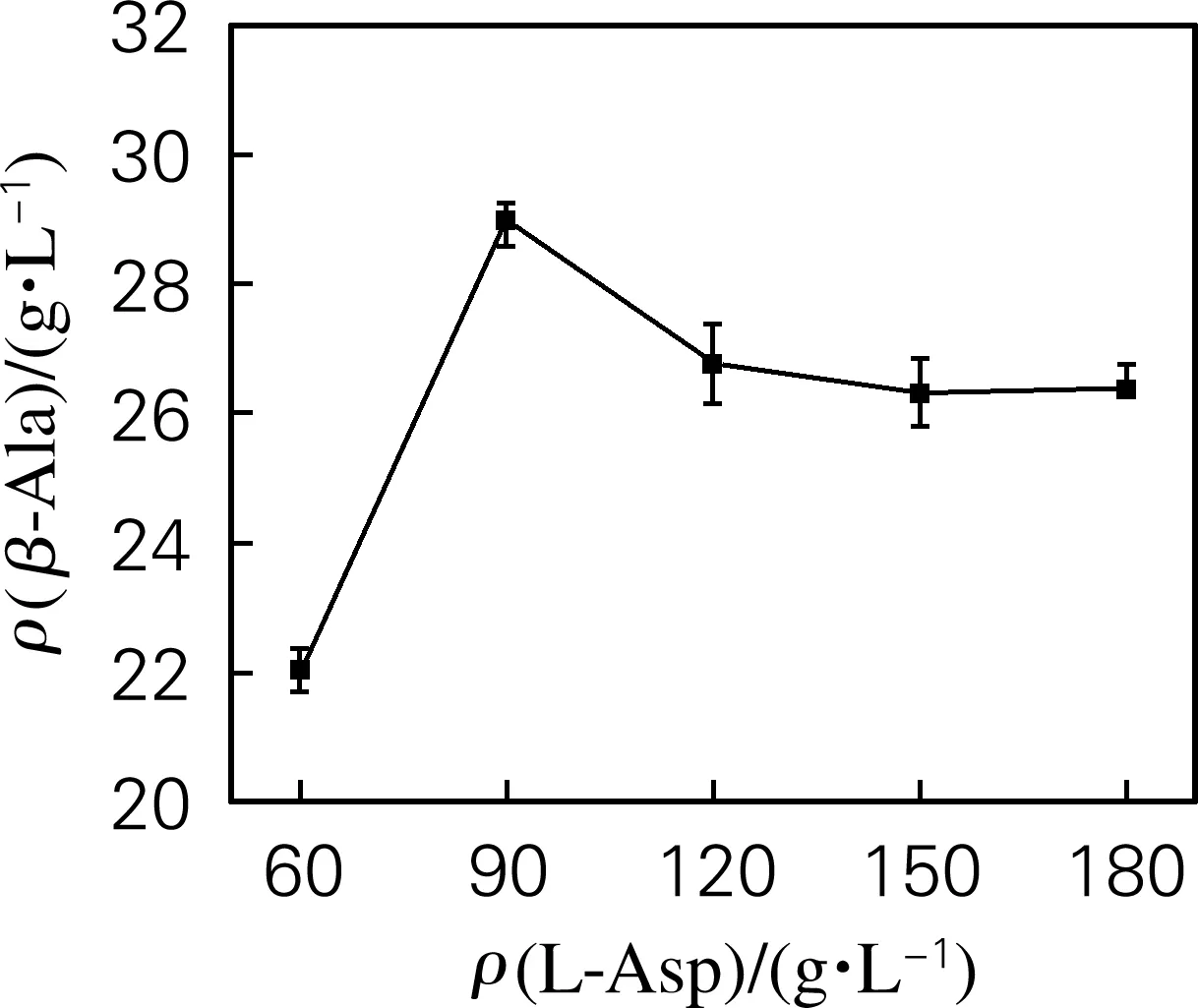
图7 底物质量浓度对转化反应的影响Fig.7 Effect of substrate concentration on theconversion reaction
3 结 论
对实验室构建的菌株E.coliBL21(DE3)/pET30a(+)-panDI88M进行生产工艺优化。
使用L-天冬氨酸粗酶液催化合成β-丙氨酸,在菌体OD600达到0.6左右时进行诱导表达,最适条件为诱导剂IPTG浓度0.5 mmol/L、25 ℃诱导表达18 h,酶活达251.4 U/mL。在pH 7.5、60 ℃条件下,1.5 mL粗酶液3 h可催化90 g/L的L-天冬氨酸生成β-丙氨酸32.58 g/L,β-丙氨酸的产率得到提高。与张波琨等[13]的研究成果全细胞催化7 h,β-丙氨酸产量达到24.17 g/L相比,仅需粗酶液催化3 h,β-丙氨酸产量就达到32.58 g/L,大大提高产量。

