石墨烯/碳复合气凝胶的制备及其吸附性能
曾 婷 婷, 史 非, 刘 敬 肖, 于 天 皎, 牛 亚 慧
( 大连工业大学 纺织与材料工程学院, 辽宁 大连 116034 )
0 引 言
近年来,城市、医院、养殖场等场所过度使用土霉素(OTC)、布洛芬(IBP)等药物,致使含有土霉素、布洛芬的废水流入河流造成水质严重污染[1-2]。水中含有的土霉素会促进耐药菌株的传播,导致多种耐药微生物的出现[3],而水中布洛芬的存在会对藻类、无脊椎动物和鱼类的洄游和生长造成严重的伤害,还会诱发青少年运动员的肝损伤[4-5]。因此,水中含有大量药物类污染物,对水生动植物和人类的健康造成严重的威胁。去除水中药物类污染物的方法有很多,如微萃取、臭氧氧化、光氧化、高级氧化、吸附和生物法等[6],其中吸附法是处理废水污染物最有效的方法之一[7]。羟基磷灰石、碳纳米管吸附剂,对水中土霉素的去除率为97.58%、80.63%[8-9]。何秋玫等[10]以香蒲为原料,高温碳化制备得到香蒲活性炭,对布洛芬的吸附去除率为97.2%。
石墨烯结构中含有大量不饱和键,与土霉素、布洛芬结构中的不饱和键发生π-π相互作用,提高其对土霉素、布洛芬的吸附能力,成为去除土霉素和布洛芬的理想吸附剂[11-12]。碳气凝胶具有丰富的孔结构和高比表面积,且其结构中同样含有大量不饱和键,成为继活性炭、纳米管之后又一新型吸附材料[13-14]。与单一性碳气凝胶相比,将碳气凝胶与石墨烯相结合,制备复合型碳气凝胶可以改善和增强其性能,通过碳气凝胶和石墨烯之间的协同作用,提高其对水中污染物的吸附能力,将成为未来碳气凝胶的发展趋势。
本研究以间苯二酚和甲醛为原料,通过原位合成的方法,制备了G/C复合气凝胶。研究发现碳气凝胶与石墨烯复合后,进一步提高了对水体中土霉素、布洛芬的吸附能力。
1 实 验
1.1 试 剂
间苯二酚、甲醛、无水碳酸钠、氧化石墨烯,分析纯。
1.2 G/C复合气凝胶的制备
以不同浓度的氧化石墨烯(GO)分散液为溶剂,加入碳酸钠、间苯二酚(R)、甲醛(F),搅拌均匀后在水浴锅中陈化,得到GO/RF凝胶。对凝胶进行溶剂置换、冷冻干燥后,氮气气氛下在管式炉中碳化得到G/C复合气凝胶。GO的浓度分别为0、0.1、0.3、0.5、1、2 mg/mL,制备的复合气凝胶分别命名为G/C-0、G/C-0.1、G/C-0.3、G/C-0.5、G/C-1、G/C-2。
1.3 表征与测试方法
采用SSA-4200孔径及表面积分析仪,分析所制备的G/C复合气凝胶的孔径分布和比表面积等特性;利用场发射扫描电子显微镜(FESEM)对G/C复合气凝胶的表面形貌进行观察;采用傅里叶变换红外光谱仪对G/C复合气凝胶的组分化学结构进行表征。
分别取质量浓度为50 mg/L的土霉素、布洛芬溶液300 mL,加入所制备样品进行吸附实验。实验过程中,每次取4 mL待测液体离心,利用紫外可见分光光度计测定离心液的吸光度。根据吸光度与浓度的关系曲线计算出水中土霉素和布洛芬的去除率。
2 结果与讨论
2.1 G/C复合气凝胶的结构表征
图1为G/C复合气凝胶的FT-IR光谱,可见在3 436、1 337 cm-1附近的峰是OH的振动吸收峰,2 924 cm-1处对应的是C—H的伸缩振动吸收峰,1 629、1 384 cm-1对应的是苯环上的碳碳骨架振动峰,1 136 cm-1附近产生的峰是亚甲基醚键(C—O—C)的伸缩振动峰。从图中可以发现G/C复合气凝胶的红外谱图中出现新的基团,在2 070、1 417 cm-1附近,分别为苯环特有的波状吸收和C—O伸缩振动,C—O基团的存在表明GO没有被完全还原。随着G含量的增加,OH峰逐渐变宽,C—H吸收峰减弱,主要是因为GO与RF凝胶之间发生氢键反应,表明G成功掺入碳气凝胶网络中。
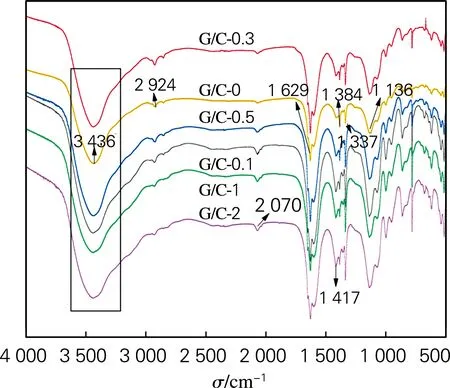
图1 G/C复合气凝胶的FT-IR光谱图Fig.1 FT-IR spectra of G/C composite aerogels
图2为G/C复合气凝胶的SEM图。从图中可以看出样品G/C-0是由碳纳米粒子堆积而成的三维网络结构,结构致密。掺入G片后,均匀分布在碳纳米粒子之间。部分碳纳米粒子沉积在G片上,说明GO与RF凝胶成功发生氢键反应,且有效防止G在凝胶过程中发生自堆积。随着G含量的增加,在碳纳米粒子之间的G片越来越多,当GO质量浓度增加到2 mg/mL时,复合气凝胶主要是由片层支撑形成三维网络结构,孔洞较大,且纳米片呈夹心状,G片变厚,几乎看不见碳纳米粒子团簇,碳纳米粒子沉积在其表面形成多孔碳,将其覆盖并包围在中间。

(a) G/C-0

(c) G/C-0.3

(e) G/C-1
图3为G/C复合气凝胶的氮气吸附脱附曲线。可见,复合气凝胶属于IV型吸附滞回曲线,是典型的介孔材料。样品G/C-0.1、G/C-0.3、G/C-0.5、G/C-1、G/C-0的吸附脱附曲线相似,在相对压力0.7~1.0范围内,具有较大的滞后回环,表明样品含有大量的介孔。随着G含量的增加,样品对氮气的吸附量先增大后减小,表明其网络结构中介孔含量先增大后减小。样品G/C-2
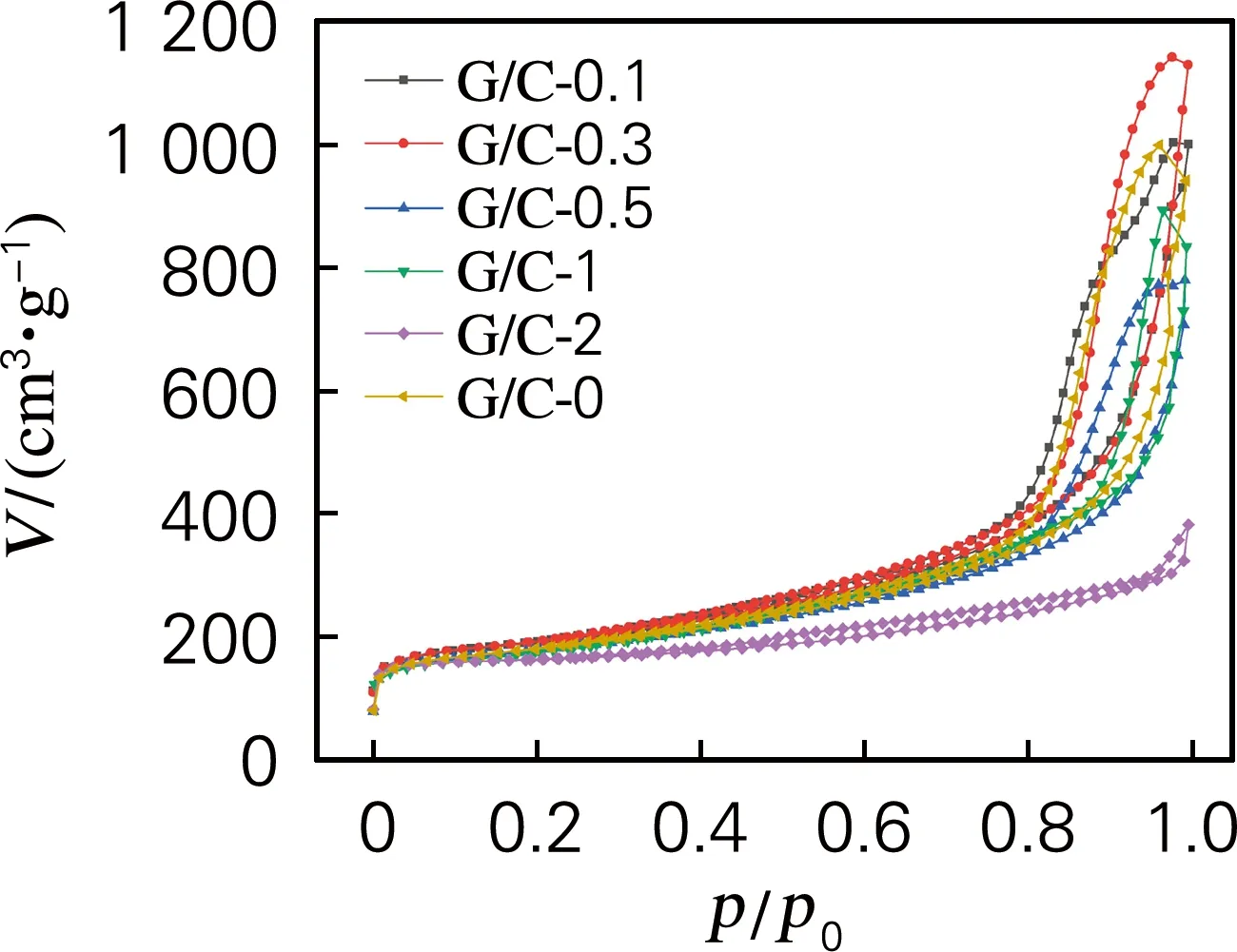
图3 G/C复合气凝胶的N2吸附-脱附等温曲线Fig.3 N2 adsorption-desorption isotherms of G/Ccomposite aerogels
的滞后回环较其他样品小很多,说明过多的石墨烯掺入会导致复合气凝胶中介孔体积大幅降低。
图4为复合气凝胶的孔径分布曲线,样品孔径主要分布在2~50 nm,属于介孔材料,随着G含量的增多,样品孔径先增大后减小。可能是因为,当石墨烯加入量较少时,气凝胶三维网络中由G片层支撑的结构较少,孔径是由碳纳米粒子团簇和少量G片构成,平均孔径变大,比表面积也随之变大;当GO质量浓度增大到2 mg/mL时,平均孔径变小,主要集中在2~10 nm,可能是因为G片较多,提供了足够的成核位点,碳纳米粒子在G片层表面生长,几乎没有形成碳纳米粒子团簇,因此复合气凝胶孔径主要是由G片层支撑的三维网络结构形成的,所以平均孔径减小,比表面积也随之减小。其中样品G/C-1的孔径分布范围比较广,因为此时的G片比较多,网络结构主要是由G片和碳纳米粒子团簇构成,所以孔径分布范围比较大。
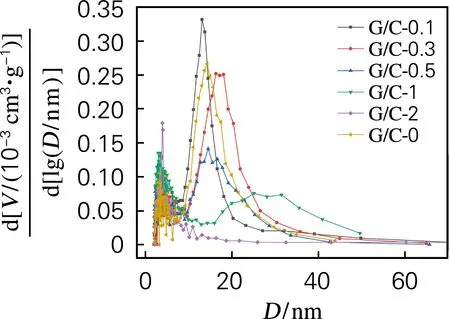
图4 G/C复合气凝胶的孔径分布曲线Fig.4 Pore size distribution curves of G/Ccomposite aerogels
表1给出了不同含量G的复合气凝胶的比表面积、孔径、孔容数据。随着G含量的增加,复合气凝胶的比表面积、孔径、孔容均先增大后减小,样品G/C-0.3的比表面积和孔容最大,分别为643 m2/g和1.688 cm3/g,且其具有最大的平均孔直径(13.5 nm);而G掺杂量最多的样品G/C-2 的比表面积、孔径、孔容最小,分别为502 m2/g、7.6 nm和0.385 cm3/g。
2.2 G/C复合气凝胶的吸附性能测试
图5为复合气凝胶在暗室条件下对土霉素和布洛芬的吸附去除率随时间的变化曲线。从图5(a)可以看出所制备样品对土霉素具有很强的吸附能力。如表2所示,100 min后,样品G/C-0.3对土霉素的吸附去除率最高为90.78%。随着G含量的增加,复合气凝胶对土霉素的吸附去除率先增大后减小,这是因为G/C复合气凝胶的比表面积和孔容先增大后减小,较小的比表面积和孔容积会影响其对土霉素的吸附能力。样品G/C-2对土霉素的吸附去除率为13.06%,这是由于样品G/C-2结构是由夹心状纳米片无规则排列组成,造成其比表面积(502 m2/g)、孔容(0.385 cm3/g)非常小,因而对土霉素的吸附性能降低。
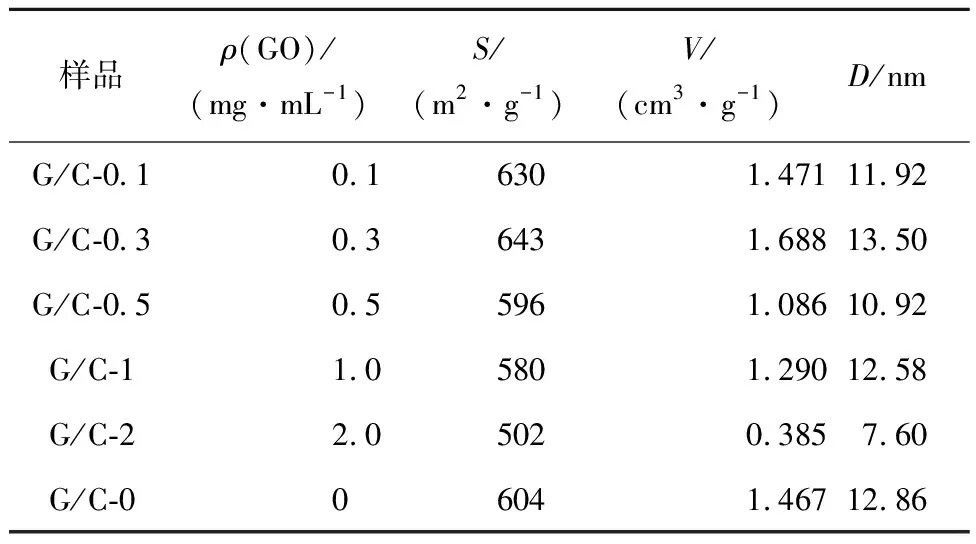
表1 不同含量G的G/C复合气凝胶的BET分析结果Tab.1 BET results of G/C composite aerogels containingG with different contents

(a) 土霉素

(b) 布洛芬
图5(b)为复合气凝胶对布洛芬的吸附去除率随时间的变化曲线。样品G/C-0.3对布洛芬的吸附去除率高于样品G/C-0,说明RF凝胶中掺入G后,对布洛芬的吸附性能提高。从表2可以看出,吸附去除率提高了6.21%,这是由于掺杂G后复合气凝胶的比表面积、孔容积增大,提高了其吸附能力。样品G/C-0.3对布洛芬的最大吸附去除率为50.11%,低于其对土霉素的吸附去除率,可能是因为土霉素结构中含有较多不饱和键,与G/C复合气凝胶中的不饱和键相互作用形成π-π结构,有利于提高复合气凝胶对土霉素的吸附能力。而布洛芬结构中含有不饱和键较少,与复合气凝胶形成π-π结构少,导致其对布洛芬的吸附能力降低。结果说明G/C复合气凝胶对土霉素、布洛芬等药物污染物具有选择性吸附作用。
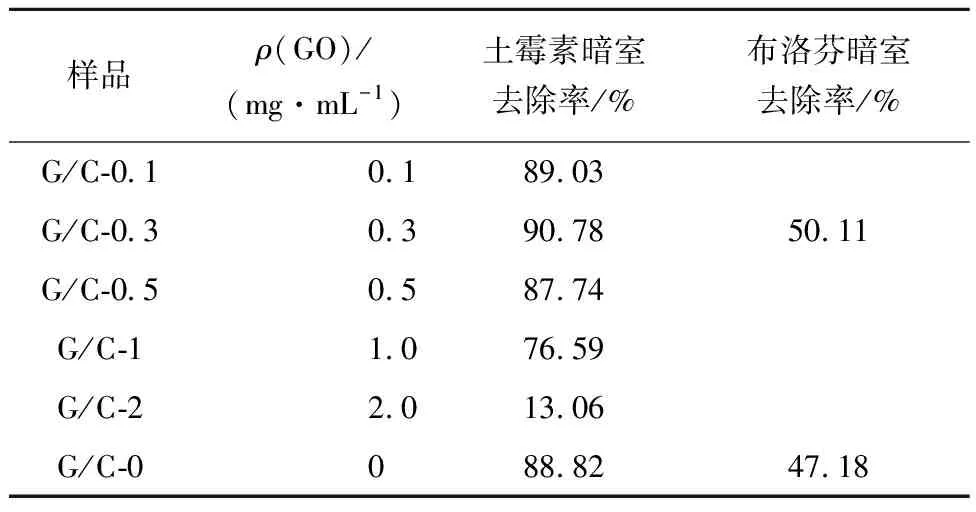
表2 不同含量G的G/C复合气凝胶对土霉素和布洛芬的去除率
图6为样品G/C-0.3在暗室条件下随时间变化对土霉素和布洛芬溶液的紫外可见吸收光谱图。从图中可以看出,随着时间的增加,溶液对紫外光的吸光度逐渐下降,说明溶液中的土霉素和布洛芬逐渐被吸附去除,证明G/C复合气凝胶对土霉素、布洛芬等水中污染物具有较高的吸附能力,特别是,G/C复合气凝胶对土霉素的吸附作用最强,紫外吸光度几乎接近于水平。
3 结 论
采用GO粉体原位分散聚合和冷冻干燥法制备湿凝胶,经700 ℃高温碳化处理后,得到G/C 复合气凝胶。所合成的G/C复合气凝胶呈现出介孔结构,具有高的比表面积(502~643 m2/g)和孔容积(0.385~1.688 cm3/g)。对G/C复合气凝胶进行吸附性能测试发现,其对水中模拟污染物土霉素、布洛芬表现出优异的吸附性能,吸附去除率分别为90.78%、50.11%。G/C复合气凝胶对水体中土霉素、布洛芬等污染物优异的吸附性能为今后药物污染的废水处理提供了一种新的方法和思路。
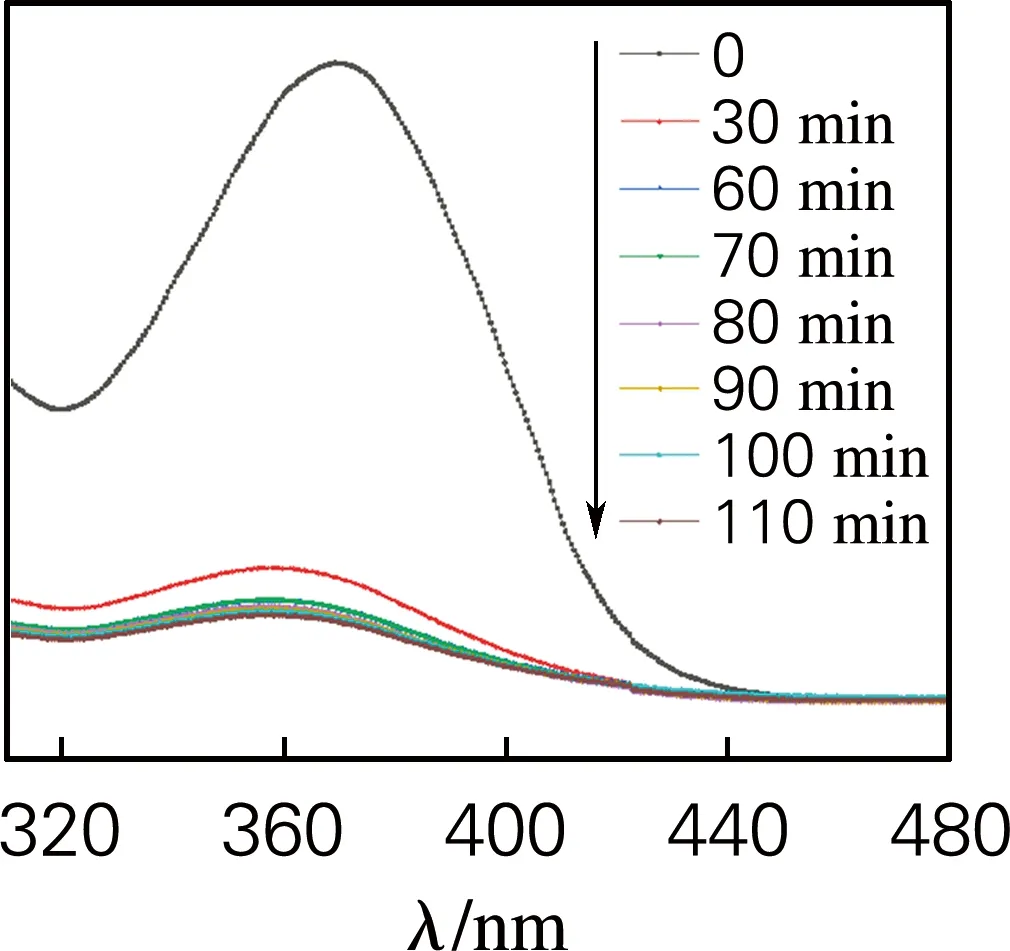
(a) 土霉素
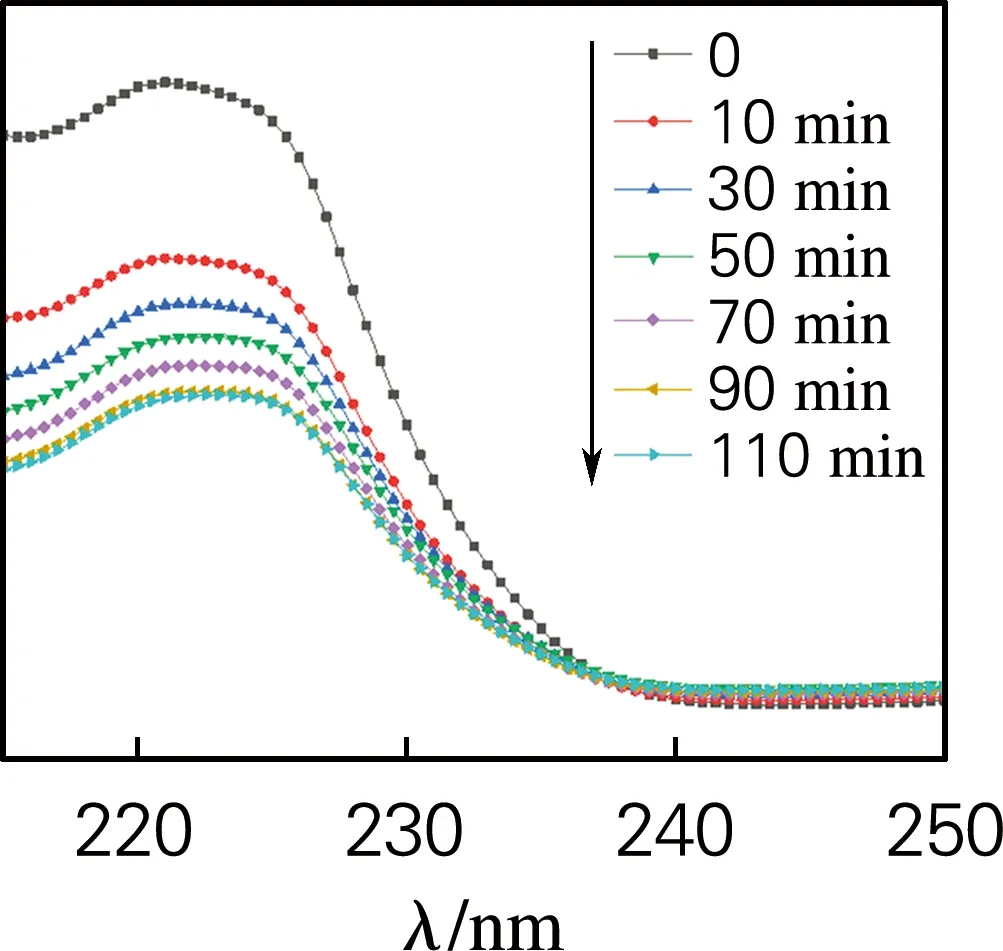
(b) 布洛芬

