胃癌患者血清IL-1的升高和癌组织JAK2/STAT3信号通路的激活
牛世伟,苏 韫*,龚红霞,李婷婷,曾元丁,张 晗,聂 蓬
(甘肃中医药大学 1.基础医学院;2.甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室,甘肃 兰州730000;3.甘肃省武威肿瘤医院 武威医学科学院 胃外科,甘肃 武威 733000)
胃癌(gastric cancer)作为世界上的常见恶性肿瘤,世界卫生组织国际癌研究机构(International Agency for Research on Cancer,IARC)最新统计数据显示,其发病率居第五位,病死率居第四位[1]。肿瘤的十大特征中就有炎性反应[2]。胃癌的最初表现为慢性胃炎,长时间的炎性反应可导致胃黏膜出现损伤,最终成为胃癌[3]。有研究报道[4],炎性因子可导致癌基因突变、细胞恶性转化及介导肿瘤的免疫逃逸。炎性细胞通过分泌多种炎性因子促进肿瘤细胞生长、侵袭及转移,同时影响肿瘤的预后。其中的IL-1和IL-10是目前研究较多的两种炎性因子,IL-1由活化单核-巨噬细胞产生,可加速炎性反应的发生发展;而IL-10可抑制炎性因子的合成与释放从而减轻炎性反应。JAK2/STAT3信号通路作为经典的炎性通路,在肿瘤中被广泛激活,参与了多种肿瘤的发生及发展[5]。本实验拟通过收集临床患者组织和血清及健康者血清标本,探讨炎性因子IL-1、IL-10和JAK2/STAT3信号通路及下游相关蛋白在胃癌发生中的作用机制。
1 材料与方法
1.1 材料
1.1.1 研究对象:选择在甘肃省武威肿瘤医院2018年1月至2018年12月手术治疗的胃癌患者及同期健康体检的人群各30例,收集患者及健康体检者的基本资料及晨起空腹静脉血。选取患者的胃癌组织、距病灶5 cm的癌旁组织及距病灶10 cm的正常组织各30例。本研究获得武威市肿瘤医院医学伦理委员会批准(伦理审批文号:WWZL-LL-2016-0001)。纳入标准:1)经病理检查诊断为胃癌的患者;2)年龄在40~60岁且预计存活周期3个月以上者;3)血常规、心、肺、肝、肾功能基本正常者。排除标准:1)身体状态差,难以耐受手术者;2)患有严重心血管疾病及其他恶性肿瘤者;3)正在参加其他药物临床研究者。
1.1.2 试剂及试剂盒:白细胞介素1(interleukin 1,IL-1)、白细胞介素10(IL-10)酶联免疫吸附测定(ELISA)试剂盒(江苏菲亚生物科技有限公司);JAK2、STAT3、pJAK2、pSTAT3、Bax和Bcl-2兔抗人多克隆抗体(Immunoway公司);DAB显色试剂盒(中国北京中杉金桥生物技术有限公司);Trizol(Ambion公司);RT-qPCR试剂盒(上海翊圣生物有限公司)。
1.2 方法
1.2.1 ELISA检测IL-1、IL-10的含量:分离患者及健康体检者血清,保存于-80 ℃冰箱;采用酶联免疫吸附实验测定血清中IL-1和IL-10水平,实验过程依据说明书严格进行,用酶标仪检测各孔450 nm处波长的吸光度(A)值。
1.2.2 免疫组化法检测Bax、Bcl-2蛋白含量:将组织固定于4%多聚甲醛中,常规包埋、切片、水化,常温3% H2O2孵育,用PBS洗涤3次后,用柠檬酸钠溶液修复抗原,分别加入Bax、Bcl-2一抗,4 ℃过夜。清洗后室温孵育二抗,30 min后PBS清洗DAB显色,封片后切片在光镜下观察并拍照。使用ImageJ软件分析平均吸光度(A)值。
1.2.3 蛋白印迹法(Western blot)检测组织JAK2、STAT3、pJAK2、pSTAT3、Bcl-2和Bax蛋白含量:提取组织蛋白,样品煮沸5 min后变性,BCA法检测蛋白浓度,配制12% SDS-PAGE胶,上样电泳,SDS-PAGE分离蛋白质后将凝胶蛋白转移至PVDF膜,加入脱脂奶粉封闭2 h后,孵育于相应一抗稀释液中4 ℃摇床过夜。第二天,TBST洗膜10 min×3次后于4℃摇床二抗孵育2 h。再用TBST洗膜3次后用ECL发光试剂曝光,使用ImageJ软件统计各蛋白条带吸光度(A)值,与内参吸光度(A)值的比值即为相对蛋白表达量。
1.2.4 RT-qPCR定量检测各组织中JAK2、STAT3、Bcl-2、Bax mRNA的含量:引物序列(表1)。取冻存组织100 mg,按Trizol法提取RNA,分光光度计测定其A260 nm/A280 nm均在1.8~2.0,采用SYBR法以cDNA为模板在实时荧光定量PCR进行检测,反应条件为:95 ℃ 5 min;95 ℃ 10 s,55 ℃ 20 s,72 ℃ 20 s,40个循环。绘制熔解曲线,根据比较Ct值法分析各基因的相对表达量,相对表达量为2-ΔΔCt。

表1 引物序列
1.3 统计学分析

2 结果
2.1 健康人与胃癌患者基线信息比较
健康人30名,其中男性14名,女性16名,平均年龄为(52.2±8.2)岁;胃癌患者30例,其中男性17例,女性13例,平均年龄为(55.5±6.3)岁,两组性别及年龄差异无统计学意义。
2.2 各组血清中IL-1、IL-10含量水平比较
与对照组相比,胃癌患者血清中IL-1含量升高,而IL-10含量下降(P<0.05)(表2)。

表2 IL-1、IL-10在各组血清中浓度
2.3 各组组织中Bax、Bcl-2含量水平比较
胃癌组织中Bax主要表达于细胞质,而Bcl-2表达于细胞核,图片中棕黄色或棕褐色颗粒为阳性表达(图1,2)。Bax在胃癌组织中的含量明显低于对照组和癌旁组,Bcl-2在胃癌组织中的含量明显高于对照组和癌旁组(P<0.05)(表3)。

A.Bax content in normal tissue;B.Bax content in adjacent tissue; C.Bax content in cancer tissue

表3 Bax、Bcl-2在各组组织中的含量
2.4 各组组织中JAK2、STAT3、pJAK2、pSTAT3、Bcl-2和Bax蛋白含量水平比较
与对照组相比,胃癌组织中JAK2、STAT3、pJAK2、pSTAT3和Bcl-2含量增加,而Bax含量减少(P<0.05)。与癌旁组织比较,癌组织中JAK2、STAT3、pJAK2、pSTAT3和Bcl-2含量增加,而Bax含量减少(P<0.05)(图3,表4)。

表4 JAK2、STAT3、pJAK2、pSTAT3、Bcl-2和Bax的含量情况
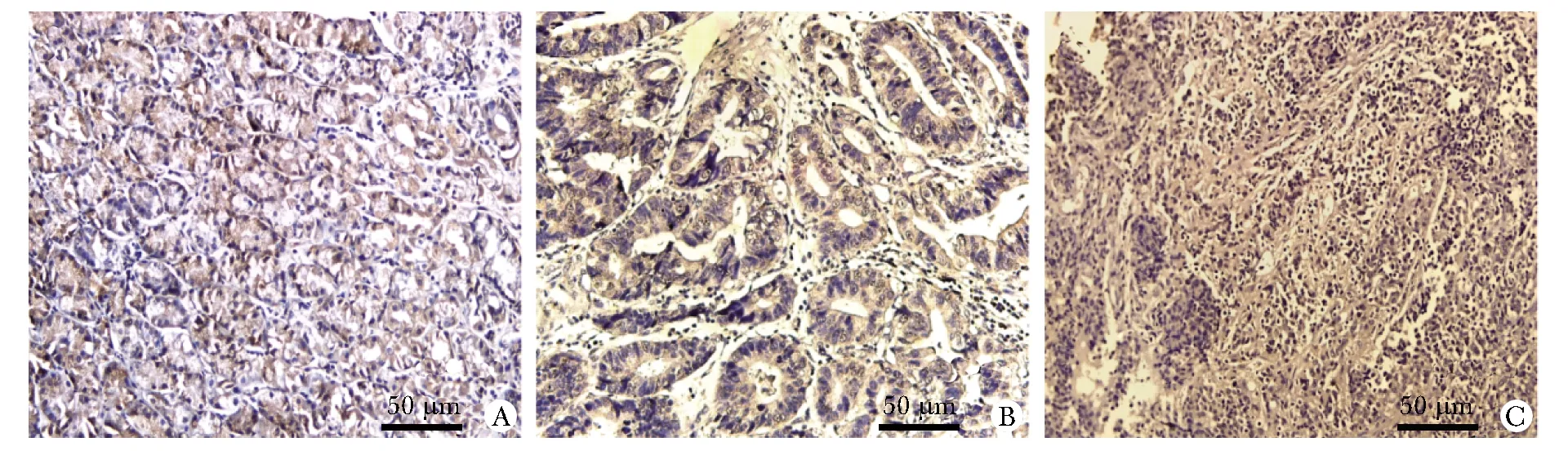
A.Bcl-2 content in normal tissue; B.Bcl-2 content in adjacent tissue; C.Bcl-2 content in cancer tissue
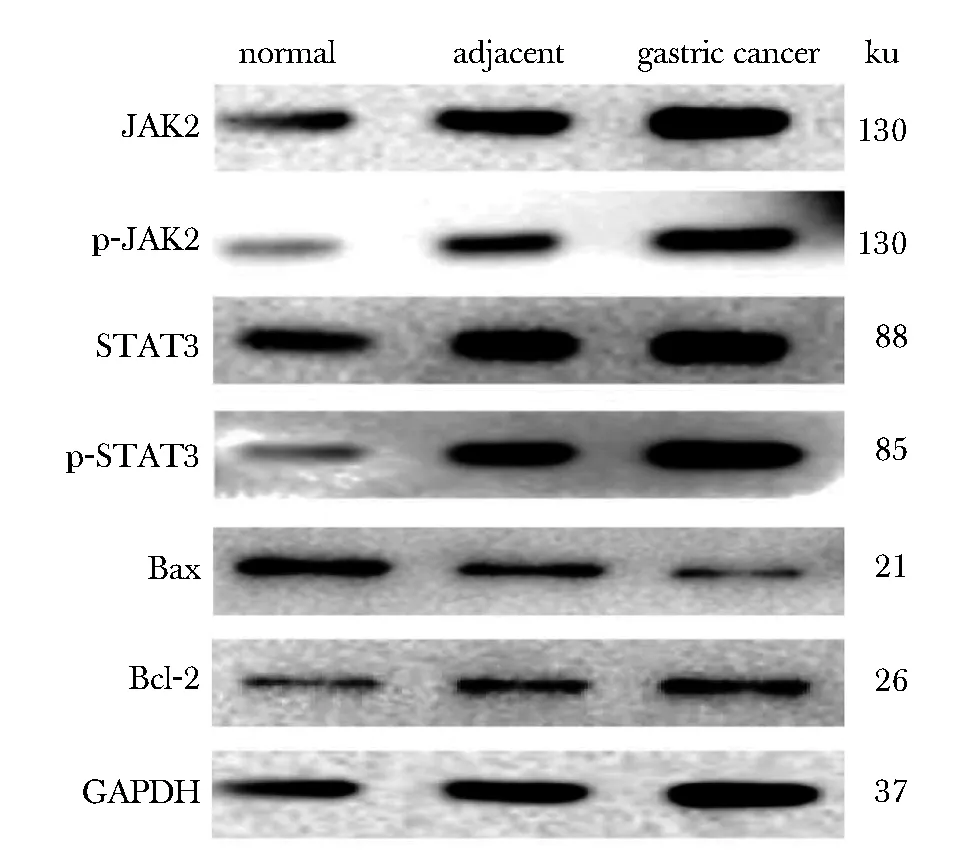
图3 JAK2、STAT3、pJAK2、pSTAT3、Bcl-2和Bax在各组组织中的含量
2.5 各组组织中JAK2、STAT3、Bcl-2和Bax mRNA含量水平比较
与对照组相比,胃癌组织中JAK2、STAT3和Bcl-2 mRNA含量增加,而Bax mRNA含量减少(P<0.05)。与癌旁组织比较,癌组织中JAK2、STAT3和Bcl-2 mRNA含量增加,而Bax mRNA含量减少(P<0.05)(表5)。

表5 RT-qPCR检测各组mRNA的含量
3 讨论
最近几年大量的报导指出IL-1和慢性炎性反应与肿瘤的发生发展紧密相关。胃癌细胞在自身生长的过程中,能通过多种方式刺激单核-巨噬细胞、上皮细胞等分泌大量的IL-1和IL-6[6-7]。有研究发现[8],在大鼠胃癌模型中,IL-10能够有效提高血清IFN-γ和IL-4的水平,降低TNF-α水平,具有一定的抗肿瘤效果。藏药二十五味驴血丸可通过提高治疗组动物血清中IL-10及降低TNF-α、IL-6、IL-17的含量水平来起到治疗关节炎的作用,其机制可能与调节JAK2/STAT3信号通路有关[9]。Bax和Bcl-2为JAK2/STAT3信号通路的下游因子,两者可形成一个凋亡调节系统,该系统参与细胞的增殖、存活,抑制细胞的凋亡和炎性[10-11]。在本研究中,与对照组相比,胃癌组中JAK2、STAT3、pJAK2、pSTAT3和Bcl-2含量均增加,而Bax含量减少,胃癌组中JAK2、STAT3和Bcl-2 mRNA含量均增加,而Bax mRNA含量减少,血清中IL-1含量增高,而IL-10含量下降,与相关文献报道一致。
综上所述,由IL-1引发的炎性反应在胃癌的发展过程中发挥了重要的作用,同时JAK2/STAT3信号通路被激活进而调控下游的Bax和Bcl-2参与胃癌异常的凋亡与增殖,通过干预胃癌前炎性反应以及开发JAK2/STAT3信号通路抑制剂可能为临床防治胃癌提供新思路。另外,IL-1、IL-10炎性细胞因子与JAK2/STAT3信号通路之间的靶向因果关系尚须在动物实验及细胞实验上进一步验证。

