金纳米-Nylon柔性膜基底的制备及其SERS性能研究
付莹莹,张 萍,郑大威,林太凤,王惠琴,吴西浩,宋佳宸
北京工业大学环境与生命学部,北京 100124
引 言
表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)技术是基于被测分子吸附在某些经特殊处理、具有纳米结构的金属表面,并且有极强拉曼散射增强效应的分子振动光谱技术[1],其广泛应用于生命科学、材料科学、环境科学、分析化学等领域。SERS活性基底的制备是SERS研究领域的热点,高活性SERS基底的发展不仅可以拓宽其应用范围,还可以作为SERS理论模型,不断推动该技术的发展。为了获得最佳SERS信号,对具有特殊性能的SERS活性基底的需求一直很大[2]。SERS活性纳米结构可以分为两种类型的基底:胶体基底和固体表面基底。目前,针对于金属胶体主要通过合成各种形貌和尺寸的贵金属纳米结构来实现对待测物的SERS检测[3]。刚性SERS固体活性基底一般采用化学刻蚀法[4]、电子束刻蚀[5]等方法刻蚀纳米阵列,可以获得很高的增强因子和光谱重复性,但通常造价昂贵,制备工艺较复杂。
目前,SERS纳米基底的研究已逐渐从传统的基于刚性基板的SERS转移到了新兴的柔性SERS技术上[6],柔性的SERS固体活性基底采用物理气相沉积法[7]等制备,但此类基底制备复杂操作繁琐,不适合在实际检测中的应用。纸基作为最常见的柔性SERS活性基底[8],其表面具有分级多孔交错排列的3D结构,金属纳米粒子可附着在表面,保持基底有足够的“热点”,从而形成SERS活性基底[9]。纸基SERS活性基底制备过程简单,易操作,有良好的柔韧性可剪裁成各种形状进行检测,并且纸基的成本低廉,可大批量制备。常见的制备方法包括浸泡法[10,14]、喷墨打印法和丝网印刷法[11-13]等。He[13]等利用静电纺丝技术在链状排列的聚乙烯醇纳米纤维中组装高SERS活性的银二聚体或定向聚集体,成功设计并合成了一种独立的柔性SERS基底,从而显著提高了SERS对4-巯基苯甲酸(4-MBA)分子的高敏感性,其增强因子高达109。Dalla[14]等用浸涂法将Au和Ag附着在滤纸上,探索一系列参数(胶体溶液浓度、滤纸孔隙度、聚合剂存在)的改变对纸基SERS活性基底性能的影响结果。Wang[15]等在聚乙烯醇吡咯烷酮(PVP)的作用和辅助下,利用N,N-二甲基甲酰胺(DMF)对AgNO3的还原,制备了锐边为20 nm的三角形Ag纳米颗粒,然后将Ag纳米三角形附着到滤纸上,获得了具有良好活性和重复性的柔性SERS基底,实现了对10-8mol·L-1浓度的对氨基噻吩酚(PATP)的超痕量检测。但上述方法耗时长,对原辅料的加工有严格的要求把控,并且对于实际应用的操作也较为复杂及繁琐。Nylon柔性膜与纸类似,其表面也具有分层、多孔结构,Nylon柔性膜具有性质稳定,可长期储存等优点,纳米颗粒可以良好地附着在Nylon柔性膜表面,另外Nylon柔性膜的亲水性、大通量、流速快等性能,使得在制备过程中操作简单并且流畅;在SERS活性基底的检测过程中,Nylon柔性膜中溶剂残留少和蛋白吸附力低的特点,可减少其他物质对实验的影响。本研究以 Nylon柔性膜作为柔性材料,利用固相萃取过滤装置,将金纳米颗粒均匀地附着在Nylon柔性膜上,制备Au-Nylon柔性膜基底。同时,以结晶紫CV作为探针分子,研究了Au-Nylon柔性膜基底的SERS活性、均匀性及检测限,并对金黄色葡萄球菌(Staphylococcusaureus)进行SERS检测,验证其在生物样品SERS检测的适用性,为SERS活性基底的研究提供新颖的思路与方法。
1 实验部分
1.1 试剂与仪器
便携式激光拉曼光谱仪(RamTracer-200,欧普图斯光学纳米科技有限公司),激发波长785 nm,激发功率250 mW;紫外-可见-近红外分光光度计(UH4150,日本日立公司);场发射扫描电子显微镜(F50,日本电子公司);恒温震荡培养箱(NB-205V,韩国 N-BIOTEK公司);集热式恒温加热搅拌器(DF-101S,上海邦西仪器科技有限公司)。
氯金酸(HAuCl4·4H2O)、硝酸(HNO3)均购自国药集团化学试剂有限公司;柠檬酸三钠(C6H5Na3O7)购自美国Alfa Aesar公司;盐酸(HCl)购自北京化工厂;Nylon柔性膜来自艾杰尔公司;S.aureus购买自中国普通微生物菌种保藏管理中心;胰蛋白胨大豆肉汤培养基(tryptone soy broth,TSB)和营养肉汤培养基(nutrient broth,NB)购自北京陆桥技术股份有限公司;结晶紫(crystal violet,CV)和罗丹明(R6G)购自Amresco公司;实验用水均为Millipore (Direct-Q 8UV-R)所制超纯水(18.2 mΩ)。
1.2 金溶胶的制备
采用Lee和Meisel[16]的合成方法,以柠檬酸钠为还原剂制备金溶胶溶液于100 mL三口圆底烧瓶中。首先吸取50.00 mL质量分数为0.01%的氯金酸溶液中加热搅拌至微沸20 min,然后再加入0.20 mL质量分数为1%的柠檬酸钠溶液,继续搅拌并保持微沸30 min,当溶液变为酒红色时,停止加热,自然冷却至室温,避光储存于4 ℃冰箱保存,备用。
1.3 Au-Nylon柔性膜基底的制备
将注射器连接装有单位面积1 cm2的Nylon柔性膜的过滤头,另一端连接在固相萃取装置,注射器中加入金溶胶,抽滤,控制流速为1 mL·min-1,然后将Nylon柔性膜取出,置于冷冻干燥机中,冷冻干燥1 h,取出备用(图1)。依据上述操作,按表1处理1~2次,制备不同条件的Au-Nylon柔性膜基底。
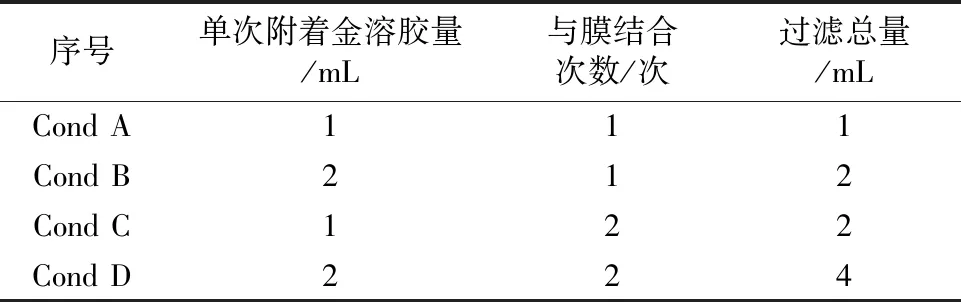
表1 Au-Nylon柔性膜基底的制备条件Table 1 Preparation conditions of Au-Nylon flexible film substrate
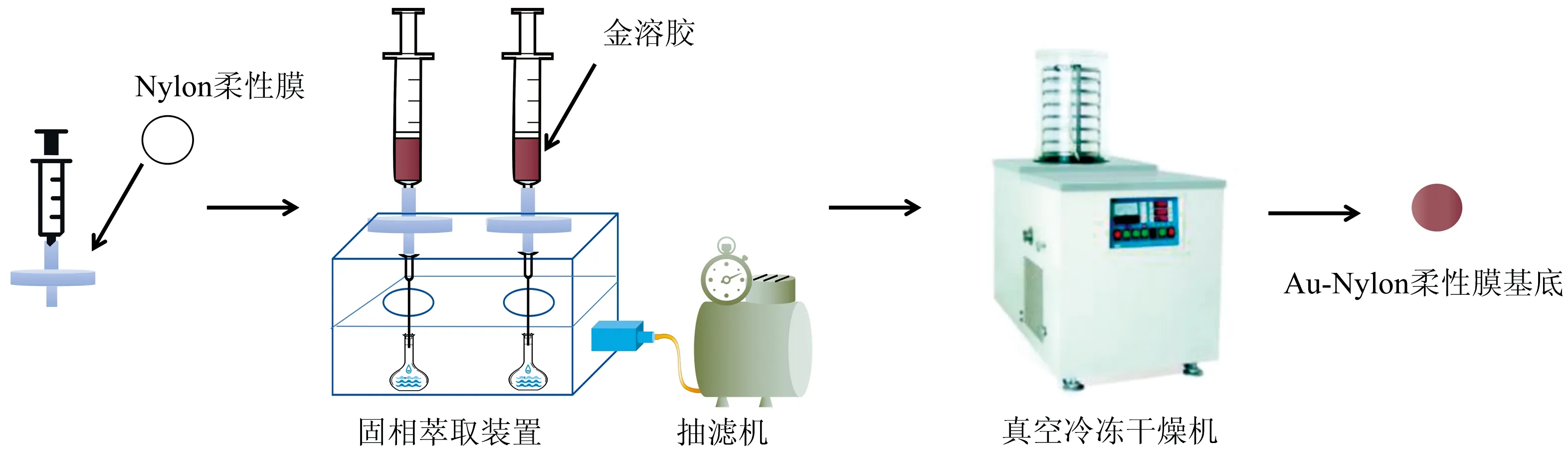
图1 Au-Nylon柔性膜基底的制备流程Fig.1 Preparation process of Au-Nylon flexible film substrate
1.4 样品
S.aureus菌液样品制备:将S.aureus接种于TSB培养基中,37 ℃,110 r·min-1震荡培养约4 h,使用紫外-可见-近红外分光光度计测定OD(600 nm)为1时,停止培养,备用,此时细菌数量约为109。
结晶紫溶液的制备:准确称取0.02 g结晶紫(CV),用去离子水配制成浓度为1×103mol·L-1的储备液,再逐级稀释到浓度为1×10-3,2.5×10-5,1×10-5,1×10-6,5×10-7及1×10-7mol·L-1的CV使用液,备用。
罗丹明溶液的制备:准确称取0.02 g罗丹明(R6G),用去离子水配制成浓度为1×103mol·L-1的储备液,再将浓度稀释到1×10-6的罗丹明使用液,备用。
2 结果与讨论
2.1 Au-Nylon柔性膜基底的表征
利用扫描电子显微镜对按表1中不同条件制备的Au-Nylon柔性膜基底进行表征,探究金纳米颗粒在Nylon柔性膜上的分布情况。不同金纳米颗粒的附着量和与膜结合次数对金纳米颗粒在Nylon柔性膜分布呈规律性的变化,由图2(a)所示。空白Nylon柔性膜是多孔交错排列的结构,其表面没有球形颗粒物,而Cond A—D的SEM图可以看出Nylon表面均有附着不同数量的金纳米颗粒,Nylon附着金颗粒的量随着金溶胶过滤量增加而增加(见Cond A和Cond B),其较均匀地分布在纤维上。从Cond A与Cond C之间、Cond B与Cond D之间的SEM图可以看出,Cond C和Cond D表面有大量的金纳米颗粒,随着与膜结合次数的增加Nylon表面的金颗粒明显增多,通过SEM观察出大量的金纳米颗粒覆盖在Nylon柔性膜的表面,并且Cond C表面的金纳米颗粒比Cond D分布更均匀,Cond D表面的金纳米颗粒出现较为明显的团聚现象。同时,研究还发现当金溶胶总量一定时,与膜结合次数增加,附着在Nylon柔性膜表面的金纳米颗粒也明显增加(Cond B和Cond C)。由此可见,前一次处理后的Nylon纤维和其表面附着的金纳米颗粒形成了新的活性截留层,能使再次结合的溶胶中金颗粒更好地附着在表面。由于SERS检测主要针对表面进行,所以在Nylon柔性膜表面附着更多的金颗粒更有利于待测物的SERS检测。
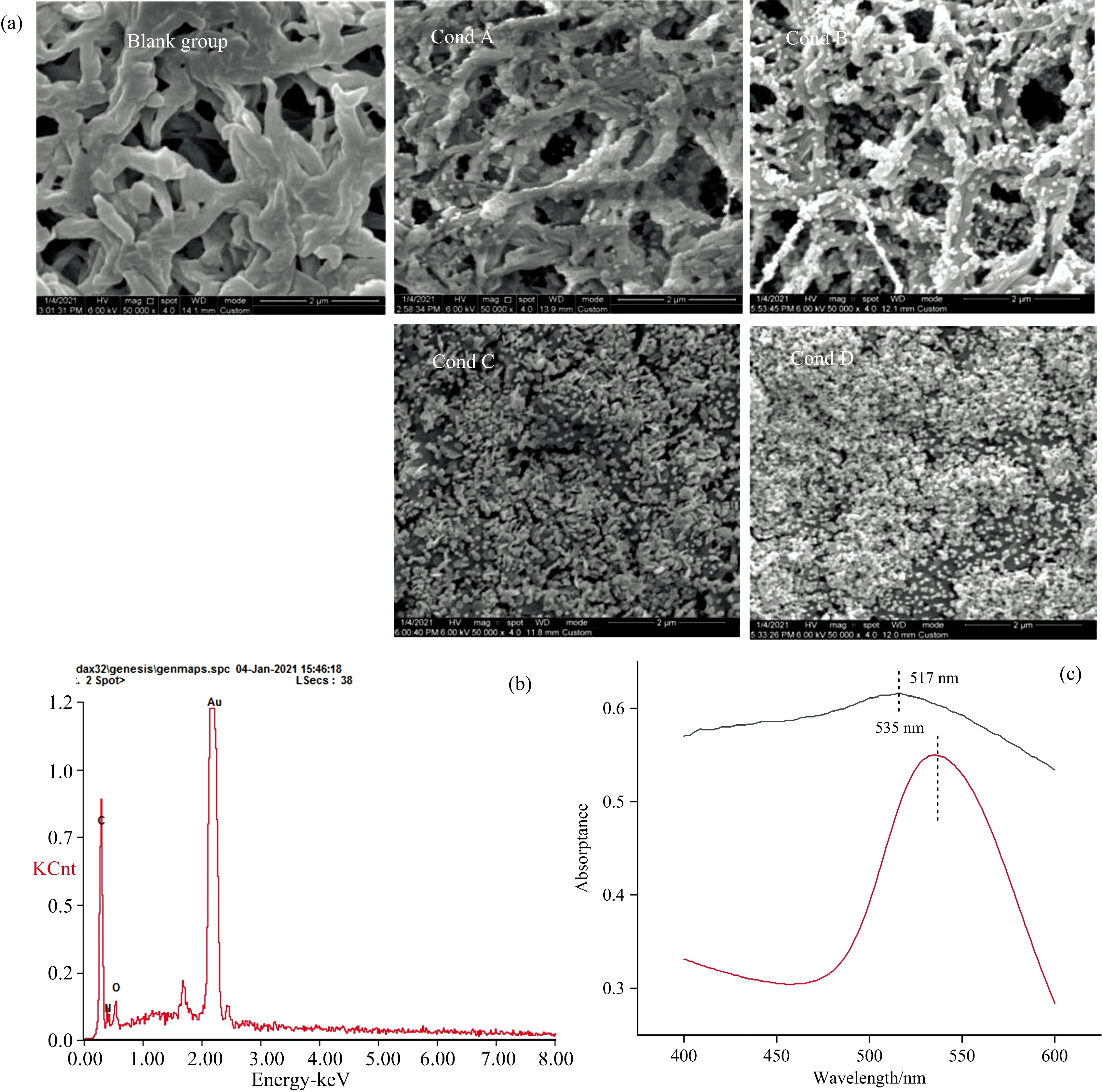
图2 Au-Nylon柔性膜基底的SEM(a)、EDS(b)及紫外-可见-近红外光谱图(c)Fig.2 SEM (a),EDS (b)and UV-Vis-NIR (c)spectra of Au-Nylon flexible film substrate
为验证Au-Nylon柔性膜基底主要成分和含量,选择金纳米颗粒附着较为均匀的Cond C样品进行光电子能谱(EDS)测试,如图2(b)可知,Au-Nylon柔性膜基底表面覆盖了大量金纳米颗粒,Au的相对含量为75.41%,其他O,N和C元素相对含量低。
图2(c)是金溶胶溶液及Au-Nylon柔性膜基底的紫外-可见-近红外光谱图,从图中可以看出金溶液的等离子共振吸收峰在535 nm,而Au-Nylon柔性膜基底的最强等离子共振吸收峰发生了蓝移,出现在512 nm。这可能是由于金纳米颗粒所处的环境发生变化,金纳米颗粒与Nylon柔性膜发生了耦合反应,金纳米颗粒受到一定的束缚造成的。Au-Nylon柔性膜基底的最大吸收高于金溶胶,这是主要由于在Au-Nylon柔性膜基底的金纳米颗粒的含量高于金溶胶,单位面积的金纳米颗粒数增大,可能会提高金纳米颗粒与被测物的碰撞几率,更有利于SERS信号的增强。
2.2 复合膜的SERS表征
不同方法制备的Au-Nylon柔性膜基底,其表面的金纳米颗粒分布有很大的差异。为了研究这些差异是否对Au-Nylon基底的SERS活性产生影响,实验以10-5mol·L-1的CV溶液作为探针分子,进行Au-Nylon的SERS活性检测,结果如图3(a)所示。从图中可以看出,Cond B的SERS信号明显强于Cond A,随着金溶胶体积的增加,Nylon柔性膜附着的金颗粒的增多,使得Au-Nylon对CV的SERS活性更好。同时,两次处理后的Au-Nylon(Cond C和Cond D)的SERS活性明显好于单次处理的Au-Nylon(Cond A和Cond B)。值得注意的是,金溶胶总体积一致时,Cond C(1 mL·次-1,2次)的SERS信号比Cond A(2 mL·次-1,1次)有明显增强,分析认为两次处理后的金纳米颗粒主要附着在Nylon柔性膜表面[见图3(a)],说明Au-Nylon表面的金纳米颗粒对SERS信号的增强起主导作用。附着在Nylon柔性膜表面上的金纳米颗粒会形成一些SERS“热点”,这些SERS“热点”的形成是由于金纳米颗粒之间的聚集,纳米颗粒间形成纳米间隙,导致颗粒之间的耦合作用增强,从而提供的“热点”逐渐增多;但当金纳米颗粒过饱和时,影响了“热点”的分布,金纳米颗粒之间的纳米间隙发生改变,使得SERS信号减弱[17]。因此,尽管Cond D的Au-Nylon表面的金纳米颗粒多于Cond C的Au-Nylon基底,但是由于表面金纳米颗粒过多而发生聚集,影响“热点”的形成,使得Cond D的SERS活性反而弱于Cond C的SERS活性。
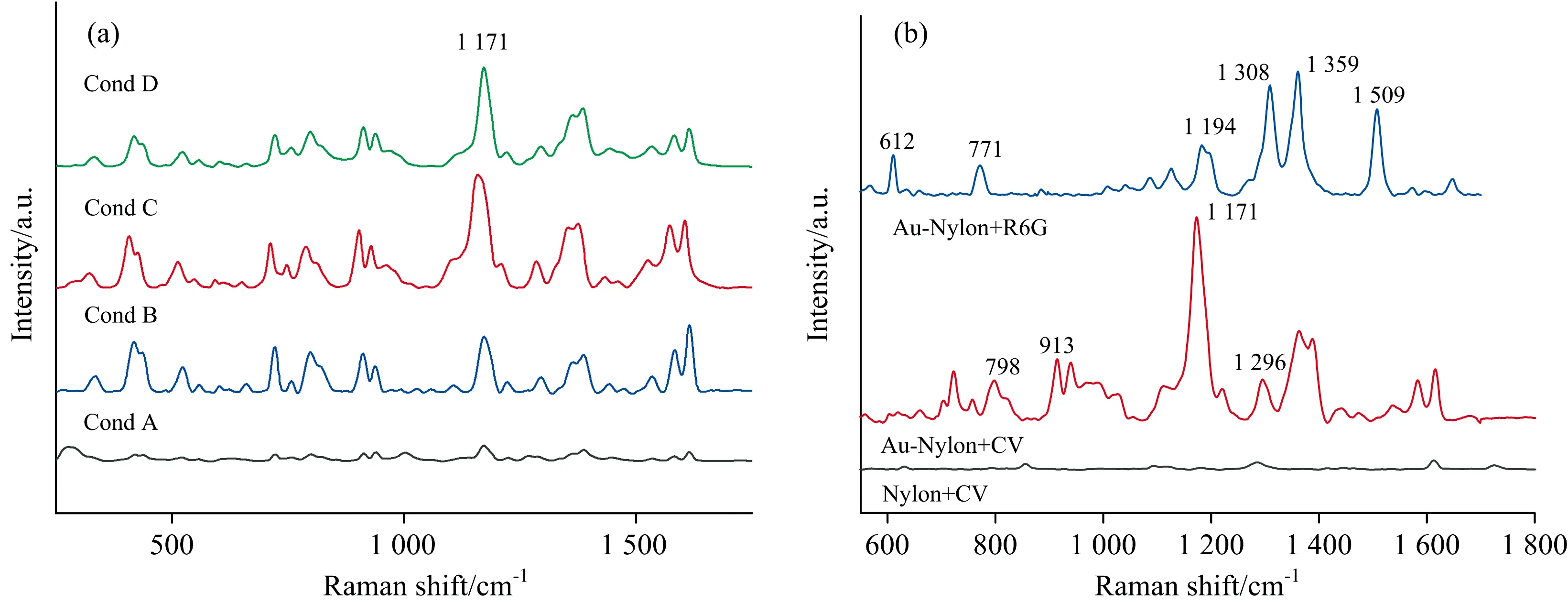
图3 不同制备条件的Au-Nylon柔性膜基底对CV探针分子的SERS检测(a)及 Nylon柔性膜和Au-Nylon柔性膜基底对CV探针分子和R6G探针分子的SERS谱图(b)Fig.3 SERS spectra of Au-Nylon flexible membrane substrate at different conditions on CV probe molecules (a)and SERS spectra of Au-Nylon flexible membrane substrate and Nylon flexible membrane on CV probe molecules and R6G probe molecules (b)

2.3 Au-Nylon柔性膜基底的SERS的检测限及增强因子
为测试Au-Nylon柔性膜基底的SERS检测限,实验将浓度为2.5×10-5,1×10-5,1×10-6,5×10-7及1×10-7mol·L-1的CV探针分子溶液滴加在Au-Nylon柔性膜基底上,然后进行SERS检测,结果如图4(a,b)所示。结果表明,随着CV探针分子溶液浓度的降低,CV探针分子在Au-Nylon柔性膜基底上的SERS信号强度逐渐降低,当CV溶液的浓度低至1×10-7mol·L-1时,CV探针分子的特征SERS信号几乎检测不到,说明Au-Nylon柔性膜基底可以检测到5×10-7mol·L-1的CV探针分子,不同浓度CV的1 171 cm-1处的拉曼峰强与浓度之间呈现正相关关系,相关系数达到0.916。
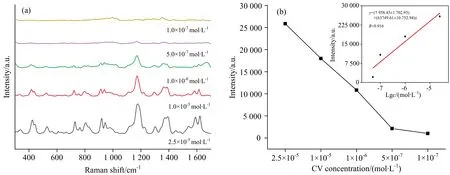
图4 Au-Nylon柔性膜基底对CV溶液定量分析(a)和1 171 cm-1处峰强与浓度线性关系(b)的SERS检测极限图谱Fig.4 Quantitative analysis of CV solution with Au-Nylon flexible membrane substrate (a)and linear relationship between peak strength and concentration at 1 171 cm-1 (b)
对Au-Nylon柔性膜基底的增强因子(enhancement factor,EF)进行计算[19],见式(1)
EF=(ISERS/cSERS)/(Iref/cref)
(1)
式(1)中,ISERS和cSERS分别表示吸附在基底上的CV探针分子的SERS信号强度和浓度。Iref和cref分别表示吸附在锡纸基底上的CV探针分子的非SERS的散射强度和浓度。以本基底检测CV溶液浓度1.0×10-6mol·L-1作为cSERS,以非SERS散射检测CV溶液的最低浓度103mol·L-1作为cref。选用1 171 cm-1处的拉曼峰的强度来计算EF。经计算Au-Nylon柔性膜基底的SERS增强因子为1×104。
2.4 Au-Nylon柔性膜基底的均一性与重复性分析
金纳米颗粒均匀的分布在SERS活性基底表面会产生更多的SERS“热点”,因此Au-Nylon柔性膜基底的均一性对待测样品的SERS检测有着重要的实际意义[17]。为了研究所制备的Au-Nylon柔性膜基底的均匀性,实验将5×10-7mol·L-1的CV溶液滴加在Au-Nylon柔性膜基底上,随机选取15个不同的点进行SERS检测,图5(a)为15个点SERS谱图,不同颜色表明Au-Nylon柔性膜基底的SERS强度。结果表明,随机选取的15个点的CV探针分子SERS图谱的峰形和特征峰的强度基本一致,不同拉曼峰均在相同峰强区域,特征峰1 171 cm-1处的SERS强度大部分处于蓝色区域。进一步的对Au-Nylon柔性膜基底的均匀性进行研究,统计并分析特征峰1 171 cm-1处的SERS信号强度,结果如图5(b)所示,15个不同点在1 171 cm-1处的SERS信号强度的RSD为11.8%,进一步说明研究中所制备的Au-Nylon柔性膜基底具有较好的均匀性。
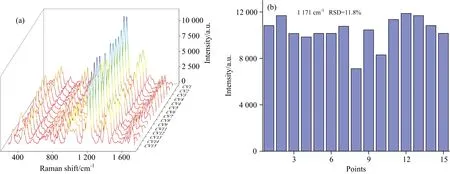
图5 15个不同点 的SERS图谱(a);CV在1 171 cm-1处的柱状体(b)Fig.5 SERS collected from 15 different points (a);Histogram of the peak of CV at 1 171 cm-1 (b)
批间重复性也是评价SERS基底的一个重要指标。本实验制备5批Au-Nylon柔性膜基底,以10-5mol·L-1的CV作为探针分子,探索基底的不同批次的重复性,图6展示了5批Au-Nylon柔性膜基底对CV进行SERS测试的拉曼光谱图(其中每一批均为重复测定了10次后的平均谱图),表2为CV的特征峰(798,913,1 171和1 296 cm-1)的峰强RSD,结果显示不同批次CV特征峰的相对标准偏差(RSD)约为15%,因此不同批次可擦拭柔性SERS基底有着良好的重现性。
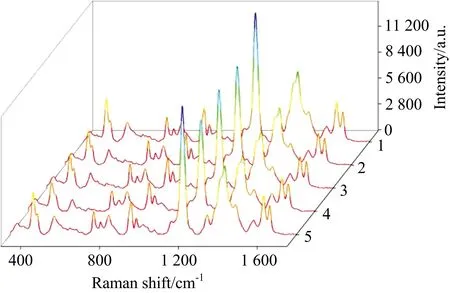
图6 Au-Nylon柔性膜基底(5批)对CV的SERS谱图Fig.6 SERS diagram of Au-Nylon flexible membrane substrate (5 batches)for CV

表2 不同批次的Au-Nylon柔性膜基底对CV的RSD分析Table 2 RSD analysis of different batches of Au-Nylon flexible membrane substrates for CV
2.5 Au-Nylon柔性膜基底在细菌SERS检测中的应用
Nylon柔性膜具有对蛋白吸附力低,在检测细菌时减少了其他蛋白物质对SERS结果的影响。为了探究Au-Nylon柔性膜基底对细菌的SERS检测能力,将金溶胶和Au-Nylon柔性膜基底对S.aureus的SERS检测进行对比,结果见图7。结果表明,空白Nylon柔性膜和Au-Nylon柔性膜基底的本底SERS信号较弱,对检测无影响;Au-Nylon柔性膜基底对S.aureus的SERS信号有明显的增强,且峰型清晰并高于液体金溶胶对S.aureus的增强作用。从图7可以看出S.aureus的特征峰主要有734,962,1 031,1 235,1 314,1 350和1 460 cm-1,与Zheng等[20]的研究结果基本相吻合。由此可见,本方法所制备的SERS活性基底,可以很好地响应细菌的拉曼特征信息,具有微生物SERS检测的应用前景。
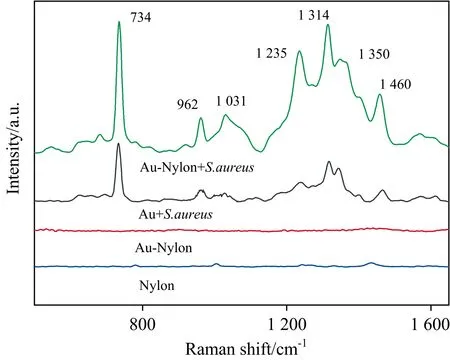
图7 金溶胶、Nylon柔性膜以及Au-Nylon柔性膜基底对S. aureus的SERS图谱Fig.7 SERS spectra of S. aureus with gold colloid,Nylon film and Au-Nylon flexible film substrate
3 结 论
利用固相萃取过滤装置,将金纳米颗粒均匀的附着在Nylon柔性膜上,制备了Au-Nylon柔性膜基底。以扫描电子显微镜作为表征技术,以结晶紫CV为SERS探针分子,对Au-Nylon柔性膜基底的结构及SERS性能进行分析,发现Nylon纤维与其所附着的金纳米颗粒形成新的活性截留层,将再次处理的金纳米颗粒均匀地附着在柔性膜表面,形成SERS“热点”,提高了Au-Nylon柔性膜基底的SERS活性,Au-Nylon柔性膜基底对CV的检测极限达到5×10-7mol·L-1,增强因子达到1×104。同时,Au-Nylon柔性膜基底具有较好的均匀性,相对平均偏差为11.8%。此外,Au-Nylon柔性膜基底能对金黄色葡萄球菌(S.aureus)进行SERS检测,且SERS性能高于液体金溶胶。综上所述,Au-Nylon柔性膜基底具有良好的均一性和重复性,并具有较好的SERS活性,该方法具有简单且易批量制备的优点,无论在化合物检测还是微生物检测中都具有良好的实际应用价值。

