基于GC-MS分析短波紫外线处理采后香蕉挥发性组分
陈铭中 ,秦小明,钟旭美,林海生
1广东海洋大学食品科技学院,湛江 524088;2阳江职业技术学院食品与环境工程系; 3阳江市功能性食品研发与质量评价重点实验室,阳江 529566
香蕉(Musaspp.)是世界上第四大消费水果,在中国水果产量位居第五,其中广东、广西和海南等地是主要产区[1]。香蕉营养丰富,含多种人体所需的微量元素,其收获后不耐贮藏,容易腐烂变质,而挥发性组分是评价香蕉等果蔬的新鲜程度的重要品质指标。固相微萃取(solid phase microextraction,SPME)具有无污染、成本低、操作简单方便等优点[2],是目前样品中挥发性组分测定的一种常用的前处理技术。SPME与GC-MS联合测定样品的挥发性组分是广泛应用的一种模式,要得到研究样品的挥发性组分并准确地鉴定混合物的化学成分,其关键的技术包括合适的萃取头、萃取条件、获取的质谱数据的质量、丰富的质谱库和良好的定性鉴定参数。目前关于香蕉挥发性组分的报道较多,Tao等[3]应用PDMS萃取头分析鉴定出成熟香蕉的挥发性组分39个;Zhu等[4]采用SPME-GC-MS对不同成熟阶段香蕉的挥发性组分进行了鉴定分析,确定了黄熟阶段香蕉的挥发性组分主要有41个;Shen等[5]以SPME-GC-MS分析成熟与未成熟香蕉中的挥发性组分,比较了二者的化学成分差异,鉴定出成熟香蕉有30个挥发性组分。近年来根据报道,应用合适剂量的短波紫外线(short-wave ultraviolet,UV-C)用于水果和蔬菜的保鲜,能够增强果蔬的防御系统,减少外界因素的伤害,提高果蔬的品质和延长其贮藏时间[6]。尽管已有采用SPME-GC-MS分析香蕉挥发性组分的报道,但有关UV-C处理后贮藏至黄熟期的香蕉挥发性组分差异的研究尚未见报道。
本研究将在正交试验设计优化组合得到寻找SPME萃取的最优参数基础上,采用MS-DIAL软件减少重叠峰、背景信号的干扰,鉴定出香蕉的挥发性组分,进而通过数理统计分析手段比较UV-C处理后香蕉的挥发性组分差异,评价UV-C处理采后香蕉的贮藏对其香气的影响效果。
1 材料与方法
1.1 材料与试剂
本实验以成熟香蕉果肉为实验材料。氯化钠(国药集团化学试剂有限公司);分析纯 2-辛醇(上海源叶生物科技有限公司);标准品正构烷烃混标(C7~C40,1 000 μg/mL;GC≥99.5%)(上海安谱实验科技股份有限公司)。
1.2 仪器与设备
QP2020型气相色谱-质谱联用仪(GC/MS;日本岛津仪器有限公司);岛津 SH-Rxi-5Sil MS 气相色谱柱;50/30 μm DVB/CAR/PDMS、100 μm PDMS、65 μm PDMS/DVB、75 μm CAR /PDMS萃取头,SPME手动进样器(美国Supelco公司);SPME专用衬管(岛津(上海)有限公司);90-2A磁力加热搅拌器(天津市赛得利斯实验分析仪器制造厂);SHT -060SD超声波清洗机(深圳市深华泰超声洗净设备有限公司);FA224电子天平(上海舜宇恒平科技仪器有限公司);A11分析研磨机(德国IKA公司)。
1.3 实验方法
1.3.1 SPME萃取头的选择[7]
准确称取4份2.0 g经均匀研磨的香蕉果肉,分别置于20 mL 的顶空瓶中,加入饱和氯化钠溶液5 mL,盖上顶空瓶盖,放入恒温加热磁力搅拌器中,在40.0 ℃、800 rpm转速磁力搅拌器上搅拌5 min。均匀后,在超声波清洗机中超声平衡20 min,在40.0 ℃水浴,用4种老化后不同的萃取头DVB/CAR/PDMS、PDMS、PDMS/DVB、CAR/PDMS分别插入顶空瓶中萃取40 min。萃取结束后,注入GC仪解析3 min,进行GC-MS分析。根据总峰面积结合鉴定峰数目,分析不同萃取头的影响。
1.3.2 SPME萃取前超声平衡时间的影响[8]
准确称取5份2.0 g经均匀研磨的香蕉果肉,分别置于20 mL的顶空瓶中,加入饱和氯化钠溶液5 mL,盖上顶空瓶盖,放入恒温加热磁力搅拌器中,在40.0 ℃、800 rpm搅拌器搅拌5 min。均匀后,分别在超声波清洗机中超声平衡10、15、20、25、30 min,用“2.1”项优选的萃取头插入顶空瓶中萃取40 min。萃取结束后,注入气相色谱仪解析3 min,进行GC-MS分析。根据总峰面积结合总峰数目,分析超声平衡时间的影响。
1.3.3 SPME萃取样品量的影响[9]
准确称取2.0、3.0、4.0、5.0、6.0 g经均匀研磨的香蕉果肉,分别置于20 mL的顶空瓶中,加入饱和氯化钠溶液5 mL,盖上顶空瓶盖,放入恒温加热磁力搅拌器中,40.0 ℃,转速为800 rpm磁力搅拌器上搅拌5 min,均匀后,分别于在超声波清洗机中超声平衡20 min,用“2.1”项优选的萃取头插入顶空瓶,40.0 ℃水浴萃取40 min。萃取结束后,注入气相色谱仪解析3 min,进行GC-MS分析。根据总峰面积结合总峰数目,分析样品加入量的影响。
1.3.4 SPME萃取温度的影响
准确称取5份2.0 g经均匀研磨的香蕉果肉,分别置于20 mL的顶空瓶中,加入饱和氯化钠溶液5 mL,盖上顶空瓶盖,放入恒温加热磁力搅拌器中,40.0 ℃,转速为800 rpm磁力搅拌器上搅拌5 min,均匀后,在超声波清洗机中超声平衡20 min,用“2.1”项优选的萃取头插入顶空瓶,分别于30.0、40.0、50.0、60.0、70.0 ℃水浴萃取40 min。萃取结束后,注入GC-MS联用仪解析3 min,进行GC-MS分析。根据总峰面积结合总峰数目,分析萃取温度的影响。
1.3.5 GC-MS条件
参考Dou等[10]的实验条件,并稍做修改。
色谱条件:SHIMADZU SH-Rxi-5sil MS(30 m×250 μm×0.25 μm)毛细管色谱柱,载气为氦气,其他色谱条件进行比较筛选后确定。程序升温,初始温度40 ℃,保持1 min;以2 ℃/min的速率升至60 ℃;保持2 min;再以5 ℃/min的速率升至150 ℃,保持2 min;以10 ℃/min的速率升至180 ℃,保持1 min;载气为高纯氦(He),流速为1.0 mL/min;进样口温度为220 ℃,不分流。
质谱条件:EI电离源;电子能量70 eV,电压350 V,扫描范围m/z35~400。
1.4 正交试验设计
根据单因素试验结果,确定SPME萃取的超声时间、样品量和温度3个水平(见表1),选用L9(34)正交表进行超声时间、样品量和萃取温度三个参数优化组合,以总峰面积为评价指标进行分析,由正交试验的结果得到的组合进行验证试验。
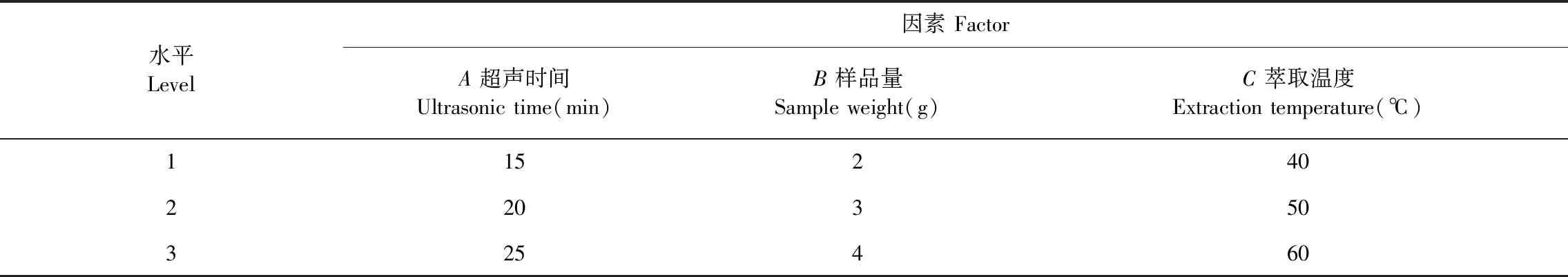
表1 正交试验因素与水平Table 1 Factors and levels of orthogonal experiment
1.5 UV-C处理组和对照组香蕉的挥发性组分定性和定量分析
1.5.1 香蕉样品
绿熟香蕉采摘于广东省阳春市果园,八成熟,挑选大小一致、无病害、无损伤的香蕉,当天运回实验室,把香蕉去柄分开,用自来水缓慢清洗香蕉果实表面物理杂质,再用蒸馏水润洗三遍,风扇晾干,随机分为对照组和UV-C处理组。根据前期实验,确定UV-C处理组照射剂量为0.02 kJ/m2剂量。先将UV-C灯(飞利浦,20 W)打开,待能量稳定后,用0.02 kJ/m2剂量的紫外线照射香蕉,对照组不照射。对照组和处理组香蕉放置于恒温恒湿箱(温度25 ℃、湿度85%)中避光贮藏,在第18天采对照组和处理组样品,将香蕉果肉快速切碎,用液氮预冷后研磨成匀浆,用于GC-MS测定。
1.5.2 Kováts保留指数(RI)测定
取稀释浓度至100 μg/L的正构烷烃C7~C40混合标准溶液1.0 μL,按“1.3.5”的GC-MS条件测定,在AMDIS软件建立本实验的保留指数校正库(RIcal),采用Kováts程序升温公式[11]计算挥发物的实际保留指数值(RIact),RIact计算公式如式(1)。
(1)
式中,RIact为本实验条件下的实际保留指数值,n为正构烷烃的碳原子数,tR(x)为待鉴定的挥发性组分的保留时间,tR(n)、tR(n+1)分别为最邻近挥发性组分x的正构烷烃的保留时间,tR(n)位于组分x的左侧,tR(n+1)位于组分x的右侧。
1.5.3 定性和定量分析
应用正交试验优化后的参数进行香蕉挥发性组分的HS-SPME萃取和GC-MS测定,将原始数据在岛津GC-MS工作站中转为CDF格式,导入MS-DIAL ver 4.48软件进行色谱峰解卷积、匹配、对齐等处理[12]后,得到MSP文件,导入NIST 17质谱库进行组分搜索与鉴定,鉴定选取的参数是未知组分在NIST 17质谱库中的正向匹配度(match factor,MF)、反向匹配度(reverse match factor,RMF)均≥800,同时参考未知组分的RIact值与NIST 17质谱库的RI参考值(RIref)最接近原则,确定该组分名称。将组分信息数据导入SIMCA 14.1软件进行正交偏最小二乘法判别分析(OPLS-DA),根据P<0.05与差异倍数(fold change,FC)>1.2或FC<0.83筛选出对照组和处理组的差异组分,应用R言语绘制火山图。
采用内标法进行半定量分析,内标物2-辛醇的浓度为0.99 mg/mL,加标体积为5.0 μL,计算公式如式(2):
(2)
式中:Cx为某挥发性组分的浓度,Ax为某挥发性组分的峰面积,Cs为添加到香蕉样品中的内标物2-辛醇的浓度,As为内标物2-辛醇的峰面积。
2 结果与分析
2.1 SPME萃取头的选择
SPME联合GC-MS进行挥发性组分测定能够有效地分析出食品中的挥发性组分,是目前最常用和有效的分析方法,而选择合适的SPME萃取头是十分关键的步骤[2]。SPME萃取头的纤维涂层不同,极性和吸附对象也不同,对研究对象的萃取效果会有很大差异。本研究应用DVB/CAR/PDMS(50/30 μm)、PDMS(100 μm)、PDMS/DVB(65 μm)、CAR/PDMS(75 μm)4种不同极性的SPME萃取头萃取香蕉果肉挥发性组分,以确定最合适的萃取头。4种不同的SPME萃取头萃取香蕉挥发性组分的GC-MS总离子流图、总峰面积和鉴定物质数量见图1,图1B的鉴定峰数是根据各种萃取头得到的GC-MS图,在岛津GC-MS工作站中设定匹配相似度≥80%,进行定性鉴别筛选出来的目标化合物的数量。由图1A可知,CAR/PDMS萃取头得到的离子流信号明显强于其他3种萃取头,结合图1B,4种萃取头萃取得到的香蕉挥发性物质的总峰面积顺序是CAR/PDMS>DVB/CAR/PDMS>PDMS>PDMS/DVB;鉴定峰数顺序是CAR/PDMS(90个)>PDMS(70个)>DVB/CAR/PDMS(68个)>PDMS/DVB(54个),CAR/PDMS萃取头得到的总峰面积大于其他3种的总峰面积之和,同时可良好地鉴定出化合物的数量(峰数)明显大于其他3种萃取头,因此在后续的SPME操作中,采用CAR/PDMS萃取头。

图1 4种不同SPME萃取头萃取香蕉挥发性组分的影响Fig.1 Influence of four different SPME extraction heads on banana volatile components extraction注:(A)GC-MS总离子流图;(B)总峰面积和鉴定峰数量。Note:(A)GC-MS total ion chromatograms;(B)Total peak area and number of identified peaks.
2.2 SPME萃取前的超声时间影响
研磨后的香蕉果肉在加入饱和氯化钠溶液后,具有较大的粘稠性,不利于挥发性组分的逸出,在SPME萃取前采用一定时间的超声处理,利用超声波震荡产生的强烈空化效应、热效应等可以提高分子运动速度,加快传质过程,使挥发性组分快速逸出至顶空瓶液面上空达到平衡,有利于后续SPME萃取[13]。SPME萃取前的超声波震荡平衡的影响见图2,由图2可知,随着超声平衡时间增大,总峰面积也增大,在超声平衡时间达到20 min时,总峰面积达到最大,再增加超声时间,总峰面积反而下降,可能是超声时间过长,导致温度过高,造成挥发性组分分解和重新溶于溶液中;离子流图的总峰数也是随超声时间增加而增长,在25 min时达到最大值。综合总峰面积和总峰数情况,本试验采用超声时间为15、20、25 min进行正交试验。
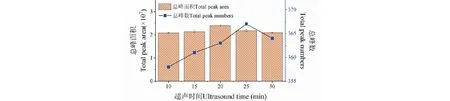
图2 超声时间对SPME萃取香蕉挥发性组分的总峰面积和总峰数的影响Fig.2 Effect of ultrasonic time on total peak area and peak number of volatile compounds extracted from banana by SPME
2.3 样品量
样品量对SPME萃取香蕉挥发性组分的总峰面积和总峰数的影响如图3所示,总峰面积从2.0 g到3.0 g是增加的过程,且3.0 g的总峰面积为最大,从4.0 g到6.0 g,总峰面积呈下降趋势,主要是因为刚开始随着样品用量的增加,逸出的挥发性组分富集在顶空瓶内液面上部的浓度增加,萃取头富集的挥发性组分的量也增加,但随着样品量的增加,样品溶液明显粘稠,特别是样品量增加到6.0 g时,磁力搅拌均匀变得相当困难,不能再增加样品用量,粘稠的样品溶液不利于挥发性组分的逸出,因此萃取头能够富集的挥发性组分总量下降,总峰面积相应变小;总峰数也有总峰面积类似的变化趋势,在样品量为4.0 g时,离子流图的总峰数最大。综合总峰面积和总峰数情况,本试验采用样品量为2.0、3.0、4.0 g进行正交试验。

图3 样品量对SPME萃取香蕉挥发性组分的总峰面积和总峰数的影响Fig.3 Effect of sample weight on total peak area and peak number of volatile compounds extracted from banana by SPME
2.4 萃取温度
温度对HS-SPME萃取效果影响较大,一般来说提高温度可以加快挥发性组分逸出至顶空瓶上部空间,增加液面以上空间的挥发性组分浓度,缩短平衡时间,可提高萃取效率,但增加至一定温度后,过高温度反而影响挥发性组分在气相和萃取涂层的分配比例,降低萃取头的挥发性组分吸附量。萃取温度对HS-SPME的影响见图4。由图4可知,随着SPME的萃取温度升高,总峰面积逐渐增大,当萃取温度为50 ℃时,总峰面积达到最大值,温度继续升高,总峰面积反而下降。而相应的总峰数在40 ℃时最大,温度继续升高,总峰数也下降了。可能是温度过高引起化合物发生分解或化学变化,造成化合物的分配和种类发生变化,进而影响萃取头的萃取效果。综合总峰面积和总峰数情况,本试验采用萃取温度为40、50、60 ℃进行正交试验。

图4 萃取温度对SPME萃取香蕉挥发性组分的总峰面积和总峰数的影响Fig.4 Effect of extracting temperature on total peak area and peak number of volatile compounds extracted from banana by SPME
2.5 正交试验分析
SPME以超声时间、样品量、萃取温度为因素变量,总峰面积为评价指标的正交试验设计方案及结果(见表2)。

表2 正交试验设计与结果表Table 2 design and result of orthogonal experiment
由表2可知,SPME各因素对总峰面积的影响依次表现为:超声时间>萃取温度>样品量,SPME最佳工艺条件:A2B3C2,即正交试验得出SPME条件为:超声时间为20 min,样品量为4.0 g,萃取温度为50 ℃。根据正交试验结果的最佳工艺参数进行验证试验,结果为总峰面积2.992×107(n=3)。
2.6 两组香蕉挥发性组分的定性和定量分析
2.6.1 香蕉样品情况
采用UV-C合适的照射剂量照射后的处理组(UV-C组)与无照射的对照组(CK组)在25 ℃贮藏18天后采样,两组香蕉的外观情况见图5。由图5可知,UV-C处理组香蕉色泽青黄、饱满、有光泽,个别香蕉果实出现很少黑点,刚好处于成熟期,而对照组香蕉色泽淡黄,已经出现大量黑点,同时部分香蕉果实开始有腐烂斑块,处于过成熟状态,两组香蕉的外观状态存在明显差异,UV-C处理后延长了香蕉的贮藏时间。

图5 UV-C组和对照组香蕉常温贮藏18天后香蕉果实的外观状况Fig.5 Appearance of banana fruits in UV-C group and CK group stored at 25 ℃ for 18 days
2.6.2 两组香蕉挥发组分的OPLS-DA分析
挥发性组分变化不仅是判断果实采后贮藏及货架寿命的一个重要指标,还是评价果实品质的一个重要依据。图6为UV-C香蕉样品与CK香蕉样品的GC-MS总离子流图,将原始数据在MS-DIAL软件进行预处理后,导入NIST 17质谱库进行组分鉴定。从本研究的UV-C组和CK组香蕉挥发性组分共鉴定出169个组分,将169个组分数据导入SIMCA 14.1软件,进行OPLS-DA分析(见图7)。由图7A可见OPLS-DA很好地区分两组间的差异,说明经UV-C处理后两组香蕉之间的代谢途径发生变化,相应的挥发性代谢组分有差异。OPLS-DA模型的R2X=0.464、R2Y=0.999、Q2=0.992、R2Y和Q2均>0.99,说明建立的模型稳定,数据可靠。OPLS-DA模型200次迭代验证结果见图7B。其中截距R2=(0.0,0.647),截距Q2=(0.0,-0.854),图中所有左边的Q2值都比右边的原始点低,且Q2回归直线的截距<0,可知OPLS-DA模型没有过度拟合,说明此模型的建立是有效的,可用于本研究的差异代谢挥发性组分的筛选[14]。

图6 UV-C与CK香蕉样品的GC-MS总离子流图Fig.6 GC-MS total ion chromatograms of UV-C and CK banana samples
2.6.3 两组香蕉挥发组分的显著差异组分
根据上述建立的OPLS-DA模型,得到了两组香蕉169个挥发性组分的FC值和T检验(Student’s t-test)的P值(P-value),采用P<0.05与FC>1.2或FC<0.83筛选差异代谢挥发性组分[15],共筛选出38个香蕉显著差异的挥发性代谢组分,图8为筛选结果的火山图(Volcano plot),图中绿色的点和数字代表显著下调的组分,红色的点和数字代表显著上调的组分。38个显著差异组分占169个鉴定组分含量的8.72%,其中含量显著下调的有34个组分,显著上调的组分有4个,具体组分见筛选结果(见表3)。

表3 UV-C组和CK组香蕉中的差异代谢挥发性组分Table 3 The difference of volatile components in banana metabolism between UV-C group and CK group
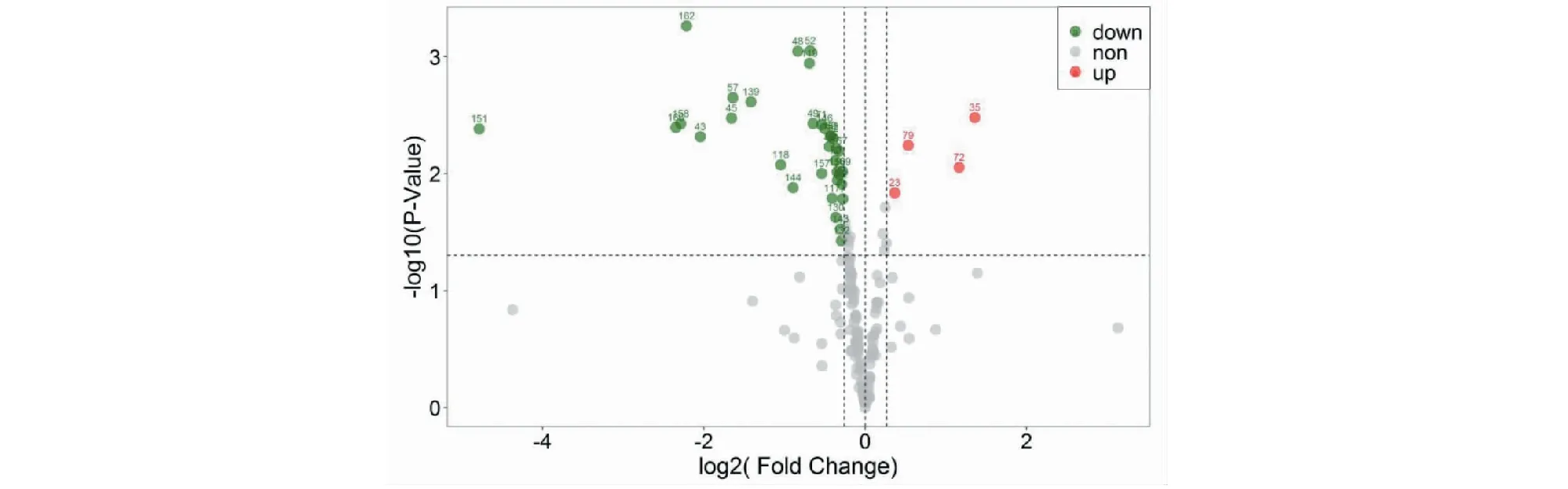
图8 UV-C组和CK组香蕉差异代谢挥发性组分的火山图Fig.8 Volcanic map of the difference in volatile components metabolism between UV-C group and CK group
3 讨论
3.1 香蕉挥发性组分的鉴定
由于SPME联合GC-MS具有环境友好、使用简易和受样品基质干扰低而被广泛应用于果蔬等的挥发性组分(或香气成分)的研究,其用于香蕉的挥发性组分分析的研究早有报道,主要集中于讨论选择合适的SPME萃取头、不同时期的香蕉挥发性组分的鉴定。选择合适的SPME纤维头对于香蕉挥发性组分的测定和后续的组分鉴定是十分重要的,可以更有效地富集挥发性组分和得到更准确的定性和定量结果。Liang等[16]应用DVB/CAR/PDMS萃取头,分析“桂蕉1号”香蕉的绿熟期、黄熟和过熟期的挥发性成分,共鉴定出44个挥发性成分。Dou等[10]应用DVB/CAR/PDMS萃取头,分析不同季节黄熟期“巴西”香蕉和“广粉1号”粉蕉的挥发性组分,共鉴定出63个挥发性组分,不同季节的组分含量有差异,其中3月份的样品的挥发性组分含量更高。Li等[17]用DVB/CAR/PDMS萃取头,探讨了整个采后贮藏后熟过程黄熟期的“巴西”香蕉和“广粉1号”粉蕉的挥发性组分,分别共检测到45个和27个挥发性组分,其中“巴西”香蕉在黄熟期的挥发性组分主要是酯类和醛类。
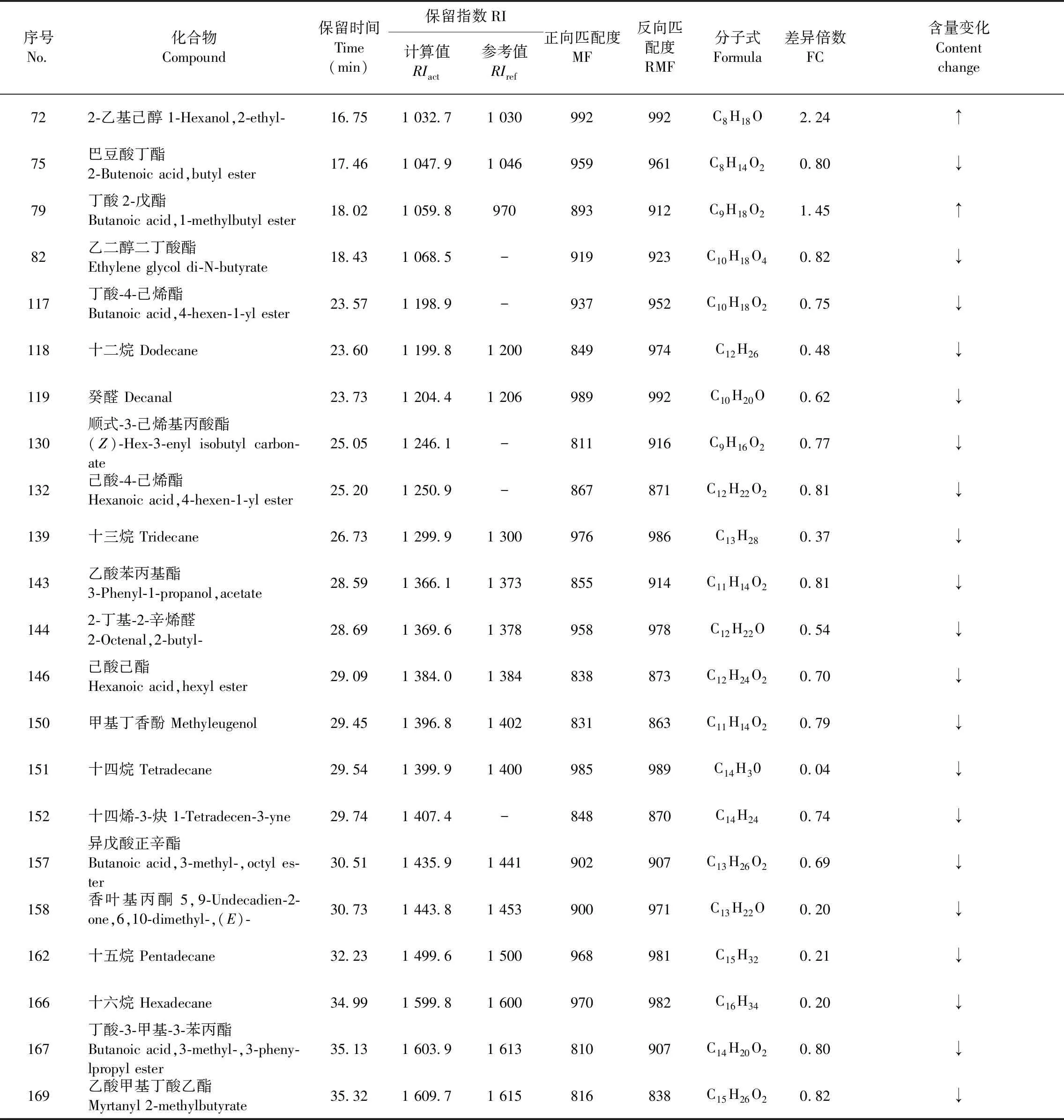
续表3(Continueed Tab.3)
上述关于香蕉挥发性组分的研究报道,在SPME萃取头使用种类上多应用DVB/CAR /PDMS萃取头,在组分定性鉴别上主要根据工作站配套的NIST质谱库进行相似度检索,原始质谱数据存在信息干扰、重峰等鉴定的不足,因此其鉴定出来的组分数量较少,一般少于50个,而香蕉果实中已鉴定的挥发性组分有250多个[18],因此如何选择和优化实验条件,应用图谱预处理软件(如AMDIS或MS-DIAL等)对测得的原始质谱图进行“减少重叠峰、背景信号的干扰等”处理,得到“纯化”的质谱图,增加与目标质谱库的匹配程度,提高鉴定组分能力和数量,是十分必要的。MS-DIAL软件能够对GC-MS总离子流图(TIC)解卷积,消除干扰峰和重叠峰,得到相对纯净的质谱图,提高待鉴定组分与质谱库组分的匹配度,使未知组分鉴定的结果更准确和可靠[12]。本研究在综合前人报道的基础上,比较了DVB/CAR/PDMS、PDMS、PDMS/DVB、CAR/PDMS四种萃取头联合GC-MS测定成熟期香蕉挥发性组分,根据丰度大小和鉴定出组分数量筛选出CAR/PDMS萃取头用于本研究后续SPME条件优化和两组香蕉挥发性差异组分比较。为了使质谱鉴定结果更加可靠,先用MS-DIAL软件对原始质谱图进行图谱预处理,然后导入NIST 17质谱库中进行鉴定,由检索的正向匹配度(MF)、反向匹配度(RMF)均≥800和正构烷烃得到的Kováts保留指数(RI)相结合,鉴定出两组香蕉的挥发性组分共169个。
3.2 UV-C处理后的香蕉挥发性组分的变化
UV-C应用于农产品、食品的保鲜,主要集中在提高果蔬的抗氧化性、抗菌性和生物活性成分的变化等研究,对于UV-C处理后贮藏的果蔬等的挥发性组分(或香气成分)变化研究较少。Söbeli等[19]使用合适UV-C剂量降低牛腰肉排中微生物数量,延长保存时间,发现牛排的有些挥发性组分含量增加了,主要是己醛和2-庚醛等。Severo等在2015年报道对草莓进行采后UV-C处理,表明UV-C能够通过基因激活诱导草莓的相关酶类,增加草莓的生物活性和酯挥发性化合物含量,导致果实更结实,生物活性分子水平更高,以及更强的香气。Severo等[20]在2017年报道UV-C辐射采前草莓,影响草莓代谢物含量和挥发性有机化合物产量,UV-C处理增加了总挥发性有机物的产量,主要是总挥发性酯,但减少了草莓特征香气物质呋喃和间甲基呋喃的产量。
本研究应用前期实验得到合适的香蕉保鲜UV-C剂量处理香蕉后,对对照组和UV-C组的挥发性组分的差异进行了深入探讨。香蕉果实各挥发性组分的相对含量通过内标法(2-辛醇为内标)计算得到,169个组分主要由酯、醛、酮、醇和其他类物质组成,其中酯类有58个(占CK组和UV-C组含量分别为75.98%±0.39%、76.61%±0.25%)、醛类有34个(占CK组和UV-C组含量分别为8.09%±0.08%、8.29%±0.05%)、酮类有27个(占CK组和UV-C组含量分别为7.72%±0.11%、6.78%±0.07%)、醇类有17个(占CK组和UV-C组含量分别为2.46%±0.07%、2.36%±0.04%)、其他类有33个(占CK组和UV-C组含量分别为5.75%±0.09%、5.49%±0.06%),酯类是成熟香蕉果肉主要的挥发性组分[3-5]。图9为两组香蕉的挥发性组分中相对含量较高的前10个组分,可见两组香蕉的前10个组分的种类是相同的,分别是乙酸异戊酯、丁酸异戊酯、1-甲基乙酸丁酯、异戊酸异戊酯、乙酸-2-庚酯、乙酸异丁酯、乙酸丁酯、3-甲基-2-丁酮、乙酸乙酯、乙酸己酯,除了第2组分(丁酸异戊酯)、第9组分(乙酸乙酯)含量有显著性差异,其他8个组分无显著性差异。这些相对高含量的酯类构成了香蕉果实的特征香气,同时是香蕉挥发性组分中的主要类别,与Wendakoon[21]和Boudhrioua[22]的研究一致。通过对两组香蕉的169个组分展开OPLS-DA建模分析,筛选差异代谢组分,由表3和图8可知,经UV-C处理后,处理组和对照组香蕉有38个差异代谢挥发性组分,含量下调的有34个,含量上调的有4个(分别是己醛、正己醇、2-乙基己醇、丁酸2-戊酯)。Zhu等[23]研究低温贮藏对香蕉果实挥发性物质的影响,结果表明低温抑制了挥发物的生物合成相关的关键基因MaHPL、MaLOX和MaAAT的表达来减少在贮藏期内挥发性物质的产生。可能本实验选择的合适剂量的UV-C处理香蕉在一定程度上抑制了MaHPL、MaLOX和MaAAT 3种基因的部分表达,起到类似低温贮藏的作用,但同时引起了香蕉的抗逆性,激活诱导了苯丙氨酸解氨酶等酶类的活性[24],因此没有表现出完全统一的挥发性组分含量的增加或下降。UV-C处理后香蕉的挥发性组分有部分的含量显著降低了,也有部分的含量下降了,但因为香蕉的香气来源主要是酯类组分,乙酸异戊酯、丁酸异戊酯这两个组分是挥发性组分含量较高的前2个,同时也是香蕉的主要特征香气成分,对比处理前后这两个组分含量均提高了,乙酸异戊酯含量提高不显著(P>0.05),而丁酸异戊酯含量提高显著(P<0.05,差异倍数FC=1.19),同时UV-C组总酯含量略高于对照组,因此总体而言,UV-C处理后的香蕉气味会略有增强。

图9 UV-C组和CK组香蕉前10个挥发性组分相对含量Fig.9 Relative contents of the first 10 volatile components of banana in UV-C group and CK group注:组分1~10分别代表乙酸异戊酯、丁酸异戊酯、1-甲基乙酸丁酯、异戊酸异戊酯、乙酸-2-庚酯、乙酸异丁酯、乙酸丁酯、3-甲基-2-丁酮、乙酸乙酯、乙酸己酯。Note:Components 1-10 represent isoamyl acetate,isoamyl butyrate,2-pentylacetate,isopentyl isopentanoate,2-heptyl acetate,isobutyl acetate,butyl acetate,3-methyl-2-butanone,ethyl acetate,hexyl acetate,respectively.
4 结论
本文优选CAR/PDMS萃取头进行SPME操作,应用正交试验设计对SPME的萃取条件进行了优化组合,得到香蕉挥发性组分测定的SPME萃取优化条件为:超声时间为20 min、样品量为4.0 g、萃取温度为50 ℃。在此基础上,通过测定经UV-C处理后具有保鲜效果的处理组香蕉和对照组香蕉的挥发性组分,实验结果表明两组香蕉的代谢途径发生了变化,共有38个差异代谢挥发性组分、34个差异代谢挥发组分的相对含量下调了,4个差异代谢挥发性组分相对含量上调了,经UV-C处理后贮藏的香蕉总酯含量、主要特征香气成分乙酸异戊酯和丁酸异戊酯均高于对照组香蕉,而酯类是成熟香蕉果肉主要的挥发性组分和香气组成,因此应用UV-C处理香蕉进行保鲜贮藏,不仅不会造成香蕉的香气成分下降,反而有利于香蕉香气的产生,本研究结果可为SPME-GC-MS测定农产品等食品中挥发性组分提供定性参考和UV-C处理保鲜水果后的香气变化提供借鉴。目前对于香蕉等果实香气成分的物质代谢途径、果实贮藏和加工过程挥发性成分变化、相应基因和酶的生理功能的机理等方面的研究还不完善,对于本研究中的UV-C处理后导致香蕉相关挥发性组分的上调或下调的相关基因和酶类变化的机理还有待进一步探索。

