鸡血藤木质部与韧皮部中代谢产物的差异性分析
陈 菲,梅余琪,刘训红*
1如皋市中医院,如皋 226500;2南京中医药大学药学院,南京 210023
鸡血藤为豆科植物密花豆SpatholobussuberectusDunn的干燥藤茎,具有活血补血,调经止痛,舒筋活络的功效[1],历版《中国药典》均有收载。鸡血藤药材主要由木质部和韧皮部组成,木质部红棕色或棕色,导管孔多数;韧皮部有树脂状分泌物呈红棕色至黑棕色,与木质部相间排列呈数个同心性椭圆形环或偏心性半圆形环[1]。鸡血藤主要含有黄酮类、萜类、甾醇类、蒽醌类、有机酸类等化学成分,具有抗肿瘤、抗病毒、抗氧化、抗贫血等多种药理活性[2]。近年来,国内外对鸡血藤的质量研究报道较少,且多集中于对其活性成分的定量研究[3-5],对鸡血藤不同组织部位中代谢产物的差异性研究尚属空白。
本实验基于植物代谢组学和网络药理学的研究思路和方法[6-9],采用超快速液相色谱-串联四级杆飞行时间高分辨质谱(UFLC-Triple TOF-MS/MS)技术结合多元统计分析,筛选并鉴定鸡血藤木质部与韧皮部中的显著差异代谢产物,并挖掘其对应的潜在靶点及通路,构建“成分-靶点-通路”网络,以期进一步明确鸡血藤的功效物质基础和主要调控靶点,并为探讨鸡血藤药材的品质形成机制提供新思路。
1 材料与方法
1.1 仪器与材料
SIL-20A XR超快速液相色谱仪(日本Shimadzu公司);Triple TOFTM5600 System-MS/MS高分辨四极杆飞行时间质谱仪(美国AB Sciex公司);Q-500B高速多功能粉碎机(上海冰都电器有限公司);ME36S型电子分析天平(百万分之一,德国赛多利斯公司);BSA224S型电子分析天平(万分之一,德国赛多利斯公司);Milli-Q超纯水制备仪(美国Millipore公司);KQ-500B超声波清洗机(500 W、40 kHz,昆山超声仪器有限公司);H1650-W高速离心机(湖南湘仪实验室仪器开发有限公司);色谱甲醇(批号143135,江苏汉邦科技有限公司)。
色谱甲醇(批号143135,江苏汉邦科技有限公司);色谱三氯甲烷(批号20190201,上海凌峰化学试剂有限公司);色谱乙腈(批号SHBL8516,德国默克公司);甲酸(批号G1326020,德国默克公司);实验用水为Milli-Q超纯水。共收集到来自老挝6个批次的鸡血藤药材,均为椭圆形或不规则的干燥斜切片,厚度约为0.3~1 cm。每批样品均被仔细地分离木质部和韧皮部,且无相互粘连。所有药材经南京中医药大学刘训红教授鉴定为豆科植物密花豆SpatholobussuberectusDunn的干燥藤茎,留样凭证存放于南京中医药大学中药鉴定实验室。
1.2 测试条件
1.2.1 色谱条件
色谱柱:ZORBAX Extend-C18(2.1 mm×100 mm,1.8 μm);流动相:0.1%甲酸水(A)-乙腈(B),梯度洗脱条件:0~8 min,5%→10% B;8~14 min,10%→25% B;14~17 min,25%→33% B;17~24 min,33%→45% B;24~31 min,45%→58% B;31~38 min,58%→83% B;38~40 min,83%→83% B;40~42 min,83%→95% B;柱温:35 ℃;流速:0.3 mL/min;进样量:2.0 μL。
1.2.2 质谱条件
电喷雾离子源(ESI);正、负离子模式下采集数据;质量扫描范围m/z50~1 500;离子源温度(temperature,TEM):550 ℃;气帘气(curtain gas,CUR)流速:40 L/min;雾化气(nebulizer gas,GS1)流速:55 L/min;辅助气(auxiliary gas,GS2)流速:55 L/min;喷雾电压(ion spray voltage,IS)正离子模式4 500 V,负离子模式-4 500 V;去簇电压(declustering potential,DP)正离子模式100 V,负离子模式-100 V。
1.3 供试品溶液制备
样品粉末粉碎过50目筛。取样品约1.0 g,精密称定,置25 mL具塞锥形瓶中,加入10 mL三氯甲烷-甲醇(4∶1,V/V)溶液,密闭,称重,室温下超声处理(功率500 W,频率40 kHz)60 min,放置冷却,再次称重,加入三氯甲烷-甲醇(4∶1,V/V)溶液至初始重量,过滤,将滤液离心10 min(12 000 rpm),取上清液,稀释10倍后经0.22 μm微孔滤膜滤过,备用。
1.4 色谱图处理与统计分析
将经过MarkerView 1.2.1预处理的样品数据,导入到SIMCA-P 13.0中进行PCA、OPLS-DA模型的预测分析。以PCA初步判断总体样本的聚散情况,如果样本之间聚集在一起,说明这些样本差异性小;反之样本之间距离越远,说明样本之间差异性越大。在PCA分析的基础上,通过OPLS-DA进行样本的具体分类,在模型参数中,R2X、R2Y越接近于1表示所建立的模型越稳定,Q2>0.5表示模型具有较高的可靠性和预测度[10,11]。根据OPLS-DA中变量权重值(VIP>1)和t检验中P值(P<0.05)筛选差异化合物。
1.5 差异化学成分鉴定
根据一级质谱确定化合物的精确相对分子质量,二级质谱获得碎片信息,结合对照品裂解信息、参考文献和前期研究基础[12]等推测和鉴定差异化合物的结构信息。以各样品中各物质对应的峰面积表示差异成分的量,根据同一物质峰面积的平均值和标准差计算各样品中该物质的相对含量并进行比较[10,11]。
1.6 网络药理学分析
在中药系统药理数据库TCMSP(https://tcmspw.com/tcmsp.php)、Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)中,根据吸收、分布、代谢与排泄(ADME)的相关参数筛选差异化合物中的中药活性组分并获取相关蛋白靶点;通过UniProt(https://www.uniprot.org/)数据库将预测出的靶点蛋白名转换为对应的基因名;利用String平台(https://string-db.org/)进行蛋白质相互作用分析,构建靶点蛋白与蛋白互作网络(protein protein interaction network,PPI network)并挖掘网络中潜在的蛋白质功能模块;采用DAVID(https://david.ncifcrf.gov/)平台分析“药物-成分-靶点”及其参与的生物过程及通路,而后采用Cytoscape 3.7.2软件构建鸡血藤“成分-靶点-通路”网络[13]。
2 结果
2.1 条件的优化
2.1.1 色谱条件的优化
比较了不同流动相(乙腈-水、甲醇-水、0.1%甲酸水-乙腈和0.1%甲酸水-甲醇溶液)对多组分的分离效果。结果表明,以0.1%甲酸水-乙腈为流动相时,各色谱峰具有较好的峰形及分离效果。通过比较正离子模式和负离子模式下的质谱数据,发现大部分化合物可以在正离子模式下被鉴定,少数化合物可以在负离子模式下被鉴定。因此,选择在正离子和负离子两种模式下收集数据。图1为鸡血藤木质部与韧皮部样品在正、负离子模式下的基峰图。

图1 正离子模式下鸡血藤木质部(A)与韧皮部(B)样品、负离子模式下鸡血藤木质部(C)与韧皮部(D)样品的基峰图Fig.1 Base peak chromatograms of xylem (A)and phloem (B)in positive ion mode and xylem (C)and phloem (D)in negative ion mode of Spatholobi Caulis
2.1.2 样品处理优化
为了优化提取工艺,对不同浓度的提取溶剂(30%、50%、70%和90%的甲醇溶液;30%、50%、70%和90%的乙醇溶液;氯仿-甲醇(4∶1,V/V))、提取时间(30、60、90 min)和药液比(1∶10、1∶20、1∶30、1∶40 g/mL)进行了单因素考察。通过比较儿茶素、表儿茶素、没食子儿茶素、表没食子儿茶素和芒柄花素的提取效率,最终确定室温下样品用1∶10的氯仿-甲醇(4∶1,V/V)溶液超声提取60 min。
2.2 PCA分析
采用PCA对鸡血藤木质部与韧皮部样品进行分类与分析。图2为鸡血藤木质部与韧皮部样品分别在正、负离子模式下的PCA得分图。在正离子模式中,t[1]=0.526,t[2]=0.266,其中R2[X]=0.962,Q2=0.554;在负离子模式中,t[1]=0.825,t[2]=0.074,其中R2[X]=0.947,Q2=0.790,表示模型成立可靠,具有良好解释能力和预测能力。在模型成立的前提下,木质部与韧皮部在PCA模型中各自聚为一类,具有较好的分类效果,表明二者之间存在一定的差异。
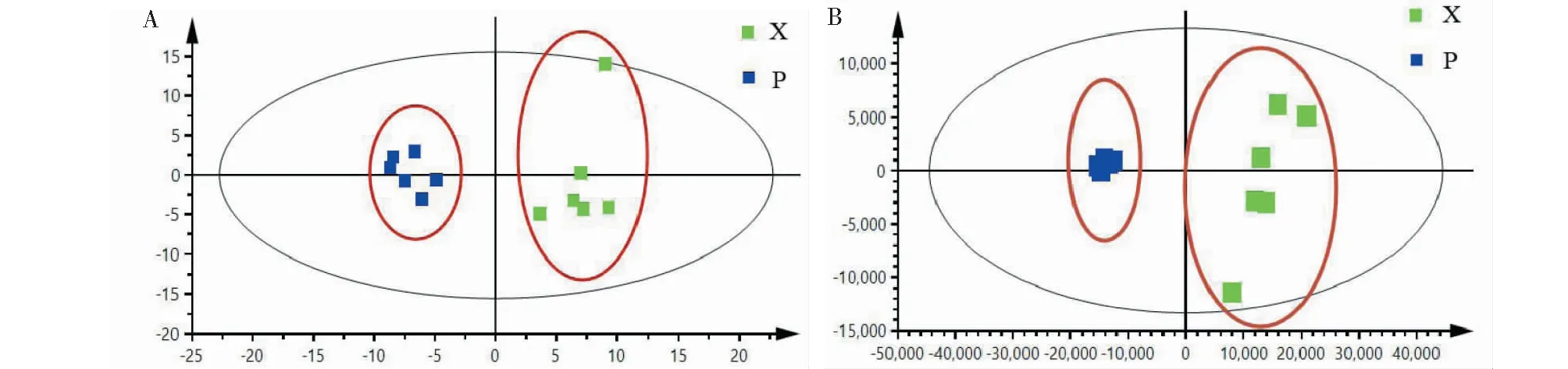
图2 鸡血藤木质部与韧皮部样品在正(A)、负(B)离子模式下的PCA得分图Fig.2 PCA score scatter plots of xylem and phloem of Spatholobi Caulis in positive (A)and negative (B)ion modes注:“X”表示木质部;“P”表示韧皮部,下同。Note;“X”is xylem;“P”is phloem,the same below.
2.3 OPLS-DA分析
为减少组内随机误差,突出组间轮廓差异,弥补无监督模型的缺陷,采用有监督的OPLS-DA分析建立判别模型,并对预测集进行预测[14]。图3、图4为鸡血藤木质部与韧皮部样品在正、负离子模式中的OPLS-DA分布图(A)、VIP得分图(B)和S-Plot图(C),其中,正离子模式R2[X]=0.862,Q2=0.959,负离子模式R2[X]=0.860,Q2=0.968。对 OPLS-DA 模型进行交叉验证方差分析(CV-ANOVA),以P值反映组间差异的大小,结果显示正离子模式下P=0.012 158 1,负离子模式下P=2.046 69×10-4,二者P值均小于0.05,表明模型稳定可靠。由VIP得分图(B)和S-Plot图(C)可知对两组分类贡献较大的成分(VIP>1),结合P<0.05,正离子模式共筛选出32个差异成分,负离子模式共筛选出27个差异成分。

图3 鸡血藤木质部与韧皮部样品在正离子模式下的OPLS-DA分布图(A)、VIP得分图(B)和S-Plot图(C)Fig.3 OPLS-DA score scatter (A),VIP plot (B)and S-plot (C)of xylem and phloem of Spatholobi Caulis in positive ion mode

图4 鸡血藤木质部与韧皮部样品在负离子模式下的OPLS-DA分布图(A)、VIP得分图(B)和S-Plot图(C)Fig.4 OPLS-DA score scatter (A),VIP plot (B)and S-plot (C)of xylem and phloem of Spatholobi Caulis in negative ion mode
2.4 差异化学成分鉴定与相对定量
通过质谱数据中的精确相对分子质量和裂解碎片信息,结合对照品信息、相关参考文献和数据库对上述显著差异成分进行结构鉴定,鉴定出其中13个差异成分(见表1)。以这13种差异成分在各样品中的峰面积作为相对含量,计算鸡血藤木质部与韧皮部中显著差异成分的相对含量平均值与标准差。如图5所示,13个差异成分在木质部中的含量均显著高于韧皮部。

表1 鸡血藤木质部与韧皮部中差异化学成分的鉴定Table 1 Identification of different constituents in the xylem and phloem of Spatholobi Caulis

图5 鸡血藤木质部与韧皮部中差异化合物的相对含量变化Fig.5 The comparison of relative contents of differential chemical constituents in xylem and phloem of Spatholobi Caulis
2.5 网络药理学分析
基于上述差异成分,利用网络药理学手段初步探究鸡血藤的药效物质基础及潜在的分子机制[13,15-17]。
2.5.1 相关靶点筛选
根据口服利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18的2个ADME属性值[18],对上述差异成分初步筛选,获得其中5个活性化合物(芒柄花素、美迪紫檀素、黄甘草苷、甘草素和维斯体素)及其作用的222个蛋白质靶点。
2.5.2 靶点蛋白与蛋白互作(PPI)网络分析
将获得的222个靶点蛋白以gene symbol形式导入在线String 11.0软件,物种选择为人(homo sapiens),最高置信度蛋白交互参数评分值>0.9,其他参数设置不变,将得到的相互作用参数导入Cytoscape 3.7.2软件构建PPI网络图。由于PPI网络中蛋白的作用的是相互的,所以通常归为无向图。PPI复杂网络中存在部分密度较高的区域称为community或module。module内部的网络是PPI网络的潜在子网,子网连线密度较高,区域部分连线少,因此module被认为是具有生物学意义的集合[13]。PPI网络中的几个得分较高的module见图6,每个节点代表1种蛋白,节点之间的连线代表2个蛋白之间的相互作用。

图6 PPI网络中的moduleFig.6 Modules in PPI network
对PPI进行拓扑特征分析,选取在“中介中心性”(betweenness)和“接近中心性”(closeness)2个参数均大于等于中位数、“度中心性”(degree)大于等于两倍中位数作为核心靶点,经筛选后共得到24个重要核心靶点,即LCK、PTPN1、HCK、SRC、TNF、GCGR、AGTR1、PIK3CA、EGFR、PIK3R1、YWHAG、PRKACA、HSP90AA1、MAP2K1、ESR1、MMP9、EPHB2、PIK3CB、VEGFA、MMP2、IGF1R、PDPK1、IL2、KDR,其中与维斯体素相关的靶点数较多。
2.5.3 功能富集分析与通路分析
利用David 6.8数据库(https://david.ncifcrf.gov/)对24个核心靶点蛋白进行GO功能和KEGG通路富集分析。GO功能分析主要用于描述基因靶点的功能,包括细胞功能、分子功能和生物功能;KEGG富集分析可以得到潜在靶点所富集的信号通路[19]。GO分析结果显示,根据P<0.01共获得生物信息条目79个,包括生物过程(BP)条目49个、细胞组成(CC)条目10个、分子功能(MF)条目20个。其中BP主要涉及血管内皮生长因子受体信号通路、磷脂酰肌醇介导的信号传导、肽基酪氨酸磷酸化、蛋白质自磷酸化、凋亡过程的负调控等;CC主要涉及细胞质膜、细胞膜和细胞质等;MF主要涉及蛋白酪氨酸激酶活性、ATP结合和蛋白质结合等(见表2)。同时,根据P<0.01获得KEGG通路富集条目67个,主要涉及蛋白聚糖作用癌症、雌激素信号通路、PI3K-Akt信号通路、局灶性粘连、癌症信号通路等相关信号转导途径(见图7)。

表2 鸡血藤相关靶点的GO分析Table 2 GO analysis of related targets in Spatholobi Caulis

图7 鸡血藤相关靶点的KEGG通路富集分析结果(前15位)Fig.7 KEGG pathway enrichment analysis of related targets in Spatholobi Caulis (Top 15)
2.5.4 “成分-靶点-通路”网络构建
根据上述成分-靶点、靶点-通路的对应关系,利用Cytoscape 3.7.2软件绘制出“成分-靶点-通路”网络图,并通过网络图进行可视化展示,如图8所示。由网络图可知,鸡血藤是通过多靶点、多途径发挥协同作用的。根据Cytoscape 3.7.2软件分析结果,以化合物、靶点蛋白、信号通路的连接度(degree)为参考,发现化合物维斯体素(degree=9)的连接度较高,提示该化合物可能是鸡血藤的关键活性成分;PIK3R1(degree=55)、PIK3CA(degree=58)、MAP2K1(degree=49)、PIK3CB(degree=63)的连接度显著高于其他靶点,表明这4个靶点发挥的作用可能更为关键;蛋白聚糖作用癌症(degree=10)、癌症通路(degree=10)、PI3K-Akt信号通路(degree=8)连接度高于其他通路,表明鸡血藤中的差异标志物主要对上述信号通路发挥重要作用。

图8 鸡血藤“成分-靶点-通路”网络Fig.8 “Component-target-pathway”network of Spatholobi Caulis
3 讨论与结论
同一植物在不同环境、不同部位、不同产地或者不同的炮制方法,所得到的代谢物均有差异。这些代谢物结构迥异,数量庞大,可以使植物很好地适应环境的变化,植物类中药的次生代谢物往往是与药效相关的活性成分,也通常作为研究中药材药效学的物质基础[20]。网络药理学是基于对“成分-靶标-通路-疾病”相互作用网络的理解,分析并观察药物对复杂疾病网络的干预和影响,并利用可视化大规模数据集成直观、清晰地观察网络各节点之间的相互作用,为研究复杂的药物与疾病机制靶标提供了新的平台[21]。
本实验基于UFLC-Triple TOF-MS/MS技术分析鸡血藤木质部与韧皮部中化学成分的差异,并通过网络药理学挖掘其对应的潜在靶点与通路,构建“成分-靶点-通路”网络。木质部与韧皮部样品在PCA模型中得到有效区分,通过进一步的OPLS-DA分析与t检验,对差异化合物进行筛选与鉴定,共鉴定出其中13个差异成分。结合网络药理学分析,进一步筛选、挖掘其对应的潜在靶点及通路。基于degree值,发现化合物维斯体素可能是鸡血藤的关键活性成分;PIK3R1、PIK3CA、MAP2K1、PIK3CB这4个靶点发挥的作用可能较为关键;鸡血藤中的差异标志物主要对蛋白聚糖作用癌症、癌症通路、PI3K-Akt信号通路发挥重要作用。
鸡血藤始载于《本草备要》,记载“鸡血藤,活血舒筋……血嗽血,诸病要药”[22],具有“去淤血,生新血”的功效[23]。目前,鸡血藤已逐步证实能通过多种机制抑制癌症。Sun等[24]研究了鸡血藤柱色谱提取物对乳腺癌细胞株MCF7的影响及其可能的作用机制。结果显示鸡血藤提取物不仅减少了MCF7细胞的存活率,还可抑制核内pER活性并通过抑制MAPK PI3K/AKT信号通路导致乳腺癌细胞凋亡。肿瘤转移是肿瘤患者的首要死因,研究表明肿瘤能够诱导血小板向其聚集从而保护肿瘤细胞的生存以及免疫逃逸[25]。有实验证实鸡血藤提取物能有效地抑制肿瘤细胞所诱导的血小板聚集,并能够显著降低乳腺癌细胞4T1的转移率,其药效机制可能与抑制P-selectin,糖蛋白Ⅵ等的mRNA水平的表达有关[26]。陈丹丹等采用腋下注射肿瘤细胞的造模方法,研究了鸡血藤水提物对S180肿瘤的抑制效果,结果鸡血藤水提物能显著抑制S180肿瘤细胞的生长,表明其具有良好的抗肿瘤活性[27]。前期通过网络药理学分析发现与鸡血藤中关键成分相关度较高的通路主要是蛋白聚糖作用癌症、癌症通路、PI3K-Akt信号通路等,结合近年来的相关文献可知,这一结果与目前已研究的鸡血藤的药理作用基本一致。
综上,本研究运用植物代谢组学的思路,筛选并表征了鸡血藤木质部与韧皮部中的差异化合物,同时结合网络药理学分析,建立鸡血藤物质基础-靶点-通路关联。研究结果可为揭示不同组织部位对鸡血藤代谢产物合成积累的影响提供科学依据,为进一步明确鸡血藤的功效物质基础和主要调控靶点提供一定的基础资料,并为探讨鸡血藤药材的品质形成机制提供新的方向。但限于网络药理学方法论的局限性以及中药组分的复杂性,后续仍需基础与临床研究予以进一步验证。

