基于氧化应激研究苦豆子不同提取物的肝毒性机制
刘学楠,李 芳,华永丽,纪 鹏,姚万玲,魏彦明
甘肃农业大学动物医学院,兰州 730070
苦豆子(SophoraalopecuroidesL.)属豆科槐属植物。1977年被收入《中华人民共和国药典》,是甘肃、内蒙古、宁夏等省份重要的中药植物资源和生态植被组成部分。苦豆子具有清热解毒、除湿的作用,生物碱、黄酮和糖类为主要活性成分[1],对胃肠道等疾病具有很好的治疗作用[2]。Wang等[3,4]发现苦豆子生物碱主要为喹诺酮类,其在抗氧化、抗寄生虫和抗菌等方面发挥重要作用[5]。研究发现苦豆子黄酮类成分对乙肝病毒有一定的拮抗作用[6]。目前,国内市场上已形成了以生态环境保护、特色产品开发及区域发展的苦豆子植物产业链。
在传统应用中,苦豆子从未因为毒性而引起关注。近年来,药物性肝损伤成为我国非感染性肝病的第二大病种,是欧美国家急性肝衰竭的首要病因,比例高达60%[7]。有关中药导致肝毒性的临床案例报道也日益增多,其潜在的毒性也成为国内外研究的热点[8]。前期急性毒性实验发现,苦豆子提取物对大鼠肝脏具有一定的毒性[9]。肝脏作为机体代谢和发挥解毒功能的主要器官,其毒性的研究具有重要的意义。目前有关苦豆子引起肝脏毒性的具体作用机制仍不明确。因此,本文通过亚急性毒性实验,观察水煎煮(WD)、水超声(WU)、乙醇回流(ER)和乙醇超声(EU)四种提取物给药后对大鼠一般行为学、组织形态学、氧化应激指标的影响,并通过测定给药后大鼠血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)含量、肝脏中氧化应激指标还原型谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、丙二醛(MDA)以及核因子红系2相关因子2(Nrf2)、血红素氧合酶1(HO-1)、SOD1、SOD2蛋白的表达与分布情况,探讨苦豆子对大鼠的肝毒性作用机制,为苦豆子临床基础研究提供科学数据和参考。
1 材料与方法
1.1 材料与试剂
苦豆子采自甘肃武威地区,经甘肃农业大学动物医学院中兽医学教研室魏彦明教授鉴定为豆科植物苦豆子(SophoraalopecuroidesL.)。植物鉴定后被保存在甘肃农业大学中兽医实验室植物标本室(NO.KDZ20180910)。
AST、ALT、GSH、SOD、MDA测定试剂盒由南京建成有限公司提供,生产批号分别为20200620、20200623、20200622、20200624、20200624。2.5%戊二醛电镜固定液购买于北京索莱宝生物有限公司。
兔多克隆抗体(一抗)SOD1(bs-10216R)、SOD2(bs-323402R)购于北京博奥森生物有限公司;大鼠单克隆抗体(一抗)Nrf2(16396-1-AP)、HO-1(10701-1010-ap)、β-actin以及二抗HRP-conjugated Affinipure Goat Anti-Mouse均购于武汉三鹰生物科技有限公司;BCA蛋白定量试剂盒、RIPA蛋白裂解液、上样缓冲液(Loading Buffer)、十二烷基硫酸钠(SDS)、TEMED、Bis-Acr、SDS-PAGE分离胶/浓缩胶缓冲液、甘氨酸、三甲醇氨基甲烷(Tris)、PVDF膜、脱脂奶粉、磷酸盐缓冲液、吐温80均购于北京索莱宝科技有限公司;ECL发光液购于南京诺唯赞生物科技有限公司;蛋白电泳彩虹Marker购于赛默飞世尔科技(中国)有限公司。
1.2 实验动物
清洁级SD大鼠4~6周龄,雌性35只,雄性40只,体重(180 ± 20)g,由中国科学院兰州兽医研究所实验动物中心提供,许可证编号(SCXX(甘)2015 -0001)。室温调整在23±1 ℃,湿度在50%±5%,12 h光照和12h黑暗环境交替进行,标准饮食,自由饮水。所有大鼠适应性饲养7天后,进行实验操作。动物福利和实验过程严格按照《关于善待实验动物的指导性意见》(中国科技部,2006)相关规定,由甘肃农业大学动物伦理委员会监督执行。
1.3 实验方法
1.3.1 药物制备
样品粉碎后过40目筛。分别称取40 g苦豆子按以下4种方法提取:①75%乙醇回流提取(ER),加醇量为10倍。②采用水煎煮提取(WD),加水量为10倍。①②均浸泡1 h,加热煎煮2 h,滤过。③采用75%乙醇超声提取(EU),加醇量为10倍,浸泡1 h,超声提取40 min,滤过,收集滤液。④采用水超声提取(WU),加水量为10倍,浸泡1 h,超声提取40 min,滤过,收集滤液。将4组滤液分别浓缩后定容至1 g/mL,冷藏,备用。
1.3.2 剂量选择与动物分组
根据实验室前期苦豆子乙醇回流提取物的亚急性毒性实验结果以及毒性实验剂量指导原则,选择1/8 LD50作为毒性研究剂量[9]。WD、WU、EU、ER LD50分别为38.397、24.994、19.957、18.536 g/kg。根据大小鼠体表面积直接换算[9]WD、WU、EU、ER组生药剂量分别为2.228、1.450、1.158、1.076 g/kg。实验采用随机数字表法分为10组,分别为WD雌性组(7只)、雄性组(8只),WU雌性组(7只)、雄性组(8只),EU雌性组(7只)、雄性组(8只),ER雌性组(7只)、雄性组(8只),雌性Control组(7只)、雄性Control组(8只)。每天早晨固定时间称重灌胃。空白组给予等量生理盐水,每天一次,连续灌胃30天。
1.3.3 一般行为学观察
给药期间观察大鼠皮毛状态、精神状况、体重、体温、饮食、尿量及粪便形状色泽等一般行为学状态。
1.3.4 样品采集与处理
实验结束后,腹腔注射10%水合氯醛麻醉,腹主动脉采集血液,分别用加EDTA-K2抗凝剂和不加抗凝剂的两种采血管收集血液,一部分用于血液生理学分析,另一部分静置1 h,4 ℃下3 000 rpm离心10 min,收集血清置-80 ℃下保存备用。快速切取2 cm3左右固定于2.5%戊二醛中进行肝脏超微组织形态学观察。肝脏右叶固定于10%中性福尔马林用于组织病理学观察。其余进行脏器称重并计算脏器系数(脏器系数=脏器重量/体重),并剪碎-80 ℃下保存备用。
1.3.5 血清生化与肝氧化应激指标检测
依照生化试剂盒(南京建成)说明书分别检测ALT、AST水平。严格按照说明书分别检测各组大鼠肝组织中GSH、MDA和SOD含量。
1.3.6 肝脏组织病理切片检测
肝组织样品经10%中性福尔马林固定15天后,石蜡包埋,切片(厚度:4 μm),苏木精-伊红(HE)染色,并通过Leica DFC显微拍照系统采集照片。肝组织固定于2.5%戊二醛后4 ℃过夜,包埋,切片,染色,电子显微镜用于超微形态学观察。
1.3.7 蛋白免疫印迹检测(Western blotting)
取各组大鼠肝脏,加入适量裂解液以及蛋白酶抑制剂,置于冰上裂解,低温匀浆30 min,提取蛋白。采用BCA法进行各样品蛋白浓度测定。吸取50 μg蛋白样品用于SDS-PAGE(5%浓缩胶,10%分离胶)检测,电泳结束后采用0.22 μm PVDF膜进行蛋白湿转,转膜1.5 h。5%脱脂奶粉封闭,封闭时间2 h。一抗SOD1(1∶500)、SOD2(1∶1 000)、Nrf2(1∶2 000)、HO-1(1∶6 000)和β-actin(1∶5 000),分别4 ℃过夜孵育;二抗HPR-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(1∶5 000),均于室温孵育1h。二抗孵育结束后用TBST洗涤,随后加入ECL化学发光液,置于Amersham Imager 600化学发光仪(GE Healthcare Bio-Sciences AB,Sweden)进行ECL化学发光信号的采集与拍照。运用Image J 软件对各组WB条带灰度值进行分析。
1.3.8 免疫组化检测
从组织蜡块切下4 μm厚的连续切片进行免疫组化,脱蜡处理,用3% H2O2室温进行阻断内源性酶,PBS洗涤,采用柠檬酸钠缓冲液煮沸15 min,进行抗原热修复。BSA 37 ℃封闭30 min,PBS洗涤,一抗4 ℃过夜孵育。PBS洗涤,37 ℃孵育二抗30 min。PBS洗涤,DAB镜下显色,水洗终止反应,苏木精复染,分化,水洗返蓝,脱水封片,显微镜拍照分析。
1.3.9 统计方法与相关性分析方法
2 结果
2.1 一般行为学考察
整个实验过程中,每组大鼠精神状态、营养状况良好,被毛整洁、平滑而有光泽。给药组相比较对照组体重增长缓慢,采食量降低,而饮水量无明显变化(见图1)。
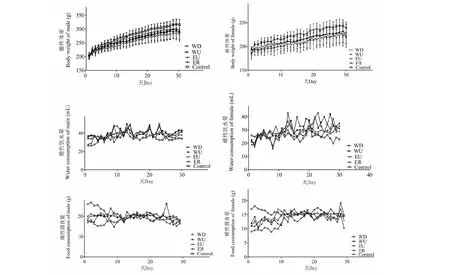
图1 苦豆子不同提取物对大鼠的一般行为学影响Fig.1 Effect of different extracts of Sophora alopecuroide on rats general behavior( =5)
2.2 苦豆子不同提取物对脏器系数的影响
ER雄性组肾脏系数相比较空白组明显升高(见图2,P<0.05)。不同提取物给药组肝脏系数相比较空白组呈现升高趋势,其中WD雄性组、WD雌性组、WU雌性组有显著性差异(P<0.05)。

图2 苦豆子不同提取物对大鼠脏器系数的影响Fig.2 Effect of different extracts of Sophora alopecuroides on rats organ coefficients( =5)
2.3 苦豆子不同提取物对AST、ALT指标的影响
AST、ALT是肝损伤的敏感性指标。如图3所示,苦豆子不同提取物给药后AST指标在雄性大鼠各组呈显著性升高(P<0.01),雌性WU组相比较空白组显著性升高。ALT在雄性大鼠中呈上升趋势,尤其在WD与ER组有显著性而在雌性大鼠血清中WD、WU、EU均发生显著性升高。
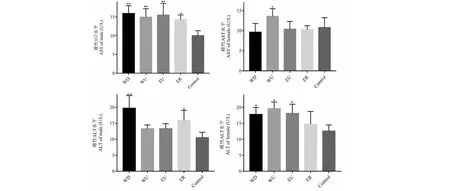
图3 苦豆子不同提取物对AST、ALT指标的影响Fig.3 Effects of different extracts of Sophora alopecuroides on AST and ALT indexes( =5)
2.4 苦豆子不同提取物对大鼠氧化应激指标的影响
大鼠肝脏组织氧化应激指标检测结果表明,与空白组相比较,四种提取物给药后各组雌雄大鼠肝组织氧化应激产物MDA含量明显升高(P<0.05),雄性大鼠肝脏GSH含量和SOD含量显著降低(P<0.05)(见表1)。雌性大鼠GSH给药各组与空白相比较有上升趋势,其中WD明显升高(P<0.001)(见表2)。结果表明苦豆子提取物可造成肝脏氧化损伤。
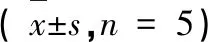
表1 不同提取物对雄性大鼠氧化应激指标的影响Table 1 Effect of different extracts on male rats oxidative stress indexes( =5)
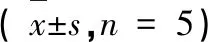
表2 不同提取物对雌性大鼠氧化应激指标的影响Table 2 Effect of different extracts on female rats oxidative stress indexes( =5)
2.5 组织病理学观察
肝脏HE染色检测发现,同空白组相比较,苦豆子不同提取物给药组均出现不同程度的肝细胞坏死。EU、ER组出现明显的炎症反应(见图4)。对大鼠各组肝脏进行电镜超微形态学观察,不同提取物给药后,肝脏出现明显的自噬情况,且肝细胞核形态发生改变,皱缩。肝脏线粒体发生嵴消失、肿胀等,尤以WD组最为明显(见图5)。从以上组织形态学结果中发现苦豆子可以通过发生炎症以及损伤线粒体从而对肝脏造成一定损伤。

图4 苦豆子不同提取物对大鼠肝脏HE染色观察的结果 Fig.4 HE staining results of rat liver by different extracts of S.alopecuroides注:黄色箭头代表炎症;绿色箭头代表坏死。Note:Yellow arrow:Inflammation;Green arrow:Necrosis.

图5 苦豆子不同提取物对大鼠肝脏超微形态学观察的结果Fig.5 Ultramorphologic observation results of different extracts of S.alopecuroides on rat liver注:红色箭头代表线粒体轻度肿胀;黄色箭头代表自噬;绿色箭头代表糖原颗粒。Note:Red arrow:Mitochondria slight swelling;Yellow arrow:Autophagy;Green arrow:Glycogen.
2.6 苦豆子不同提取物对Nrf2/HO-1信号通路的影响
通过免疫组织化学定位表达氧化应激Nrf2/HO-1通路中SOD1、SOD2、Nrf2、HO-1等关键蛋白发现Nrf2主要分布于肝细胞胞浆以及在胆管上皮细胞等。如图6所示,WD、WU、EU、ER各组给药后Nrf2蛋白表达明显降低,其中雄性组WD、WU、EU组Nrf2蛋白与空白相比较有显著性差异(P<0.05),雌性大鼠WD、EU、ER组Nrf2蛋白表达显著性降低(P<0.05)。HO-1蛋白主要分布于肝血窦中(见图8、图9),且四种提取物大鼠给药后表达均显著性降低(P<0.05,见图6)。SOD1主要分布于肝血窦中,蛋白在雌性大鼠肝脏中表达均显著性降低,而在雄性大鼠肝脏也呈下降趋势,WD、ER组最为明显(P<0.05)。SOD2主要分布在肝细胞胞浆中,在雄性各组大鼠肝脏表达中显著性降低,而在雌性大鼠各组中呈上升趋势,与空白组相比较WD、WU、ER有显著性差异(见图7)。

图6 苦豆子不同提取物对大鼠Nrf2、HO-1的影响(n = 3)Fig.6 Expression of Nrf2 and HO-1 in different extracts of S.alopecuroides (n =3)

图7 苦豆子不同提取物对大鼠对肝脏SOD1、SOD2蛋白表达的影响(n = 3)Fig.7 Protein expression of SOD1 and SOD2 in liver of rats with different extracts of S.alopecuroides (n =3)

图8 苦豆子不同提取物作用下的雄性大鼠肝脏免疫组化图Fig.8 Liver immunohistochemistry of male rats of different extracts of S.alopecuroides注:黄色箭头表示目的蛋白。Note:Yellow arrow:Target protein.

图9 苦豆子不同提取物作用下的雌性大鼠肝脏免疫组化图Fig.9 Liver immunohistochemistry of female rats of different extracts of S.alopecuroides注:黄色箭头表示目的蛋白。Note:Yellow arrow:Target protein.
3 讨论与结论
肝脏系数的变化可以作为肝脏发生病变的一个重要指标。苦豆子不同提取物给药后大鼠肝脏系数明显升高。肝脏系数的升高提示肝脏可能发生水肿、炎症等反应[11]。肝脏组织病理学观察发现肝细胞存在坏死,炎症细胞增多。通过对ALT、AST的肝脏损伤敏感性指标检测[11]发现,不同提取物给药后各组大鼠血清中ALT、AST水平不同程度地升高。说明苦豆子提取物长期给药后可以造成肝功能受损,这与文献报道一致[13,14]。为了进一步对苦豆子不同提取物肝脏毒性进行研究,本论文对肝脏进行微观形态学观察,发现大鼠肝脏线粒体肿胀,甚至嵴消失,并有明显的自噬现象。其中,自噬是机体清除异物,对外界不利因素做出的一种反应[13]。苦豆子提取物给药后大鼠肝脏发生明显的自噬现象,基础水平的自噬对细胞是一种保护性作用,但过度自噬会引起自噬性细胞死亡甚至加速疾病的进展[14],同时Ravanan等[15]证明通过抑制自噬可以降低NF-κB通路造成的炎症反应。苦豆子不同提取物给药后大鼠肝脏自噬程度增加,可能是苦豆子通过增加自噬来加速肝脏毒性。
线粒体是细胞的能量代谢中心,在细胞增殖、遗传信息传递、免疫调节和细胞生长周期调控、细胞凋亡等过程中发挥重要作用。同时也是细胞产生ROS类物质的关键场所,线粒体损伤功能障碍可引起机体代谢异常和器官功能衰退[16]。因此线粒体的损伤也有可能是肝脏发生毒性的重要原因,而本研究通过形态学观察发现,苦豆子不同提取物给药后大鼠肝脏线粒体发生肿胀,甚至嵴消失,尤其在WD组中表现最为明显。究其原因可能是线粒体损伤,引起ROS自由基生成增多,最终引起机体器官功能障碍[17,18]。本研究通过测定MDA、GSH、SOD等相关氧化应激指标后发现,大鼠肝脏毒性与氧化应激存在明显的相关性。苦豆子不同提取物在雌性与雄性大鼠给药后中均可以使氧化应激指标发生不同程度的显著性变化,其中MDA显著性升高,SOD与空白组相比较均发生显著性降低。MDA是脂质过氧化的最终产物,能反映脂质过氧化的程度,从而反映肝细胞损伤的程度[19]。在正常情况下,SOD能将超氧化物转化为H2O2,CAT能将H2O2转化为H2O,而GSH可直接通过供H+拮抗氧自由基毒性,清除体内的超氧离子及其他自由基,从而防止肝细胞损伤。事实上氧化应激在许多疾病的发病机制中都起着至关重要的作用,如结肠炎,动脉粥样硬化以及阿尔茨海默症等[20-22]。本研究发现苦豆子引起肝损伤主要机制为氧化应激。
Nrf2信号通路是机体内主要氧化应激抗氧化的主要通路,在正常情况下,Nrf2主要与Keap1结合形成一个复合物存在于细胞浆中[23,24],保持较低的水平以维持细胞稳态,当机体受到外界刺激,例如药物刺激以及氧自由基等的存在会使Nrf2与Keap1形成的复合物分离,Nrf2蛋白积累并移至细胞核内。在细胞核中,Nrf2与抗氧化反应元件ARE结合,诱导下游抗氧化蛋白HO-1、SOD1的表达[25]。SOD2主要分布线粒体中,是线粒体中清除氧自由基保护线粒体内环境稳定关键蛋白,其活性会随着机体内ROS的改变而变化[26]。HO-1、SOD1可以通过催化血红素降解生成胆红素,CO和Fe2+这些都可以发挥积极的抗氧化作用[26]。SOD2又称Zn-SOD,可以清除超氧阴离子[28]。Western blotting结果显示雄性组WD、WU、EU提取物给药后大鼠肝脏Nrf2蛋白与空白相比较有显著性差异,HO-1蛋白在四种提取物大鼠给药后表达均显著性降低(P<0.05,见图6),SOD1蛋白在雌性大鼠肝脏中表达均显著性降低,而在雄性大鼠肝脏也呈下降趋势,WD、ER组最为明显(P<0.05),SOD2蛋白在雄性各组大鼠肝脏表达中显著性降低,而在雌性大鼠各组中呈上升趋势,与空白组相比较WD、WU、ER有显著性差异。虽然雌雄大鼠指标变化存在差异,但都能通过影响大鼠肝氧化应激指标而造成肝毒性。雌性大鼠在氧化应激状态下可能为了维持体内的平衡通过代偿性来恢复抗氧化功能。在前期进行急性毒性实验时发现,雄性小鼠对不同提取物的毒性更为敏感,死亡率高[10],且雌雄大鼠生理结构不同,这也可能导致各项指标在雌雄大鼠中表现出一定的差距。Chen等[29]对金铁锁提取物进行小鼠和大鼠的急性和亚急性毒性实验时,也同样发现雌雄大鼠指标出现明显差异。
综上所述,苦豆子提取物可以造成肝毒性,其毒性主要是调控Nrf2/HO-1通路中相关蛋白造成机体氧化应激。

