猕猴桃AcbHLH137功能鉴定及对淀粉降解基因AcBAM3转录激活分析
刘 璐 王 康 韩一璐 杨民杰 陈 伟 曹士锋 施丽愉
(浙江万里学院生物与环境学院,浙江 宁波 315100)
淀粉(C6H10O5)n是植物中最重要的多糖类物质,由α-1,4糖苷键和α-1,6糖苷键连接形成的葡萄糖分子聚合而成,可依据所含葡萄糖分子的数目以及是否可溶分为直链淀粉和支链淀粉[1-2]。果实的细胞中充斥着大量的淀粉,可以起到维持细胞膨压,保持果实硬度的作用[3-4]。未成熟的香蕉、苹果、猕猴桃等果实含有大量淀粉[5-6]。淀粉酶在猕猴桃果实采后阶段起着关键作用,此时淀粉会被降解,果实细胞的支持力减弱,果实硬度也急速下降[7-9]。猕猴桃果实富含大量淀粉,果实后熟软化与淀粉降解存在密切的关系,且降解后的淀粉会转化为可溶性糖,提高果实的口感[10-11]。
大量研究表明多种酶协同参与淀粉降解过程[12-13]。支链淀粉上的C6和C3键分别受到葡聚糖水合双激酶(glucan water dikinase,GWD)、磷酸化葡聚糖水合双激酶(phosphoglucan water dikinase,PWD)的催化,发生磷酸化反应,导致淀粉粒结构松散[14-15]。松散的淀粉粒在异淀粉酶(isoamylase,ISA)的催化下分解为可溶线性葡聚糖分子,再由β-淀粉酶(β-amylase, BAM)催化水解生成麦芽糖。BAM主要在果实发育后期及后熟过程中发挥功能。Maria等[16]发现在樱桃番茄的后期发育和成熟过程中,BAM活性增强,该编码基因的转录丰度增加,导致樱桃番茄中淀粉消耗及可溶性固形物含量增加。在猕猴桃果实后熟过程中,淀粉迅速降解,BAM基因的表达量显著上调[17]。在香蕉果实成熟的整个过程中BAM基因的表达增加[18]。此外,萧允艺[19]研究发现香蕉果实中的MaBAM1、MaBAM2、MaBAM3、MaBAM4、MaBAM6、MaBAM8、MaBAM10受乙烯诱导表达量增加。因此,BAM在果实采后淀粉降解过程中发挥着关键作用。
研究发现,植物淀粉降解受到转录因子的直接调控[20-22]。Wang等[23]研究发现,microRNA可以介导猕猴桃果实中NAC转录因子(NAC domain transcription factor)调控下游靶基因并参与果实的后熟机制;乙烯响应因子ERF(ethylene response factor)通过调控参与猕猴桃果实细胞壁降解基因的表达,进而调控猕猴桃果实的成熟衰老[24]。bHLH转录因子家族是植物第二大转录因子超家族,广泛存在于动植物及微生物中,得名于其保守的bHLH结构域。bHLH结构域由2个功能不同的区域组成,约含60个氨基酸,即长度为15~17个氨基酸的碱性区(basic)和长度约为40个氨基酸的螺旋-环-螺旋区(HLH)[25-26]。位于bHLH结构域N端的碱性区具有结合目的DNA的功能;C端的HLH区含有2个相邻的α螺旋。相同或不同bHLH转录因子的2个α螺旋可以相互作用形成同源或异源二聚体,该二聚体正是bHLH行使功能的关键[26-27]。萧允艺[19]在香蕉果实中发现,MabHLH6转录因子可以激活MaBAM2、MaBAM8、MaBAM10的启动子活性,促进这些BAM基因的表达,从而促进淀粉的降解。
陈景丹等[28]研究发现,淀粉的降解是导致猕猴桃果实软化的重要原因之一,而AcBAM3是猕猴桃果实采后淀粉降解的关键基因。有研究报道C2H2型锌指蛋白AdDof3可显著转录激活猕猴桃β-淀粉酶编码基因AdBAM3启动子并促进猕猴桃淀粉的降解[24,29]。但有关bHLH转录因子对猕猴桃果实淀粉降解的转录调控机制研究还鲜见报道。为此,本研究从猕猴桃中克隆获得1个AcbHLH137基因,并对其进行初步的生物信息学分析,通过实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)分析AcbHLH137基因在猕猴桃果实不同组织和果实采后贮藏期间的表达水平,同时通过双荧光素酶试验研究AcbHLH137转录因子对AcBAM3基因启动子的转录调控作用,最后利用AcbHLH137在烟草叶片瞬时过表达验证AcbHLH137转录因子对NbBAM3基因表达以及淀粉降解的调控作用,以期为揭示猕猴桃淀粉降解转录调控机制奠定一定的理论基础。
1 材料与方法
1.1 试验材料
以宁波奉化佳恒农业开发有限公司种植的6—7年生2倍体青皮红香猕猴桃(ActinidiachinensisQingpihongxiang)及其不同组织样品为供试材料。猕猴桃成熟果实于盛花期后130 d采收,其余组织于盛花期后30 d采集,包括根(直播苗)、茎(长度约7~8 cm)、叶(嫩叶)、藤、幼果。将所有采集的样品放入预冷的袋子中迅速运送回实验室,液氮冻结取样,置于 -80℃ 保存。其中,贮藏期间的样品采后散去田间热后,挑选大小均一、表面光滑无破损、相对成熟度一致(可溶性固形物含量约为7%)的果实,随机选60个果实,贮藏于20℃,每组设置3个重复。随机选取外果肉液氮冻结,-80℃贮藏,每2 d取样一次,用于后续试验。
1.2 植物组织总RNA的提取及cDNA的合成
选用Omega Plant RNA Kit(50)试剂盒(Omega公司,美国)提取猕猴桃果实总RNA。由于猕猴桃根、茎、叶组织中富含多糖类物质,选择改进的植物总RNA提取试剂盒HiPure Universal RNA Kit(美基公司,广州)提取猕猴桃果实组织总RNA。利用NanoDrop2000核酸蛋白仪(Thermo,美国)检测总RNA的浓度,采用1.5%琼脂糖凝胶电泳检验总RNA质量。利用HiFiScript cDNA Synthesis Kit逆转录试剂盒(康为世纪,北京)将提取的总RNA反转录成cDNA第一链。
1.3 猕猴桃AcbHLH137基因克隆
参考本实验室前期对猕猴桃果实不同处理的转录组测序结果,从前期获得的猕猴桃转录组测序数据库中筛选出1个bHLH家族候选基因CEY00_Acc22104,在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中对该基因的氨基酸序列进行BLAST比对,发现该序列与猕猴桃果实中bHLH137(登录号:PSR95969.1)序列完全一致,因此将该基因命名为AcbHLH137。利用Oligo7软件设计该基因的克隆引物(表1)。以获得的猕猴桃cDNA为模板进行PCR扩增,扩增体系10 μL(3.2 μL ddH2O、0.4 μL上游引物、0.4 μL下游引物、1 μL cDNA、5 μL 2x Phanta Max Master Mix)。反应程序如下:95℃预变性3 min;95℃变性15 s,61℃退火15 s,72℃延伸1 min,30个循环;72℃终延伸5 min。通过1.5%琼脂糖凝胶电泳验证目的条带大小后进行割胶回收,割胶产物与载体PMD18-T连接后转化至大肠杆菌(DHα105)感受态细胞,涂板,次日经菌落PCR鉴定阳性菌,摇菌提质粒送杭州擎科生物测序。
1.4 实时荧光定量PCR(qRT-PCR)
从猕猴桃基因组数据库及NCBI下载并比对各基因全长序列,使用Beacon 7软件对基因编码区序列设计qRT-PCR引物(表1),以1.2中得到的cDNA为模板,AcActin为内参,使用FS Universal SYBR Green Master(Roche,德国)试剂、Step DneplusTM荧光定量PCR仪(ABI,美国)完成,采用2-ΔΔCT方法[30]分析AcbHLH137在猕猴桃不同组织样品和不同贮藏时间中的表达水平,每个样品设置3次生物学重复。
1.5 AcbHLH137生物信息学分析
根据已经获得的AcbHLH137序列,利用在线软件(Expasy Translate Tool/ProtParam)得到该基因的氨基酸序列并分析该序列的氨基酸特性[31]。通过NCBI的保守结构域分析程序(https://www.ncbi.nlm.nih.gov/Structure)进行AcbHLH137的保守结构域确定。通过NCBI-BLAST(http://www.ncbi.nlm.nih.gov/blast)检索AcbHLH137的同源性物种,不同物种间同源基因的序列比对使用Clustal X1.83、Gendoc软件进行分析,用邻接法(neighbor-joining,NJ)结合MEGA 7.0软件构建系统进化树[32-33]。
1.6 AcbHLH137亚细胞定位分析
根据AcbHLH137的开放阅读框(open reading frame,ORF)序列设计带有酶切位点的引物(表1),利用同源重组方法将AcbHLH137基因的ORF序列插入pCAMBIA-1301-GFP载体的NcoⅠ和SpeⅠ区域,将获得的连接产物转化到DH5α感受态细胞,经菌落PCR筛选阳性菌并提取质粒,获得绿色荧光蛋白(green fluorescent protein,GFP)与目的基因的融合表达载体AcbHLH137-GFP[34-35]。
烟草叶片的瞬时转化及激光共聚焦显微观察:将构建好的载体质粒采用电击转化法转入农杆菌感受态 EHA105,28℃培养2 d;将单菌落从固体培养基挑出接种于5 mL LB液体培养基中悬浮培养8 h,取菌液2 mL接种于20 mL LB液体培养基中悬浮培养至OD600为1.0左右;注射烟草下表皮,培养3 d,取样,在激光共聚焦荧光显微镜下观察荧光信号。
1.7 LUC/REN双荧光素酶试验
将AcbHLH137基因的ORF序列插入到pGreenII 62-SK载体的BamH Ⅰ和HindⅢ两个酶切位点之间,将AcBAM3的启动子序列插入到pGreenII 0800-LUC载体的NcoⅠ和Bam HI两个酶切位点区域之间,扩增引物见表1。将构建好的重组载体CaMV35S-AcbHLH137和AcBAM3pro-LUC/CaMV35S-REN通过电击转入农杆菌(EHA105)感受态细胞中,CaMV35S-AcbHLH137作为该试验的效应基因(Effector重组载体),AcBAM3pro-LUC/CaMV35S-REN则作为报告基因(Reporter重组载体),且将空载体CaMV35S-Empty作为阴性对照。效应基因(Effector重组载体)与报告基因(Reporter重组载体)按照8∶1体积比混合注射于本氏烟草叶片背面,将注射后的烟草置于光照培养箱中3 d。取注射区域直径1 cm圆片,采用Dual-Luciferase© Reporter Assay System试剂(Promega,美国)和Luminoskan Ascent化学发光分析仪(Thermo,美国) 测定萤火虫荧光素酶(firefly luciferase,LUC)和海肾荧光素酶(renilla luciferase,REN)的比值(LUC/REN),每组试验设置5个生物学重复。
1.8 CaMV35S-AcbHLH137瞬时过表达本氏烟草叶片
将1.7中构建的CaMV35S-AcbHLH137载体瞬时注射本氏烟草叶片,置于光照培养箱中培养7 d,以注射空载体CaMV35S-Empty作为对照。将注射的烟草叶片放入60℃的80%乙醇中温浴脱色8 h,待绿色褪去后,用蒸馏水清洗,置于碘液中2 min,用蒸馏水冲洗直至碘液底色褪去,拍照。参照1.2中的方法提取注射烟草叶片的总RNA,合成cDNA,通过荧光定量PCR测定本氏烟草叶片中AcbHLH137和NbBAM3基因的表达水平。相关引物见表1。
参考苗红霞等[36]的方法测定注射部位的淀粉含量,烟草叶片注射部位液氮冻结后研磨成粉末取0.05 g,5 mL 80%乙醇匀浆,10 000 r·min-1离心15 min,弃上清液;用5 mL ddH2O匀浆,洗涤沉淀,10 000 r·min-1离心15 min,弃上清液;用2.5 mL 80% Ca(NO3)2溶解,沸水浴10 min,4 000 r·min-1离心4 min,收集上清液。重复上述操作3次,定容至10 mL,取2 mL提取液加100 μL 0.01 mol·L-1I2-KI于600 nm波长处测定吸光值。采用100 μg·mL-1可溶性淀粉标准液绘制标准曲线,根据曲线得淀粉含量,设置3次重复,结果以mg·g-1FW表示。
1.9 数据分析与统计
采用GraphPad Prism 7软件绘图,结果以平均值±标准偏差表示。采用非配对T检验进行显著性分析(P<0.05)。
2 结果与分析
2.1 AcbHLH137基因序列与蛋白特征分析
以青皮红香猕猴桃果实cDNA为模板,对AcbHLH137基因进行qRT-PCR扩增,得到长度约为1 000 bp 的扩增片段。测序结果表明,AcbHLH137基因的ORF长度为969 bp。BLAST结果显示,该基因序列含有碱性区(basic)和螺旋-环-螺旋区(HLH),其为bHLH转录因子特征结构域(图1)。AcbHLH137基因编码323个氨基酸,预测蛋白质分子量为36.27 kDa,等电点(pI)为6.46,不稳定系数为51.68,属于不

表1 引物序列Table 1 Primers sequences

图1 AcbHLH137蛋白中HLH结构域分析Fig.1 Analysis of HLH domain in AcbHLH137 protein
稳定蛋白质。该蛋白的平均疏水系数为-0.611,属于亲水性蛋白。亚细胞定位预测发现AcbHLH137蛋白定位在细胞核,与转录因子的功能定位特征相一致。
2.2 AcbHLH137蛋白的氨基酸序列比对与进化树分析
对猕猴桃AcbHLH137基因的ORF序列进行NCBI-BLAST分析,发现AcbHLH137编码氨基酸序列与茶树(CsbHLH137,XP_028125498.1)的氨基酸序列相似率较高,达到98%。利用Clustal X1.83和Genedoc软件对AcbHLH137和其他9个物种的bHLH蛋白氨基酸序列进行比对,结果发现AcbHLH137蛋白的N端含有bHLH转录因子共有的碱性区(basic)和螺旋-环-螺旋区(HLH)保守结构域(图2)。为了研究不同物种之间bHLH137蛋白的进化关系,利用MEGA7软件通过NJ法分析中华猕猴桃AcbHLH137与茶、蓝果树、白桦、葡萄、杏、桃、枇杷、番木瓜、香蕉之间的进化关系(图3),结果表明,AcbHLH137与茶树(CsbHLH137,XP_028125498.1)聚类于同一分支,亲缘性较好。

图2 猕猴桃AcbHLH137蛋白与其他物种中bHLH137蛋白的氨基酸序列比对Fig.2 Comparison of amino acid sequence of kiwifruit AcbHLH137 protein with bHLH137 protein in other species
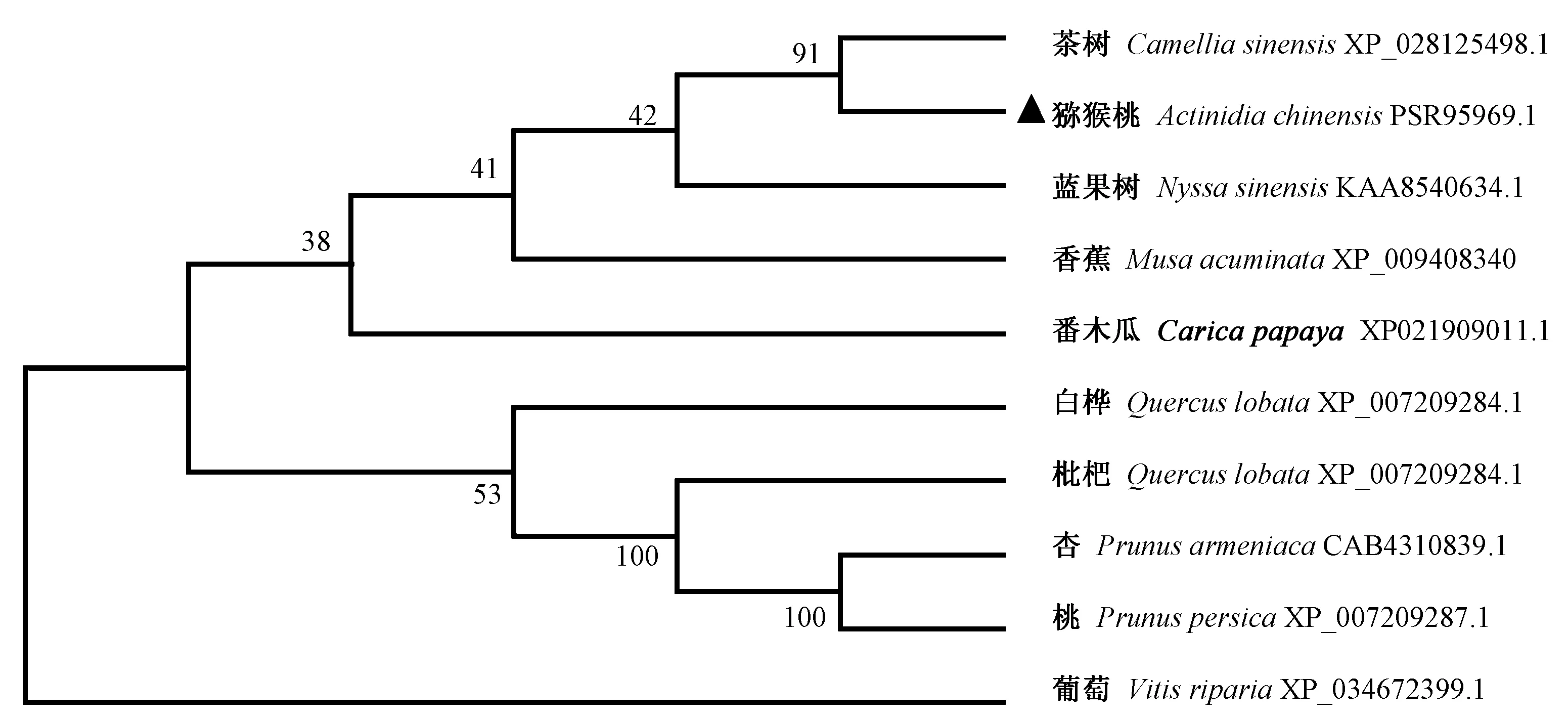
图3 AcbHLH137基因系统发育树Fig.3 Phylogenetic trees of AcbHLH137
2.3 AcbHLH137基因表达分析
对不同猕猴桃组织(根、茎、叶、藤、幼果、果实)中AcbHLH137基因表达水平进行分析,结果表明,AcbHLH137基因在根、茎、叶、藤4个组织中均有表达,其中在茎中的表达量最高,其次是叶。对于果实组织,AcbHLH137在幼果中几乎不表达,但在成熟果实中大量表达。在猕猴桃所有组织中,AcbHLH137在成熟果实和茎中表达量最高(图4-A)。在猕猴桃果实采后贮藏期间,AcbHLH137基因表达量整体表现为上升趋势,且表达量在贮藏后期(8~10 d)急剧升高(图4-B)。

注:不同小写字母表示在 0.05 水平差异显著。Note: Different lowercase letters mean significant difference at 0.05 level.图4 AcbHLH137基因在猕猴桃不同组织(A)和不同贮藏时间(B)中的表达Fig.4 Expression of AcbHLH137 gene in different tissues(A) and different storage time(B) in kiwifruit
2.4 AcbHLH137亚细胞定位分析
将AcbHLH137-GFP重组载体转化本生烟叶片中瞬时表达,叶片表皮细胞的荧光信号结果如图5所示。对照GFP蛋白在整个细胞的细胞核和细胞质都有分布,而AcbHLH137-GFP细胞中只有细胞核中能观察到绿色荧光,表明该转录因子定位在细胞核中,这与转录因子的功能定位相一致。
2.5 AcbHLH137转录因子对AcBAM3基因启动子的转录调控特性
前期研究发现β-淀粉酶基因AcBAM3是猕猴桃果实采后后熟过程中淀粉降解的关键基因,同时是转录因子调控淀粉降解的关键靶基因[28]。为了明确AcbHLH137转录因子对猕猴桃淀粉降解的调控功能,采用LUC/REN双荧光素酶试验研究AcbHLH137转录因子对AcBAM3基因启动子的转录调控特性。重组载体构建如图6-A所示,利用同源重组法将AcBAM3基因插入pGreenII 0800-LUC构建Reporter重组载体,将基因AcbHLH137 ORF序列插入pGreenII 62-SK构建Effector重组载体。双荧光素酶试验结果如图6-B所示,与未含AcbHLH137基因的空载体相比,AcbHLH137转录因子与AcBAM3启动子的共同转化使LUC/REN的比值显著提高(P<0.001)。这说明AcbHLH137转录因子对AcBAM3启动子具有转录激活功能。
2.6 AcbHLH137瞬时表达促进本氏烟草淀粉降解
为了进一步验证AcbHLH137转录因子对淀粉降解的调控功能,将上述已构建的Effector重组载体注射本氏烟草叶片进行AcbHLH137基因瞬时过量表达,图7-A为AcbHLH137基因成功瞬时表达。如图7-B所示,烟草叶片中未含AcbHLH137基因的空载体注射区域经I2-KI染色后呈紫色,而AcbHLH137瞬时过表达区域经I2-KI染色后未出现紫色。该现象与空载体注射的叶片区域中淀粉含量显著高于AcbHLH137瞬时过表达区域的结果相一致图7-C(P<0.001)。对过表达烟草叶片中NbBAM3基因的表达量进行分析,结果如图7-D所示,AcbHLH137转录因子瞬时过表达显著提高了叶片中NbBAM3基因的表达水平(P<0.05)。
3 讨论
bHLH转录因子构成了植物中一类重要的转录因子家族。植物bHLH转录因子是一个庞大的多基因家族,可以被分成6个类别[37]。bHLH转录因子因含有2个功能不同且保守的结构域而得名,即碱性区(basic)和螺旋-环-螺旋区(HLH)[38]。本研究从猕猴桃果实中克隆获得了AcbHLH137基因。生物信息学分析表明,AcbHLH137与其他物种bHLH转录因子高度同源,并且其氨基酸序列上含有bHLH转录因子共有的保守bHLH结构域。亚细胞定位结果表明AcbHLH137定位于细胞核,具有转录因子特征。上述结果表明AcbHLH137属于bHLH家族转录因子。
植物bHLH转录因子在植物的许多生理途径中起着重要的调控作用,如调控植物器官发育[39]、光敏色素途径[40]、原花色素合成[41]、植物激素应答[42]和花朵衰老[43]等。本研究中猕猴桃的根、茎、叶、藤、果实等组织中均检测到AcbHLH137基因表达,表明该基因可能参与了猕猴桃的各生长发育过程。萧允艺[19]发现MabHLH6转录因子参与了香蕉果实采后成熟进程,MabHLH6转录因子能激活淀粉降解基因启动子活性,诱导该类基因的表达,从而促进果实中淀粉的降解。本研究发现猕猴桃AcbHLH137与MabHLH6的保守结构域序列高度相似并且在果实采后后熟期间都呈表达上调模式。在猕猴桃果实采后后熟期间,AcbHLH137表达水平的上升趋势与该期间淀粉迅速降解的下降趋势恰好相反。这些结果暗示着AcbHLH137可能具有与MabHLH6类似的功能,即可能也正向调控果实淀粉降解。在淀粉降解过程中,BAM是催化淀粉水解的重要酶之一[44]。陈景丹等[28]研究发现β-淀粉酶基因AcBAM3在猕猴桃果实淀粉降解中起关键作用,其在猕猴桃果实采后成熟进程中表达模式与AcbHLH137相一致。本研究利用LUC/REN双荧光素酶试验明确了AcbHLH137转录因子能激活AcBAM3启动子活性。同时,AcbHLH137基因在本氏烟草叶片中瞬时过表达降低了叶片的淀粉含量,并显著提高了烟草β-淀粉酶基因NbBAM3的表达水平。综上所述,AcbHLH137转录因子可能通过上调β-淀粉酶基因AcBAM3促进猕猴桃果实淀粉降解,但具体调控机制有待进一步深入研究。
4 结论
本研究从猕猴桃果实中克隆了1个bHLH基因AcbHLH137,其ORF序列长度为969 bp,编码323个氨基酸,含有bHLH特有的保守结构域,定位于细胞核。在猕猴桃果实采后淀粉降解期间,AcbHLH137表达量呈上升趋势。LUC/REN双荧光素酶试验结果表明AcbHLH137能激活AcBAM3启动子活性。烟草瞬时过量表达AcbHLH137基因进一步验证了AcbHLH137转录因子能促进淀粉降解。

