电解水对荞麦芽酚酸含量及抗氧化能力的影响
刘 瑞 于章龙 孙元琳 王 慧 李云龙 周素梅
(1 运城学院生命科学系/特色农产品加工山西省重点实验室,山西 运城 044000;2 山西农业大学棉花研究所,山西 运城 044000;3 山西农业大学山西功能食品研究院,山西 太原 030031;4 北京工商大学食品与健康学院,北京 100048)
我国是荞麦种植及生产大国,栽培品种主要有苦荞和甜荞,分别可称为鞑靼荞麦和普通荞麦[1]。荞麦作为一种药食同源植物,含有丰富的蛋白质[2]、不饱和脂肪酸[3]、D-手性肌醇[4]、抗性淀粉[5]和多酚类[1]等活性成分。研究表明,可食性种子萌发后其营养价值和功能显著提升[6-7],因而发芽食品得到消费者越来越多的关注和认可。但种子在发芽过程中易受到微生物污染,严重影响发芽食品的产量和品质。
电解水作为一种高效、安全、无污染无残留且制取方便、价格低廉的杀菌剂,在解决芽苗菜生产中的保鲜问题方面,相比传统杀菌剂具有很多优势。据报道,电解水不仅可以降低芽苗菜表面微生物数量,还可提升芽苗菜营养成分含量,如超声波辅助酸性电解水处理绿豆芽可以显著降低绿豆芽表面的微生物数量[8];碱性电解水前处理可以显著提高酸性电解水对黄豆、绿豆、苜蓿、萝卜、糙米等种子的杀菌效果[9-10]。适宜理化指标的电解水可表现出对发芽谷物的生长促进作用,主要是由于电解水中含有活性氧成分,激发了种子内部的抗氧化酶系活力,调控了植物激素水平[11-12]。微酸性电解水有利于发芽糙米[10]、发芽荞麦[13]中γ-氨基丁酸的积累。使用微酸性电解水制备高活性成分发芽荞麦有助于其还原糖含量和芦丁含量的增加[9]。
目前,发芽荞麦中酚酸富集技术缺乏相关研究,基于电解水在种子、芽苗消毒及活性成分富集方面的应用研究,使用电解水制备高活性成分发芽荞麦具有可行性。本研究采用电解水制备荞麦芽,考察不同理化指标电解水处理后,荞麦发芽率、芽长、总酚含量、2,2-联苯基-1-苦基肼基(2,2-diphenyl-1-picrylhydrazyl,DPPH)自由基清除能力、2,2-联氮双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid ammonium salt),ABTS]自由基清除能力和铁离子还原力随时间的动态变化情况。另外考虑到蔬菜中酚酸的测定多是通过传统方法直接提取分析,只得到游离型酚酸含量的测定结果,而蔬菜中的酚酸多以结合形式存在,因此本研究进一步对发芽7 d荞麦芽的游离酚和结合酚的种类及含量进行研究,以期更全面地解释发芽荞麦的营养价值,为电解水应用于发芽荞麦功能食品的制备提供理论依据。
1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
XY-L-150电解水生成器,宝鸡新宇光机电有限责任公司;pH/ORP计,杭州奥立龙仪器有限公司;HWS-160恒温恒湿培养箱,宁波江南仪器厂;KQ300DE超声波清洗机,昆山舒美超声仪器有限公司;TGL-16M冷冻高速离心机,长沙湘仪离心机仪器有限公司;Scient2-ND真空冷冻干燥机,宁波新芝生物科技股份有限公司;AcquityTM超高效液相色谱仪-TQS串联质谱仪,美国Waters公司。
1.3 试验方法
1.3.1 电解水的制备 强酸性电解水和强碱性电解水通过在XY-L-150电解水生成器中电解16 g·L-1NaCl溶液,由机器出水口直接获取;微酸性电解水通过在自制电解槽中电解15 mmol·L-1HCl溶液获得;弱碱性电解水是在强碱性电解水基础上通过稀释调节pH值得到试验用电解水均盛放于深色密闭容器中,并于制备后尽快用完。电解水的有效氯浓度用碘量法测定[14]。电解水理化指标如表1所示。

表1 电解水理化指标Table 1 Physicochemical parameters of electrolyzed water
1.3.2 荞麦芽的制备 准确称取30 g荞麦种子,用相应处理液(表1)淋洗5遍,沥干后将荞麦种子在相应处理液(表1)中以1∶6(g·mL-1)比例浸泡8 h。然后将浸泡好的种子置于底部有孔的发芽盒中于恒温恒湿培养箱(25℃,湿度85%)中遮光发芽。发芽期间,每日用处理液(表1)淋浇荞麦芽3次。分别于培养第1、第3、第5、第7天取样进行真空冷冻干燥,磨粉冷藏备用。
1.3.3 发芽率和芽长的测定 培养18~67 h(从荞麦种子浸泡之后放进培养箱起计时),定期统计各处理组发芽率,冒有白尖的荞麦种子即认为已发芽。在培养荞麦芽83~167 h内,每日从各处理组随机抽取30根荞麦芽用直尺测量其芽长,统计其平均值。
1.3.4 荞麦芽样品总酚含量的测定 将荞麦芽冻干粉与50%乙醇溶液以1∶50(w∶v)的比例混匀,于超声波清洗器中60 kHz,25℃处理30 min,然后于4 800 r·min-1离心15 min,上清液用于总酚含量测定。荞麦芽样品中总酚含量采用Folin-Ciocalteu法[15]测定。用没食子酸作标准曲线定量测定样品中总酚含量。拟合标准曲线线性回归方程为y=0.719x-0.001 (R2=0.997 6),y为吸光值,x为没食子酸质量浓度(mg·mL-1)。
1.3.5 荞麦芽样品DPPH自由基清除能力的测定 样品前处理同1.3.4,荞麦芽样品DPPH自由基清除能力的测定参考文献[16]。用Trolox溶液作标准曲线定量测定样品DPPH自由基清除能力,即待测样品DPPH自由基清除能力用Trolox当量值来表示。拟合标准曲线回归方程为y=78.01x+13.16 (R2=0.996 2),y为DPPH自由基清除率(%),x为Trolox浓度(mmol·L-1)。
1.3.6 荞麦芽样品ABTS自由基清除能力的测定 样品前处理同1.3.4,荞麦芽样品ABTS自由基清除能力的测定参考文献[17]。用Trolox溶液作标准曲线定量测定样品ABTS自由基清除能力,即待测样品ABTS自由基清除能力用Trolox当量值来表示。拟合标准曲线回归方程为y=44.91x-3.15 (R2=0.997 1),y为ABTS自由基清除率(%),x为Trolox浓度(mmol·L-1)。
1.3.7 荞麦芽样品铁离子还原能力的测定 样品前处理同1.3.4,荞麦芽样品铁离子还原能力的测定参考文献[18]。用Trolox溶液作标准曲线定量测定样品铁离子还原能力,即待测样品铁离子还原能力用Trolox当量值来表示。拟合标准曲线回归方程为y=0.386 4x+0.247 3 (R2=0.998 2),y为铁离子还原能力(△A),x为Trolox浓度(mmol·L-1)。
综上所述,急性左心衰病人减少急诊留置时间,尽早进行专科规范化治疗,可显著缩短病程,降低死亡率和减轻病人医疗负担。
1.3.8 荞麦芽样品游离酚和结合酚含量的测定 荞麦芽样品游离态和结合态酚类物质的提取与测定参照文献[19-20]。色谱条件:Waters HSS T3色谱柱(150 mm×2.1 mm,1.8 μm);流动相A为0.1%甲酸,B相为乙腈(含0.1%甲酸);梯度洗脱:0~0.5 min,95%A,5%B;0.5~5 min,95%A,5%B;5~9.5 min,70%A,30%B;9.5~9.75 min,10%A,90%B;9.75~12 min,95%A,5%B。流速0.3 mL·min-1;柱温40℃;进样量5 μL。质谱条件:电离源模式为电喷雾离子化,采用多反应监测(multiple reaction monitoring,MRM)模式进行检测;负离子模式扫描;雾化气为氮气;碰撞气(高纯氩气)流速0.13 mL·min-1;离子源温度150℃;脱溶剂气温度500℃;脱溶剂气流量1 000 L·h-1。
1.4 数据分析
除芽长测定取30根荞麦芽量取长度求平均以外,其余试验均重复3次,并用SPSS 22.0中的Duncan方差分析比较处理组间的差异显著性,差异显著性水平为P<0.05。
2 结果与分析
2.1 电解水对荞麦发芽率的影响
由图1可知,在36~67 h的观测时间内,电解水对荞麦种子发芽具有一定的促进作用,且酸性电解水对荞麦种子发芽的促进作用优于碱性电解水。pH值5.02时,有效氯浓度22.85 mg·L-1的酸性电解水处理组荞麦种子在培养至67 h时发芽率达到98%,比自来水处理组发芽率提高16个百分点。

图1 电解水对荞麦发芽率的影响Fig.1 Effect of electrolyzed water on the germination rate of buckwheat seeds
前人研究表明,电解水(pH值2.5~6.0,有效氧浓度30 mg·L-1)相比自来水而言,能够促进荞麦种子的萌发[21]。将荞麦种子浸泡于pH值5.5、有效氯浓度为10~60 mg·L-1的微酸性电解水中也能促进荞麦种子萌发[22]。本研究结果表明,除酸性电解水外,碱性电解水也表现出对荞麦种子萌发的促进作用。这可能是由于酸性电解水的氧化还原电位较高,且含有HClO、ClO-和Cl2等有效氯成分[23],而碱性电解水具有相对较低的氧化还原电位和较高的pH值,具有一定杀菌作用,从而为种子的萌发提供了良好的环境条件,且可以提高种子中淀粉酶、蛋白酶、植酸酶、脂肪酶等多种酶活性,促进发芽[24]。
2.2 电解水对荞麦芽长的影响
由图2可知,在观测期间内,酸性电解水对荞麦芽的生长表现出更为明显的促进作用,如pH值3.21和pH值5.02的酸性电解水处理组荞麦芽在发芽167 h时,芽长分别为8.73和8.58 cm,比自来水对照组分别高出54.05和51.40个百分点(图2)。
前人研究表明,相比自来水而言,无论是在浸泡阶段还是淋浇阶段使用微酸性电解水处理荞麦种子,均能促进荞麦芽的生长[21]。同类研究也表明,微酸性电解水还可以促进绿豆芽、黄豆芽和发芽糙米的生长[10,25-26]。且研究已证实微酸性电解水促进绿豆芽的生长与电解水对于绿豆芽抗氧化酶系活性的调节有关,酸性电解水中所含有的活性氧成分有利于促进芽苗的生长[11]。

图2 电解水对荞麦芽长的影响Fig.2 Effect of electrolyzed water on the length of buckwheat sprouts

图3 各处理组荞麦芽照片Fig.3 The photograph of buckwheat sprouts of each treatment
2.3 电解水对荞麦发芽期间总酚含量的影响
由图4可知,EW11碱性电解水处理组荞麦芽在发芽第1天总酚含量达到较高水平,为31.99 mg·g-1, 后期该处理组荞麦芽总酚含量有所降低,维持在稳定水平。其余处理组荞麦芽总酚含量均随发芽时间延长而增加。酸性电解水处理组荞麦在发芽3~7 d时,其总酚含量均高于自来水对照组。到发芽第7天,pH值5.02处理组荞麦芽总酚含量为38.29 mg·g-1,显著高于对照组(P<0.05)。
当植物体处于逆境胁迫时,会激发体内苯基丙酸类物质代谢路径的酶活性,包括苯丙氨酸解氨酶(phenylalanineammonialyase,PAL)等,这会导致植物体内酚类化合物的积累[27]。电解水与自来水的理化指标不同,因此用电解水处理荞麦芽,会使荞麦芽体内发生相应的胁迫应激反应,从而产生更多的酚类物质以抵御环境对机体造成的损伤[28],因而电解水处理有利于荞麦芽酚类物质的积累。前人研究表明,相比自来水对照,有效氯浓度为10~30 mg·L-1的微酸性电解水促进了发芽第7天荞麦芽总酚的积累[1]。但目前缺少碱性电解水对荞麦发芽期间总酚含量的影响研究。本研究结果表明,在1~7 d的观测期内,pH值11.13的强碱性电解水有利于发芽早期荞麦芽总酚的积累,而在发芽后期,酸性电解水和弱碱性电解水均表现出对荞麦芽总酚积累的促进作用。
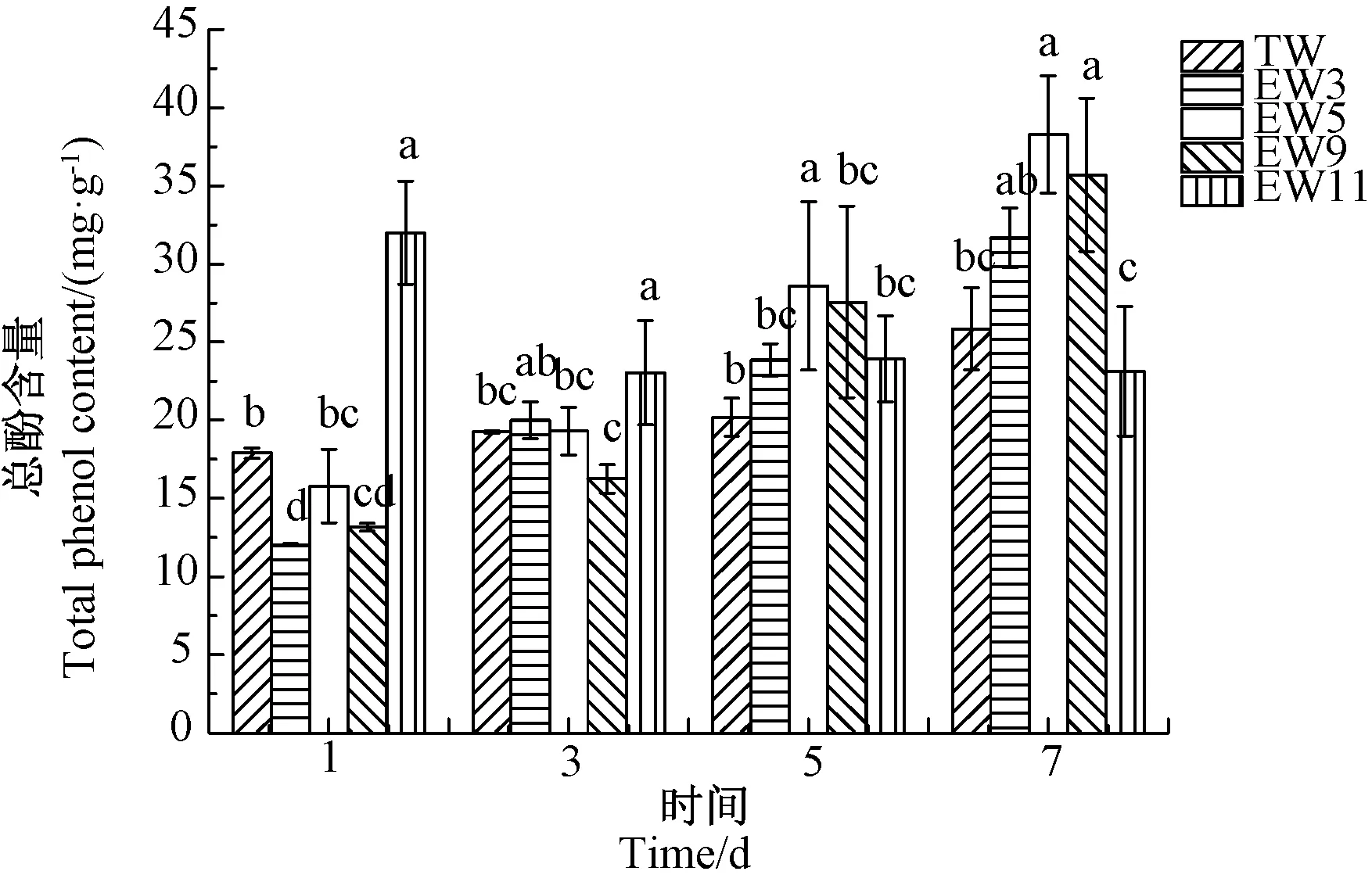
注:不同小写字母表示同一时间不同处理间差异显著(P<0.05)。下同。Note: Different lowercase letters in the same day indicate significant differences among treatments at 0.05 level. The same as following.图4 电解水对荞麦芽总酚含量的影响Fig.4 Effect of electrolyzed water on the content of total phenols of buckwheat sprouts
2.4 电解水对荞麦发芽期间DPPH自由基清除能力的影响
由图5可知,pH值11.13的碱性电解水处理组荞麦芽在发芽第1天,其DPPH自由基清除能力达到较高水平,为105.9 μmol Trolox·g-1,但后期有所降低,并维持稳定。其余处理组荞麦芽在发芽期间的DPPH自由基清除能力均随发芽时间延长而增强。自发芽第3天始,酸性电解水处理组荞麦芽的DPPH自由基清除能力均显著高于对照组(P<0.05)。到发芽第7天,除了pH值11.13处理组之外,其余电解水处理组荞麦芽的DPPH自由基清除能力均显著高于对照组(P<0.05)。
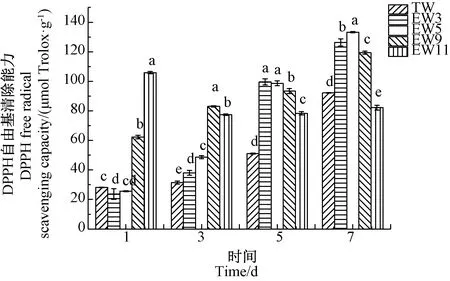
图5 电解水对荞麦芽DPPH自由基清除能力的影响Fig.5 Effect of electrolyzed water on the DPPH free radical scavenging capacity of buckwheat sprouts
2.5 电解水对荞麦发芽期间ABTS自由基清除能力的影响
由图6可知,pH值11.13碱性电解水处理组荞麦芽在发芽第1天ABTS自由基清除能力达到较高水平,为27.49 mmol Trolox·100g-1,但后期略有降低。其余各处理组荞麦芽发芽期间ABTS自由基清除能力均随发芽时间的延长而增强。到发芽第7天,pH值9.02、5.02、3.21电解水处理组荞麦芽ABTS自由基清除能力分别为35.03、31.72和28.35 mmol Trolox·100g-1,均显著高于对照组(P<0.05)。
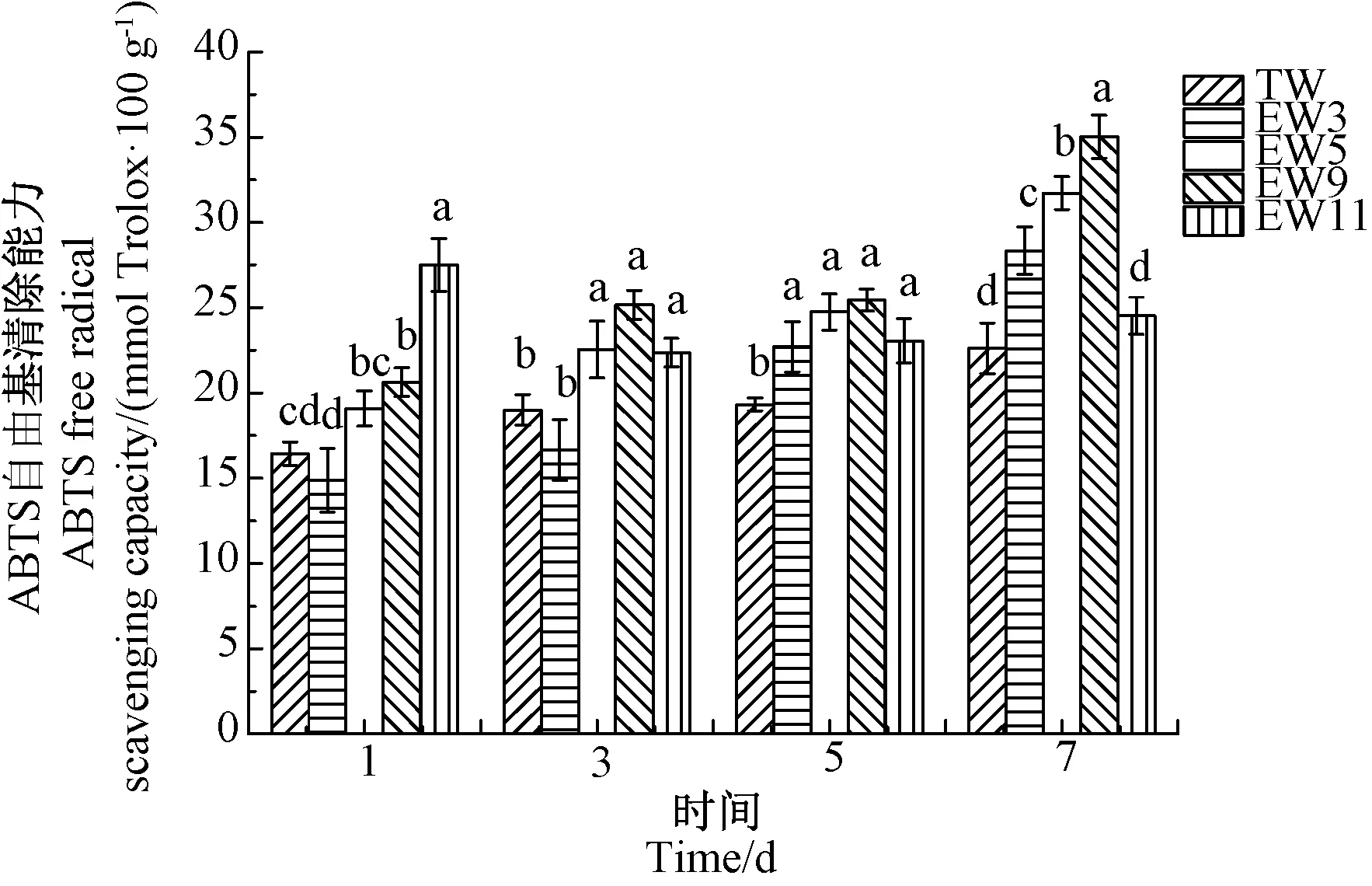
图6 电解水对荞麦芽ABTS自由基清除能力的影响Fig.6 Effect of electrolyzed water on the ABTS free radical scavenging capacity of buckwheat sprouts
2.6 电解水对荞麦发芽期间铁离子还原能力的影响
由图7可知,pH值11.13碱性电解水处理组荞麦芽铁离子还原力在发芽第1~第5天均显著高于其余处理组(P<0.05)。除pH值11.13碱性电解水以外的处理组荞麦芽随发芽时间的延长,其铁离子还原力呈上升趋势。到发芽第7天,pH值9.02、5.02和3.21电解水处理组荞麦芽铁离子还原能力分别为27.56、27.34和28.45 mmol Trolox·100g-1,均显著高于对照组(P<0.05)。
2.7 电解水对荞麦芽结合酚和游离酚含量的影响
由表2可知,荞麦芽中含量较多的游离酚为绿原酸和表儿茶素。自来水处理组荞麦芽中对香豆酸含量显著高于电解水处理组(P<0.05),然而对于检测到的其他主要游离酚,包括绿原酸、表儿茶素、咖啡酸、没食子酸、原儿茶酸、2,5-二羟基苯甲酸和4-羟基苯甲酸,其含量均为自来水处理组显著低于电解水处理组(P<0.05)。 绿原酸是荞麦芽中含量最高的游离酚,各处理组荞麦芽绿原酸含量由高到低排序依次为:pH值9.02碱性电解水处理组>pH值3.21酸性电解水处理组>pH值5.02酸性电解水处理组>pH值11.13碱性电解水处理组>自来水处理组。

图7 电解水对荞麦芽铁离子还原能力的影响Fig.7 Effect of electrolyzed water on the ferric ion reducing antioxidant power of buckwheat sprouts
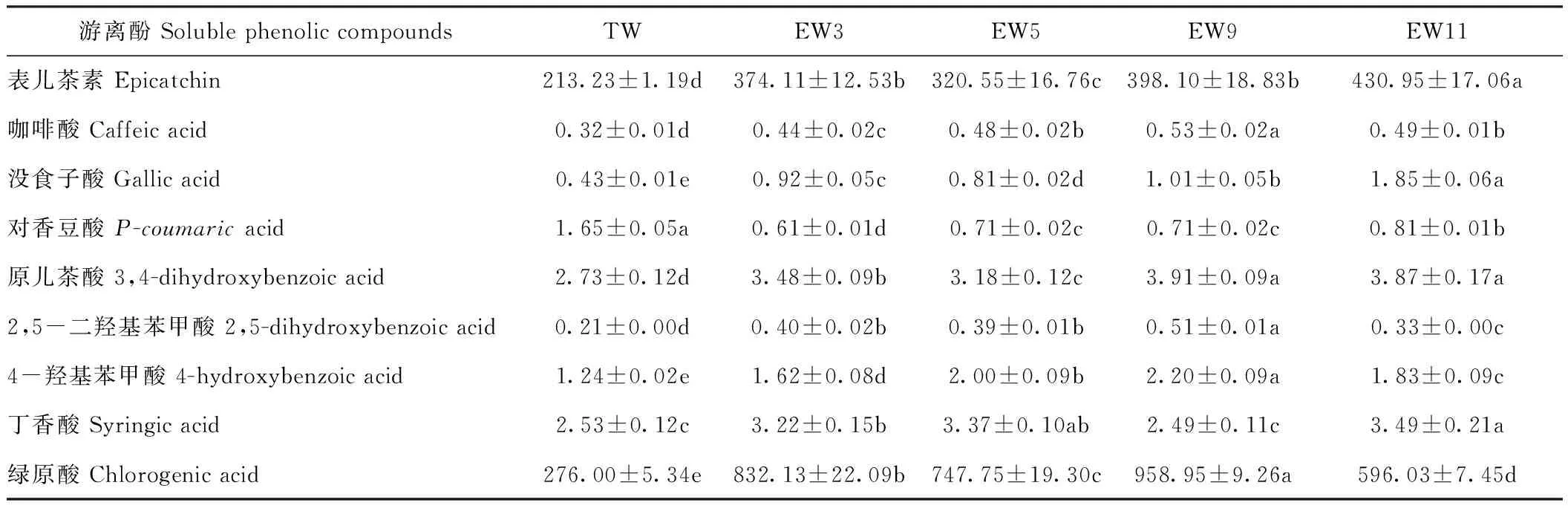
表2 电解水对荞麦芽中游离酚含量的影响Table 2 Effect of electrolyzed water on the soluble phenolic compounds of buckwheat sprouts /(mg·kg-1)
由表3可知,自来水处理组与电解水处理组荞麦芽含量最多的结合酚种类不同,即对香豆酸是自来水处理组荞麦芽含量最多的结合酚且显著高于电解水处理组(P<0.05)。而咖啡酸是电解水处理组荞麦芽中含量最多的结合酚且显著高于自来水处理组(P<0.05),不同电解水处理组荞麦芽咖啡酸含量由高到低排序依次为:pH值9.02碱性电解水处理组>pH值3.21酸性电解水处理组>pH值5.02酸性电解水处理组>pH值11.13碱性电解水处理组。对于检测到的荞麦芽中的主要结合酚,包括阿魏酸、咖啡酸、没食子酸、香草酸、原儿茶酸、4-羟基苯甲酸和丁香酸,其含量均为pH值3.02和pH值 9.02电解水处理组显著高于对照组(P<0.05)。
3 讨论
本研究采用DPPH自由基清除能力、ABTS自由基清除能力和铁离子还原能力来评价不同处理组荞麦发芽期间的抗氧化水平变化情况,这三种体外抗氧化活性评价方法大体呈现出一致的结果。这主要是由于抗氧化活性评价方法的化学本质相同,即基于物质的氧化还原特性[29],另一方面,综合图4~7可知,荞麦发芽期间的抗氧化水平与其总酚含量具有一致的变化规律。这是由于发芽期间抗氧化活性主要源于芽苗
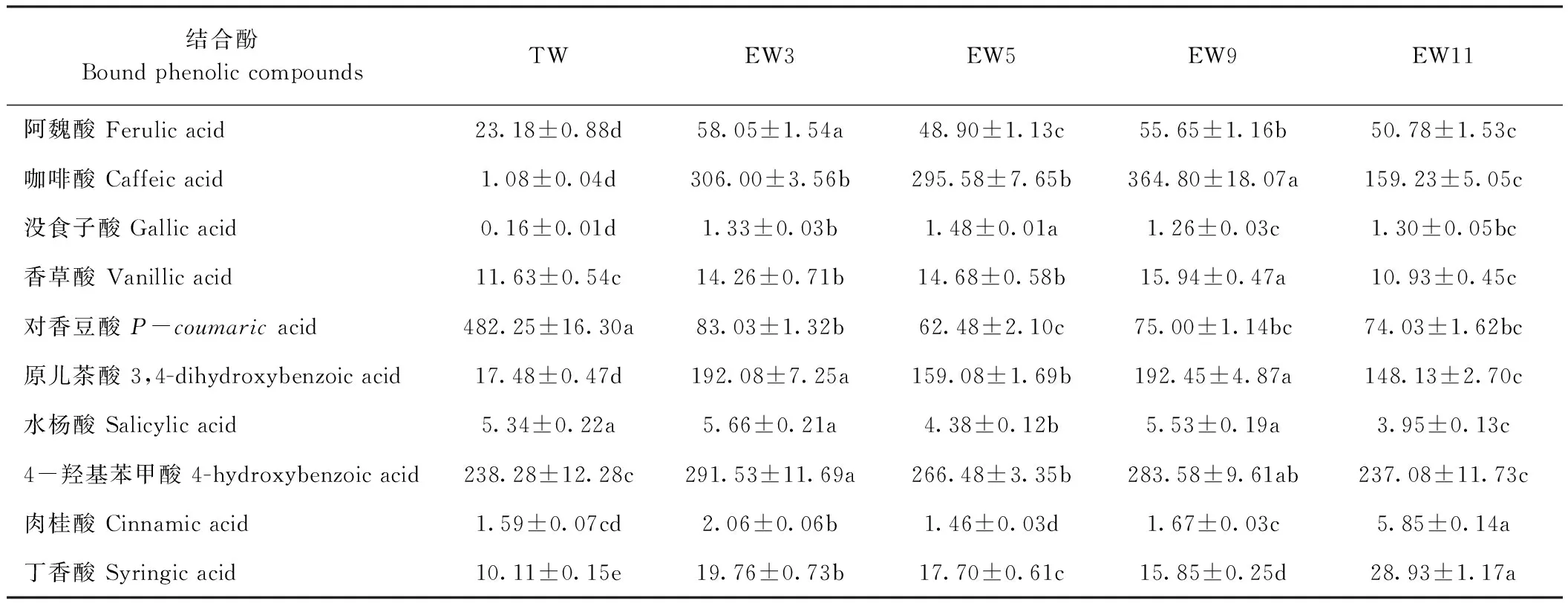
表3 电解水对荞麦芽中结合酚含量的影响Table 3 Effect of electrolyzed water on the bound phenolic compounds of buckwheat sprouts /(mg·kg-1)
中产生的还原性物质,例如酚类等[30]。且前人研究表明,电解水处理组发芽第7天的苦荞芽、甜荞芽总酚含量与苦荞芽DPPH自由基清除能力和铁离子还原力等均比对照组显著提升,且总酚含量与抗氧化活性呈正相关(P<0.01)[1,31]。
谷物作为膳食多酚的重要来源之一,其多酚含量与果蔬相当。酚酸能够提高植物的抗逆性,可在非生物胁迫条件下大量积累[32]。本研究中不同pH值的电解水处理组第7天荞麦芽中含量最多的游离酚酸和结合酚酸分别为绿原酸和咖啡酸,其含量均显著高于自来水对照组(P<0.05)。酚酸类物质具有抗氧化、抗癌等多种生物活性。例如,咖啡酸具有较强的DPPH自由基、ABTS自由基清除能力和铁离子还原能力,并极显著高于食品抗氧化剂二丁基羟基甲苯(butylated hydroxy, BHT)[33]。绿原酸和咖啡酸可以调节脂类代谢,具有抗肥胖作用[33]。绿原酸可以促进肿瘤细胞凋亡,降低抗癌药物不良反应等作用[34]。因此,基于电解水技术富集荞麦芽酚酸,可为相关功能食品研发提供理论依据。
4 结论
电解水对荞麦种子发芽及生长均有一定的促进作用。综合本研究所采用的3种抗氧化能力评价方法,在1~7 d的发芽观测期内,pH值11.13电解水处理组发芽1~3 d荞麦芽总酚含量和抗氧化能力均显著高于对照组(P<0.05),其余处理组荞麦芽总酚含量及抗氧化能力均随发芽时间延长而提升,且发芽5~7 d,pH值3.21、pH值5.02和pH值9.02电解水处理组荞麦芽总酚含量和抗氧化能力均显著高于对照组(P<0.05)。通过进一步探究发芽第7天各处理组荞麦芽中的结合酚酸和游离酚酸的种类和含量,发现绿原酸是各处理组荞麦芽中含量最多的游离酚酸,自来水、电解水处理组荞麦芽中含量最多的结合酚酸分别为对香豆酸和咖啡酸。总体而言,电解水处理有利于荞麦芽中主要酚酸的富集。

