葡萄酒发酵前后稳定同位素特征变化及初步相关性分析
申 雪 聂 晶 李春霖 邵圣枝 黄 翠 张永志 武 运,* 袁玉伟,*
(1 新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2 浙江省农业科学院农产品质量安全与营养研究所,浙江 杭州 310021;3 农业农村部农产品信息溯源重点实验室,浙江 杭州 310021)
近年来,随着我国农业结构的发展和工业化进程的加快,葡萄酒的产量有了大幅度增长,消费者对葡萄酒的品质越发重视。葡萄酒是葡萄全果经酒精发酵后的产物[1-2],不同地域酿酒葡萄品质及葡萄酒酿造工艺差异使葡萄酒具有明显的地域特色。近年来葡萄酒掺假、地理产地误标等情况时常发生,对葡萄酒品牌形象和消费者权益造成了严重损害[3]。因此,需要开发一种能够快速、稳健地对原产地进行验证的方法,以确保能准确识别原产地[4-5]。
稳定同位素比值能反映农产品所处的环境条件并提供可靠、准确的产地来源信息[6]。葡萄酒中稳定同位素组成受原料种植地的光照气候、地理位置与种植方式的影响,因此不同种植环境中的葡萄酒所含稳定同位素比值表现出一定的地域特征[7-8],可利用这种地域特征对葡萄酒进行产地判别验证。近年来,利用该技术探讨发酵对稳定同位素的影响取得了良好的成效。Zyakun等[9]系统调查了不同产区中葡萄酒发酵前后δ13C值的变化,发现葡萄酒中δ13C差异是由于酿酒葡萄生长条件和品种所致。Fauhl等[10]对不同发酵条件下的葡萄酒进行了研究,发现酵母菌株、发酵温度或葡萄酒澄清度等参数对乙醇中甲基位(D/H)Ⅰ均未有显著影响。Perini等[11]通过研究5个不同发酵阶段的126个样品中的稳定同位素组成,发现发酵阶段各指标参数与δ18O无关。综上,国内外对葡萄酒发酵过程中稳定同位素比值的研究大多集中于单一稳定同位素比值,而对整个发酵过程中各样品稳定同位素比值的研究较少,无法体现发酵过程中各稳定同位素比值的变化。
本试验采用元素分析仪-稳定同位素比率质谱(elemental analyzer-stable isotope ratio mass spectrometry,EA-IRMS)测定了发酵前(全果、果汁和皮籽)与发酵后(酒和皮渣)各固体样品中同位素比值的特征差异及相关性,以期为葡萄酒产品的真实性研究提供理论参考与数据支撑。
1 材料与方法
1.1 材料与试剂
试验样品于2020年9月采自新疆焉耆盆地的芳香庄园与乡都酒庄的葡萄种植基地(两地相距70 km),采用对角线采样的方式进行收集,每个采样点采集4~5 kg,共计15个采样点,品种均为赤霞珠。
葡萄酒果酒专用酵母购自安琪酵母股份有限公司;偏重亚硫酸钾购自北京奥博星生物技术有限责任公司;果胶酶(酶活力8 600 PGNU/g),购自法国拉氟德公司;稳定同位素标准物质IAEA-CH-6(蔗糖,δ13CV-PDB= -10.449‰)和IAEA-N-2(硫酸铵,δ15Nair=20.3‰),购自奥地利国际原子能机构;B2155(δ13CV-PDB=-26.98‰,δ15Nair=5.94‰)购自英国EMA公司;USGS64(δ13CV-PDB=-40.81‰)、USGS40(δ15Nair=9.52‰)、USGS55(δ2H=-28.2‰,δ18OV-SMOW=19.12‰)和USGS56(δ2HV-SMOW=-44‰,δ18OV-SMOW=27.23‰)购自美国地质勘探局。
1.2 主要仪器与设备
Vario PYRO cube 型元素分析仪、Isoprime100型稳定同位素比率质谱仪,德国Elementar公司;SCIENTZ-18N冷冻干燥机,宁波新芝生物科技股份有限公司;XP6型天平,瑞士Mettler-Toledo公司;LC110-12匀浆机,佛山市翁开尔贸易有限公司。
1.3 试验方法
1.3.1 样品制备与预处理 样品经采集后,用去离子水清洗干净后进行低温干燥,去除表面水分。利用匀浆机将样品进行匀浆后,平均分装成3份,分别用于发酵前(全果、果汁和皮籽)与发酵后(酒和皮渣)样品的制备。
全果:取1份匀浆样品作为全果样品;
果汁:取1份匀浆样品,利用0.5 mm筛网进行过滤,获得的滤液作为果汁样品;
皮籽:制备果汁样品时经筛网过滤后得到的滤渣为皮籽样品;
酒:取1份匀浆样品,先加入0.03%果胶酶和0.025%偏重亚硫酸钾,搅拌均匀后再加入活化好的0.02%安琪酿酒活性干酵母。按照《GB/T 15037-2006 葡萄酒》[12]和《GB/T 15038-2006 葡萄酒、果酒通用分析方法》[13]标准进行发酵和检测,将发酵液用多层纱布进行过滤后得到发酵完成后的葡萄酒样品;
皮渣:待葡萄酒发酵过程结束后,经过滤后得到的残渣作为皮渣样品。
将制备的样品先放置于-20℃冰箱中冷冻保存,在-80℃、20 Pa条件下冷冻干燥至恒重。干燥结束后使用液氮将全果、皮籽和皮渣样品研磨至粉末,装入棕色小瓶中,置于18℃以下的干燥器中保存,待测。本研究中的果汁和酒样品均为冷冻干燥并研磨后的固体样品。
1.3.2 稳定同位素比值测定 碳和氮稳定同位素:称取6~7 mg待测样品,放入锡箔杯(5 mm×9 mm)中包好,然后放入元素分析仪的固体样品自动进样盘中。样品中碳、氮元素通过高温燃烧后经氧化铜还原成CO2和N2,再进入稳定同位素比率质谱仪中进行检测。检测条件:元素分析仪中燃烧炉和氧化炉的温度分别为1 150℃和850℃,载气He(99.999%),流量为250 mL·min-1。在分析过程中碳稳定同位素使用IAEA-CH-6、B2155和USGS64,氮稳定同位素使用IAEA-N-2、B2155和USGS40为标准物质,分别采用三点校正的方法对测试结果进行校正。
氢和氧稳定同位素:称取约0.5 mg待测样品,放入银舟(8 mm×5 mm)中包样,包好的样品按编号放入元素分析仪自动固体进样盘中,样品中的氢、氧元素在经高温裂解后分别转化为H2和CO,进入稳定同位素比率质谱仪进行检测。检测条件:元素分析仪裂解炉温度为1 450℃,He流量为150 mL·min-1。在分析过程中以USGS55和USGS56作为标准物质,对测试结果进行两点校正。
参照下列公式计算稳定性同位素比值:
式中,R样品为所测样品中重同位素与轻同位素的丰度比,即13C/12C、15N/14N、18O/16O、2H/1H;R标准为国际标准样品中重同位素与轻同位素的丰度比,其中,δ13C以维也纳美洲拟箭石(V-PDB)为基准,δ15N以大气中氮气为基准,δ2H和δ18O以维也纳标准平均海洋水(V-SMOW)为基准。
1.4 数据处理
采用SPSS 18.0(美国IBM公司)软件对数据进行单因素方差分析(one way-ANOVA)和皮尔逊相关分析,其中单因素方差分析采用邓肯(Duncan)多重比较法。
2 结果与分析
2.1 发酵前葡萄中稳定同位素分布特征
发酵前,对葡萄各部分(全果、果汁和皮籽)固体品中δ13C、δ15N、δ2H和δ18O进行比较分析,结果如图1所示。δ13C的分布范围为-25.0‰~-24.4‰,全果(-24.7‰) 与皮籽(-24.6‰)及果汁(-24.8‰)间δ13C值的差异不显著。δ15N分布范围为2.4‰~5.4‰,各部分样品间均具有显著性差异,全果(4.6‰)显著高于皮籽(2.8‰)和果汁(3.8‰),而果汁显著高于皮籽。δ2H分布范围为-26.9‰~-14.3‰,全果(-19.3‰) 与果汁(-20.0‰)之间δ2H值差异不显著,但显著高于皮籽(-22.9‰)。δ18O分布范围在32.1‰~41.6‰,全果(34.4‰)与皮籽(34.3‰)之间δ18O值差异不显著,但果汁(40.1‰)的δ18O值显著高于全果与皮籽。经比较分析,除了δ13C外,发酵前各固体样品(全果、果汁和皮籽)中δ15N、δ18O和δ2H均存在差异性。此外,全果中δ2H极差较大,跨度为10.3‰,而δ18O 极差较小,跨度为0.5‰。
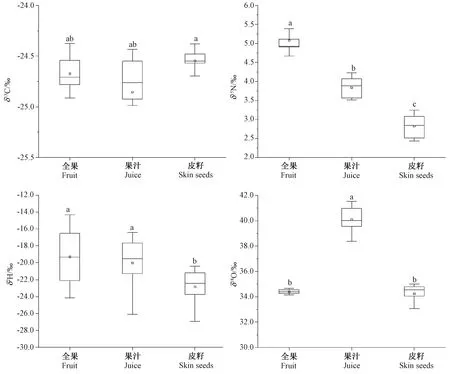
注:不同小写字母表示经单因素方差分析,样本间存在显著差异(P<0.05)。下同。Note: Different lowercases represent that significance exists between inter-samples after one-way ANOVA(P<0.05). The same as following.图1 发酵前葡萄中稳定同位素比率Fig.1 Stable isotope ratio in grapes before fermentation
2.2 发酵后葡萄酒中稳定同位素分布特征
将酿酒葡萄发酵后,通过筛网过滤得到上清液(葡萄酒)与皮渣部分,收集两部分样品进行稳定同位素分析,各同位素比值分布情况略有不同(表1)。葡萄酒与皮渣中δ13C均值分别为-25.1‰和-25.2‰,无显著差异;而δ15N、δ2H和δ18O值在酒和皮渣中差异较大,葡萄酒中δ15N值显著低于皮渣,而δ2H与δ18O值均显著高于皮渣,其中,δ2H差异较大,可能是由于添加的发酵剂导致同位素比值分馏[14]。综上,发酵后的葡萄酒与固体皮渣样品中除δ13C以外,其余稳定同位素比值均呈显著性差异。

表1 发酵后葡萄酒中稳定同位素平均值与标准偏差Table 1 Average and standard deviation of stable isotopes in wine after fermentation /‰
2.3 发酵前后不同样品中稳定同位素的变化及相关性分析
全果和皮籽经发酵后变为酒与皮渣,采用单因素方差法对发酵前后全果和酒,皮籽和皮渣中稳定同位素比值的差异与变化进行分析。由图2可知,发酵前后稳定同位素特征分布均有不同。碳是生物体的骨架元素,也是参与生命代谢的重要元素[15]。酒和全果中δ13C值分别为-25.1‰和-24.7‰,皮渣和皮籽中δ13C值分别为-25.2‰和-24.6‰,酒与全果中δ13C 值虽无显著差异,但皮渣中δ13C值显著低于皮籽。氮是发酵过程中重要的元素,酒和全果中δ15N值分别为3.6‰和4.9‰,皮渣和皮籽中δ15N值分别为5.0‰和2.8‰,经对比发现δ15N值在发酵前后不同样品中都具有显著性差异。氢是质量最小的元素,其同位素比值易受到外界影响而发生分馏。酒和全果中δ2H值分别为-28.7‰和-19.3‰,而皮渣和皮籽中的δ2H值分别为-57.5‰和-22.9‰,由此可见,氢同位素在发酵过程中发生较大变化,以皮渣中的同位素变化跨度最大。氧是构成生物界与非生物界最重要的元素[16]。酒和全果中δ18O值分别为36.7‰和34.4‰,皮渣和皮籽中δ18O值分别为30.0‰和34.3‰,酒中δ18O值显著高于发酵前全果,而皮渣中δ18O显著低于发酵前的皮籽,由此可见δ18O值在发酵前后的变化趋势不同。
通过对全果和酒、皮籽和皮渣中δ13C、δ15N、δ2H和δ18O稳定同位素特征进行皮尔逊相关性分析(表2),结果表明,全果和酒中对应相同元素的同位素比值相关性较弱且不显著,葡萄酒δ15N与全果δ18O值呈极显著相关,相关系数为0.66(P<0.01)。皮籽和皮渣中对应相同元素的同位素比值相关性较弱且不显著,皮渣δ15N与皮籽δ18O值呈显著相关,相关系数为0.61(P<0.05)。由此可见在该试验条件下发酵对葡萄酒中稳定同位素有显著影响。
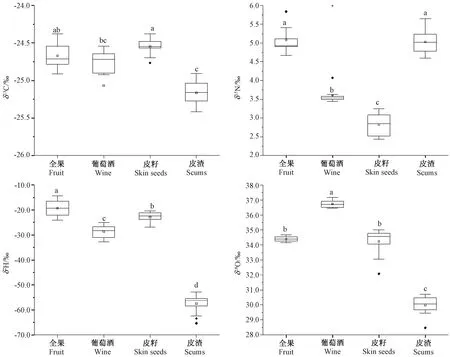
图2 葡萄酒发酵后稳定同位素特征Fig.2 Stable isotope characteristics of wine after fermentation
3 讨论
本研究立足于我国新疆焉耆盆地的酿酒葡萄,分析了发酵前酿酒葡萄(全果、果汁和皮籽)与发酵后各样品(葡萄酒和皮渣)中稳定同位素比值分布情况,初步探讨了发酵前后稳定同位素比值变化,得到葡萄酒发酵前后各样品稳定同位素比值变化的相关性。葡萄

表2 发酵后葡萄与葡萄酒中稳定同位素相关性Table 2 Correlation of stable isotopes in grape and wine after fermentation
是典型的C3植物[17],本研究中酿酒葡萄的δ13C主要分布在-24.75‰附近,符合C3植物的稳定同位素比值分布范围[18]。C3植物中δ13C易受到位置、海拔的影响[19-20]。新疆是我国高纬度地区,新疆的大枣[21]、梨[22]、甜瓜[23]等农产品的δ13C均值分别在-27.0‰、-26.0‰及-25.0‰附近。农业生产系统中的施肥(有机肥与化肥)[24-25]会影响农产品中δ15N值,使其比值发生变化。本研究发现酿酒葡萄不同部位(全果、果汁和皮籽)中δ15N值存在显著差异,这也印证了δ15N在植物体中分馏具有差异性。δ2H和δ18O是具有地理指示性的稳定同位素,容易受到位置、海拔、海岸线等因素的影响[26-27]。本研究发现,新疆焉耆盆地产区酿酒葡萄中的δ2H和δ18O分别在-26.9‰~14.3‰和32.1‰~41.6‰范围内。将酿酒葡萄发酵为葡萄酒的过程中,葡萄酒中的δ2H受到了人为及外部环境的影响。研究葡萄酒中的同位素可验证产品的真实性,报道中多以葡萄酒中的乙醇为研究对象。本研究对发酵前后的全果、酒、皮籽、皮渣中各元素的稳定同位素比值进行对比分析,发现各元素的稳定同位素比值特征均有不同,发酵前后相同元素的同位素相关性不显著主要归因于发酵过程。基于本研究结果,为建立更加稳定的葡萄酒原产地数据库,建议应结合不同的酿酒葡萄品种和产地以及不同的发酵工艺展开研究。
4 结论
本研究采用固体样品分析法对发酵前酿酒葡萄各部位(全果、果汁和皮籽)与发酵后各样品(酒和皮渣)中稳定同位素比值进行测定,发现不同样品中除δ13C外,其余稳定同位素比值在发酵前后均具有显著差异性。进一步对发酵前全果和发酵后葡萄酒与发酵前皮籽和发酵后皮渣进行相关性对比,发现各相同元素的稳定同位素比值相关性较小(P<0.05)。结果证明通过固体样品分析法能对发酵前后各样品中稳定同位素比值进行初步探索,为葡萄酒产品真实性鉴别提供了新思路。

