莲藕采后主要致腐真菌分离鉴定及生物学特性研究
贾 乐 刘瑞玲 房祥军 陈杭君,* 郜海燕,*
(1 浙江师范大学化学与生命科学学院,浙江 金华 321000;2 浙江省农业科学院食品科学研究所/农业农村部果品产后处理重点实验室/浙江省果蔬保鲜与加工技术研究重点实验室,中国轻工业果蔬保鲜与加工重点实验室,浙江 杭州 310021)
莲藕(NelumbonuciferaGaertn.)属睡莲科莲属植物,在我国种植历史悠久,营养价值丰富,是国内外广受欢迎的水生根茎类蔬菜[1]。莲藕富含钾、铁、铜、维生素和膳食纤维等营养元素对维持心脏及健康、降低血压、提高免疫力等有一定的功效[2-3],具有抗肥胖、保肝、抗菌、利尿和清热生津等药用功能[4-6],深受消费者喜爱,市场份额逐年增加[7]。莲藕已成为人们日常生活饮食中重要的组成部分[8]。但由于莲藕组织娇嫩,含水量高,极易受微生物侵染,常温下贮藏5~7 d便会出现褐变、干缩、霉烂等问题[9],在很大程度上影响莲藕的可食用品质,缩短莲藕货架期,造成资源浪费和经济损失。
果蔬采后腐烂的原因主要有生理衰老、机械损伤和侵染性病害,其中大部分采后腐烂损失由病原菌侵染引起[10],在病原微生物中,真菌对果蔬贮藏期间的危害最为严重且种类数量最多[11]。目前对莲藕采后贮藏方面的报道主要集中在保鲜技术方面,在微生物病害方面的研究较少,且大部分研究是从田间直接采集病株进行致病微生物的分离鉴定。目前国内已报道的尖孢镰刀菌引起的莲藕腐败病[12]、胶孢炭疽菌引起的莲藕炭疽病[13]、睡莲假尾孢菌引起的黑斑病[14]等均为真菌引起的莲藕采前病害。也有报道对低温贮藏条件下的腐败莲藕进行病原菌分离,罗海莉[15]对采后4~10℃贮藏的莲藕腐烂病原菌进行分离发现,其主要病原菌为芽枝孢霉、交链孢霉和镰刀菌;李慧[16]进一步研究确定低温下引起莲藕采后腐烂的主要致腐病原菌为茄病镰刀菌和尖孢镰刀菌。但针对莲藕采后常温贮藏过程中的致腐微生物相关研究较少。莲藕采收于高温季节,在常温下极易被微生物侵染而发生腐败,因此新鲜莲藕采后在常温条件下最多能贮藏7 d。本研究对25℃常温贮藏条件下发生腐败的莲藕进行病原菌分离鉴定,并研究其主要致腐真菌的生物学特性,以期为后续采取针对性的防腐保鲜措施提供基础数据。
1 材料与方法
1.1 试验材料与试剂
以鄂莲五号莲藕为试验材料,样品采自浙江省杭州市余杭区湾里塘莲藕合作社。于采摘当天运回实验室,挑选50根大小均一、色泽亮白、无机械损伤和病虫害的莲藕,随机分成10组,用紫外照射过的聚乙烯PE袋进行包装,每袋约5 kg,模拟常温下自然贮藏条件,将包装好的莲藕挽口放置于湿度40%~50%,温度25℃的条件下贮藏,每天定期观察其发病情况。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)、平板计数培养(plate count agar, PCA)、孟加拉红培养基,上海盛思生物科技有限公司;真菌DNA提取试剂盒,上海生物工程股份有限公司;葡萄糖、D-果糖、麦芽糖,上海阿拉丁生化科技股份有限公司;牛肉膏、蛋白胨、硝酸铵、尿素,上海生物工程科技有限公司;硫酸铵,上海凌峰化学试剂有限公司;酵母浸出粉,上海盛思生化科技有限公司;甘露醇,上海源叶生物科技有限公司;乳糖,上海伯奥生物科技有限公司;麦芽糖,国药集团化学试剂有限公司。
1.2 主要仪器与设备
MLS-3781L-PC高压蒸汽灭菌器,松下健康医疗器械株式会社;MJX-160B-Z霉菌培养箱,上海博讯医疗生物仪器股份有限公司;BSC-130011A2生物安全柜,苏州安泰空气技术科技有限公司;Peltier Thermal Cycler MG48 PCR仪,美国BioRad公司;Axio Vert A1蔡司倒置荧光显微镜,德国卡尔蔡司股份公司;WD9413C凝胶成像分析系统,北京六一生物科技有限公司;MIR-254恒温培养箱,日本三洋电器股份有限公司。
1.3 测定项目及方法
1.3.1 腐败菌的分离纯化及致病性测定 采用组织分离法对病原菌进行分离,参照杜小琴等[17]的方法并略作修改,将常温下自然发病的莲藕按照病症进行分组,切取4~5 mm病健交界处组织,在酒精中浸泡20 s,再用无菌水洗涤3次后置于PDA培养基中,每一病症设置5个平行,在28℃恒温培养箱中避光培养。以上操作均在无菌环境下进行。每天观察其菌丝生长情况,用无菌接种环挑取菌落边缘菌丝转接至新的PDA培养基上,重复操作3~5次,直至菌落形态稳定。获得的纯培养物于4℃冰箱保存。病原菌致病性的测定采用针刺法。选取健康无机械损伤的莲藕,清水冲去表面污泥,75%酒精表面消毒30 s,再用无菌水清洗3次,置于超净工作台上晾干备用。将菌株活化后用无菌打孔器打取直径约6 mm的菌饼,用无菌针刺破处理好的莲藕,将病原菌接种至伤口内,以接种同体积的无菌PDA培养基为对照。将接种好的莲藕置于经紫外照射处理过的聚乙烯PE袋进行包装,28℃恒温箱避光培养,定期观察莲藕发病情况。待发病后,按照1.3.1方法对病原菌再次进行分离,将2次分离得到的病原菌的菌丝及菌落形态进行对比,判断两者是否一致。
1.3.2 腐败菌形态学及分子生物学鉴定 用打孔器在活化菌落边缘打取直径约6 mm的菌饼,转接至新的PDA平板上,置于28℃恒温培养箱中避光培养,每天观察并记录其菌落大小、形状、颜色、菌丝密集度及扩展直径,并在光学显微镜下观察菌丝和孢子的形态。腐败菌基因组DNA的提取参照刘小玉等[18]的方法,将纯化好的腐败菌转接于PDA平板上进行活化,待长出菌落后,用无菌接种环刮取少量菌丝于PDB培养基中,28℃摇床振荡(120 r·min-1)培养48 h,用无菌滤纸过滤得到菌丝体,再用无菌水洗涤3~5次,滤纸吸干多余水分,收集菌丝0.1~0.3 g,使用液氮进行研磨,剩余操作按照DNA提取试剂盒说明书进行。对目的基因进行扩增,引物序列为:ITS1:5′-T C G T A G G T GA A C C T G C GG-3′,ITS4:5′-T C C T C C G C T T A T T G A T A T GC-3′。引物合成委托杭州有康生物技术有限公司完成。PCR反应体系共25 μL:2×Rapid Taq Master Mix 12.5 μL、引物ITS1和ITS4各1 μL、模板DNA 1 μL,ddH2O 9.5 μL。 按照说明书和设定PCR反应程序,其中延伸时间根据目的基因序列长度进行设定,退火温度根据引物的Tm值进行设定。PCR反应程序:95℃预变性3 min;95℃变性15 s,58℃复性15 s,72℃延伸15 s,35个循环;72℃延伸5 min,4℃保存。使用1%琼脂糖凝胶电泳对扩增产物进行检测,PCR产物测序由杭州擎科梓熙生物技术有限公司完成。将测序所得序列在NCBI网站进行Blast在线比对,选取同源性较高的已知序列。利用BioEdit、MEGA7.0软件,采用Neighbor-Joining法构建菌株与亲缘关系较近物种的系统发育树,并结合菌株形态,确定菌株种属。
1.3.3 腐败菌生物学特性分析
1.3.3.1 不同培养温度对菌丝生长的影响 设置5、10、15、20、25、30、35、40℃共8个培养温度,在培养2 d的菌落边缘打取直径6 mm的菌饼,转接至新的PDA平板中央,每个处理温度设置3个平行,28℃培养箱进行暗培养,48 h后采用十字交叉法测量病原菌得扩展直径,并观察记录菌丝密集程度。
1.3.3.2 不同碳、氮源对菌丝生长的影响 以察氏固体培养基为基础培养基,分别用等物质量的D-果糖、甘露醇、乳糖、麦芽糖、葡萄糖和可溶性淀粉替代察氏固体培养基中的碳源,用等物质量的牛肉膏、蛋白胨、酵母浸出粉、硫酸铵、硝酸铵和尿素替代基础培养基中的氮源,两者均以无碳氮源的培养基为空白对照,其余方法同1.3.3.1。
1.3.3.3 致死温度测定 参照赵璐藐等[19]的方法,设置40、45、50、55、60、65、70℃共7个处理温度,用打孔器从活化的菌落边缘打取直径为6 mm的菌饼,置于装有5 mL无菌水的试管中,在以上设定温度水浴加热10 min,取出后迅速冷却并接种于PDA平板上,其余方法同1.3.3.1。
1.3.3.4 不同光照条件及pH值对菌丝生长的影响 将病原菌接种到PDA培养基上,分别置于24 h持续光照、12 h光暗交替、24 h持续黑暗3个条件,设置4、5、6、7、8、9、10、11共8个pH值对病原菌的酸碱适应性进行测定,其余方法同1.3.3.1。
1.3.3.5 不同培养基对菌丝生长的影响 选取孟加拉红培养基、莲藕汁培养基、PDA、PCA以及清水琼脂培养基(water agar,WA)共5个处理,其余方法同1.3.3.1。除测定不同温度对菌丝生长的影响试验时,将病原菌置于不同温度的恒温培养箱中,其余试验均于28℃恒温箱中进行。
1.4 数据处理与分析
试验数据显著差异性分析用SPSS 19软件进行(P<0.05表示差异显著),采用GraphPad Prism8进行数据的处理和图片绘制。
2 结果与分析
2.1 腐败菌的分离纯化及致病性检测
莲藕在常温贮藏条件下易发生腐烂,其自然发病症状为:贮藏第3天,莲藕表面出现白色绒状物,随后莲藕表面褐变,组织软化、腐烂(图1-A)。采用组织分离法,从腐烂部位共分离出3株真菌,分别标记为LO-1、 LO-2、 LO-3, 根据科赫氏法则[20]对分离出的真菌进行回接验证,将病原菌分别接种至新鲜莲藕上,只有LO-1能导致莲藕腐烂,且腐烂部位分离得到的菌株与自然发病部位分离得到的菌株相一致(图1-B),从发病部位也可分离得到LO-1菌株,表明LO-1菌为莲藕采后致腐病原菌。挑取菌落边缘部位的菌丝对莲藕致腐菌进行分离纯化,病原菌培养2~3 d时,菌落呈白色绒毛状,近圆形,气生菌丝旺盛(图1-C),显微镜下观察菌丝无隔(图1-D)。培养7 d后,菌落开始变为淡绿色,随着培养时间的延长,菌落逐渐变为黑色,培养至第14天时,菌丝出现有隔形态(图1-E)。该菌产孢条件较为苛刻,在燕麦培养基上于28℃持续光照培养至第21天时,可观察到该菌分生孢子器的产生,分生孢子器近球形或不规则形,分生孢子呈椭圆形或卵形,初期无隔膜,具纵纹,无色或透明,成熟后在近中部出现隔膜,整个孢子呈褐色,胞壁加厚(图1-F)。

图1 莲藕贮藏期间果实发病症状、分离菌株菌落形态和孢子形态Fig.1 Diseases symptom on water bamboo shoot and morphology characteristics of colonies and spores of isolated strains
2.2 腐败菌系统发育树的分析
采用真菌通用引物,对分离得到的病原菌DNA进扩增,得到长度为 528 bp 的特异片段(图 2-A),对该 DNA 序列进行测序,将测序结果在 NCBI 上进行比对,选取同源性较高的序列,构建 LO-1 的系统发育树,结果如图 2-B所示。LO-1 的序列与可可毛色二孢菌Lasiodiplodiatheobromae(登录号:MK166047.1)的同源性较高,可达到 99.81%,两者亲缘关系最近的,在进化树上聚为一类。将测序所得序列与其聚在同一分支上的物种序列对比结果如图3所示,LO-1只有1个碱基与其亲缘关系较近的物种的碱基序列不同。

注:M:分子量标记。Note:M: Marker.图2 莲藕采后分离病原菌 rDNA-ITS区PCR扩增产物的电泳结果及基于ITS基因序列构建的系统发育树Fig.2 Electrophoresis results on PCR products of rDNA-ITS from isolated strains and phylogenetic treeconstruted based on ITS gene sequence

图3 ITS基因序列比对图Fig.3 ITS gene sequence alignment map
2.3 莲藕致腐真菌生物学特性分析
2.3.1 培养温度和pH值对菌丝生长的影响 由图 4-A可知,在培养基的pH值范围为4~10 时,菌株均能生长,其中pH值范围为 4~6 时,菌丝扩展直径较大;pH值为5时,菌丝扩展直径最大;pH值范围为 8~10时菌丝扩展直径较小,所以该菌在 pH值>10 时无法生长。最适生长 pH 值为 5(P<0.05)。培养温度对菌丝生长的影响如图4-B所示,该菌在10~35℃范围内均能生长,最适宜的培养温度为25℃,此温度下培养2 d菌落直径可达到80.01 mm,显著高于其他处理(P<0.05),在低于5℃或达到35℃以上菌丝不能生长,故该菌最适生长温度为25℃。
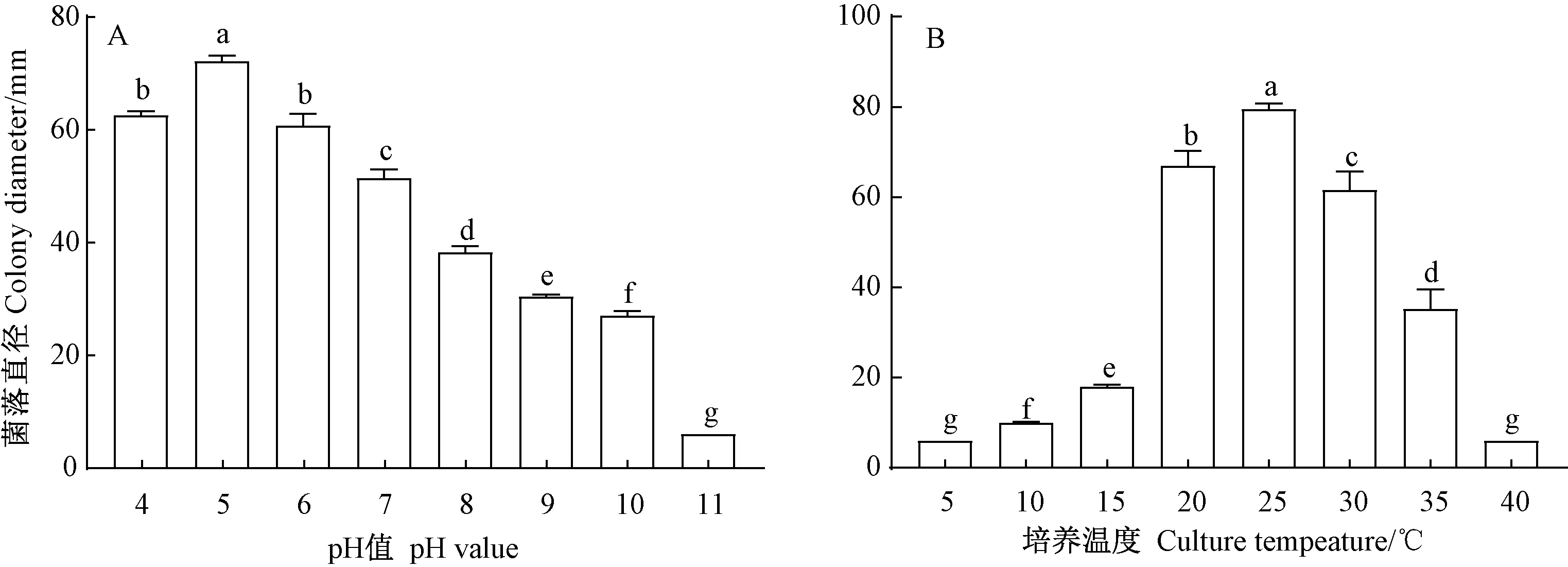
注:不同小写字母表示差异显著(P<0.05)。下同。Note: Different lowercase letters indicate signifcant differences at 0.05 level. The same as following.图4 不同pH值(A)、温度(B)对菌株 LO-1生长的影响Fig.4 Effect of different pH value(A) and temperatures(B)on the growth of strain LO-1
2.3.2 不同碳、氮源对菌丝生长的影响 由图5-A可知,该菌以蔗糖为碳源时生长较好,培养2 d菌落直径可达76.75 mm,且菌丝生长迅速,长势较好,相对其他碳源处理有显著性差异(P<0.05),其次为可溶性淀粉。由图5-B可知,该菌以酵母浸出粉、牛肉膏、蛋白胨、硝酸铵为氮源时生长较好,四者间无显著差异(P>0.05),这4个处理的菌落直径显著高于其他氮源处理组(P<0.05),其中以酵母浸出粉为氮源时,菌丝生长最为茂盛,菌丝直立,触及培养皿盖,表明酵母浸出粉最有利于该菌生长。

图5 不同碳源(A)、氮源(B)对菌株 LO-1 生长的影响Fig.5 Effect of different carbon sources(A) and nitrogen sources (B)on the growth of strain LO-1
2.3.3 致死温度测定 该菌经过40~70℃水浴处理10 min,结果发现(图6)菌株LO-1在40~50℃处理后在PDA上能继续生长,但随着温度的升高,菌丝的扩展直径越来越小,菌丝分布也越来越稀薄,而55℃及以上温度的各处理组,在培养7 d后仍未有菌丝长出,将该平板放于适宜该菌生长的条件下25℃培养7 d,仍未观察到菌丝体的生长,说明该菌致死温度为55℃(处理10 min)。
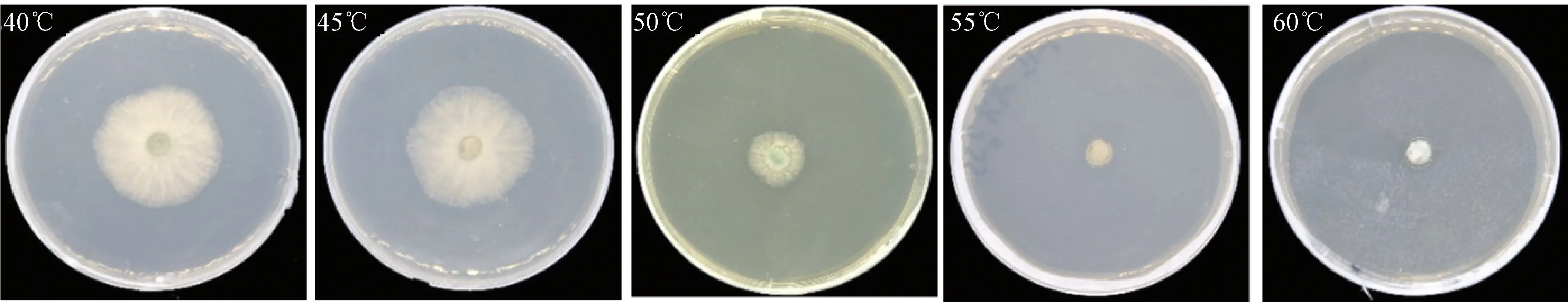
图6 不同致死温度对菌株LO-1生长的影响Fig.6 Effect of different lethal temperatures on the growth of strain LO-1
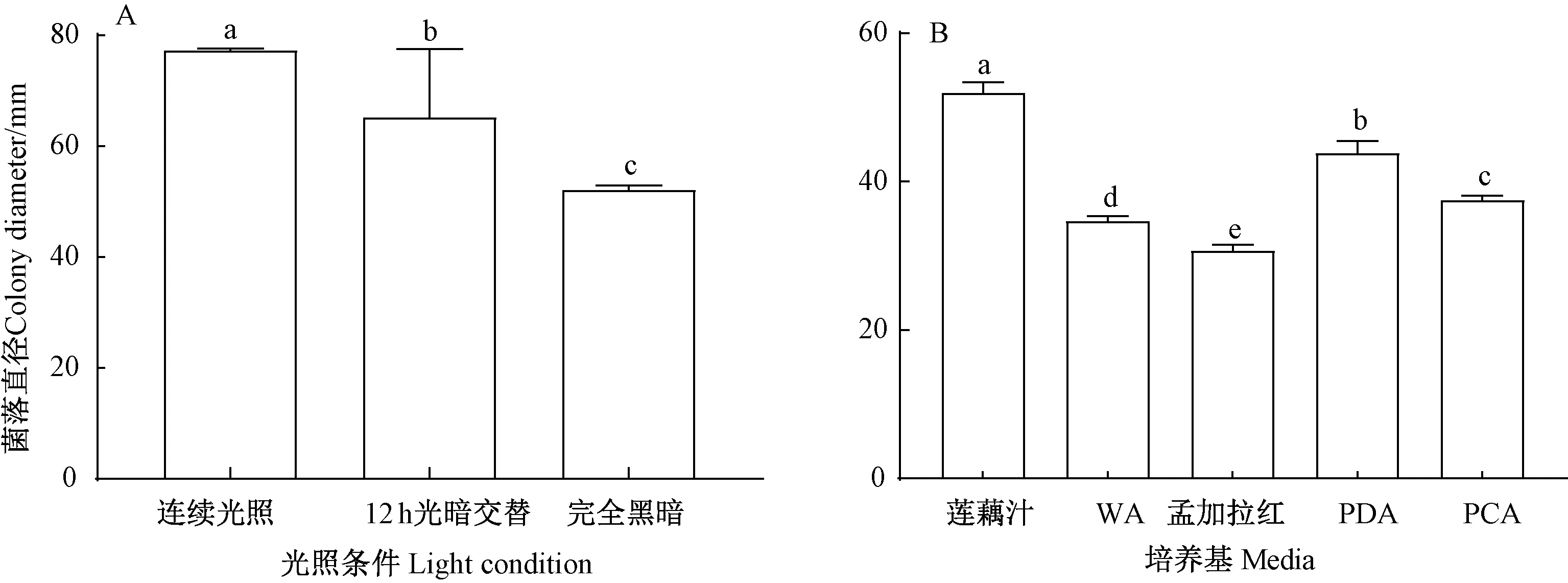
图7 光照条件(A)和培养基(B)对菌株LO-1生长的影响Fig.7 Effect of light conditions(A) and different media(B) on the growth of strain LO-1
2.3.4 不同培养基及光照条件对菌丝生长的影响 在不同光照条件下培养2 d后对菌落直径进行测定,由图7-A可知,光照条件对LO-1菌丝生长的影响有显著性差异,其中连续光照条件更有利于菌丝的延伸,黑暗条件下菌丝扩展直径最小。培养至20 d时,12 h光暗交替及完全黑暗条件下均不产孢,而在连续光照条件下,培养至14 d便可观察到孢子,说明持续光照有利于LO-1菌丝的生长,且能促进其产孢。不同培养基对LO-1生长的影响有显著性差异(P<0.05),在莲藕汁-葡萄糖培养基中生长最好,培养2 d后菌落直径达到51.95 mm,菌落生长平整、圆形,呈辐射状,菌丝生长旺盛;其次是PDA培养基,该病原菌在PDA培养基上培养48 h后菌落直径达43.84 mm。
3 讨论
可可毛色二孢菌广泛分布在热带和亚热带地区,目前已知寄主达500种之多[21],可引起果腐病、根腐病、枝枯病、褐腐病等,目前已报道的有龙眼焦腐病[22]、花生茎腐病[23]、蓝莓枝枯病[24]、肉桂枝枯病[25]、橡胶树回枯病[26]、高良姜叶枯病[27]等,同时也有研究发现可可毛色二孢菌是引起甘薯[28]和芋艿[29]等根茎类蔬菜腐败的主要病原菌,但目前国内尚鲜见可可毛色二孢菌侵染引起莲藕采后腐败病的相关报道。
本研究通过对LO-1的生物学特性初步探究发现,该菌在10~35℃条件下均可生长,其中25℃最适合病原菌LO-1的生长,该菌的最适生长温度与莲藕采摘季节的温度相近,这一研究结果与陈佳华[30]的报道相近,且在实际生产中具有一定的应用价值,一方面在莲藕采摘时应尽量选择气温较低的清晨或傍晚,可以有效钝化病原菌的活性;另一方面采摘后的莲藕应放置于低温条件下进行贮藏,以此延长其保鲜期。菌株LO-1在pH值4~10条件下均可生长,最适pH值为5,更适宜在偏酸性环境下生长。而莲藕多生长于偏酸性粘质土中,与该菌适宜生长的条件一致,这可能也是导致莲藕易感染该菌的原因。在采后保鲜中可以考虑喷淋偏碱性保鲜剂来抑制莲藕表面病原菌的生长,以此延长保鲜时间。LO-1病原菌可以利用蔗糖、葡萄糖等多种碳源,其中利用葡萄糖、乳糖、甘露糖的能力无显著差异,对蔗糖的利用率最高,这与廖旺娇等[31]在桉树枝枯病上分离出来的LO-1菌的试验结果一致;本研究结果发现该病原菌也可利用多种有机碳源和无机碳源,其中对酵母浸出粉的利用率最佳,这与董章勇等[32]报道的沙田柚果腐病可可毛色二孢无法利用尿素的结果不同,这可能是由于不同地区、不同物种所分离到的菌株的生物学特性、抗逆性、致病性以及菌落形态等方面均存在差异。在对LO-1菌丝体致死温度的研究中发现,该菌致死温度为55℃处理10 min,这与戴利铭等[33]的研究结果相似。以上研究结果说明LO-1具有较强的环境适应能力,可以利用多种碳源和氮源,且有较为广泛的酸碱适应能力,因此无法简单地通过改变外部环境条件来达到杀死病原菌的目的。今后的研究中应考虑选择环保型保鲜剂对莲藕进行保鲜。在研究不同培养基对该菌菌丝生长的影响时发现,在莲藕汁-葡萄糖培养基上菌丝扩展直径最大,说明莲藕为该菌菌丝的生长提供了较为适宜的条件,也是莲藕易感染该菌的原因之一。本研究还发现光照条件对LO-1菌丝的生长有显著影响,光照可促进菌丝的生长,且可以促进孢子的产生,说明莲藕采后避光保存可在一定程度上延缓其腐败进程。而胡文军等[26]研究发现光照条件对LO-1菌丝生长的影响不显著,这可能是由于病原菌因寄主不同而导致的差异,具体情况还有待进一步研究。可可毛色二孢菌的产孢条件较为苛刻,在PDA培养基、不同碳氮源培养基以及不同pH值培养基中暗培养30 d均未观察到孢子的产生,在燕麦培养基中连续光照培养,第14天方可观察到少量孢子的产生,其具体产孢条件还需进一步研究。
4 结论
本研究采用组织分离法对常温下自然腐烂的莲藕进行病原菌的分离纯化,得到LO-1、LO-2、LO-3 3种致腐真菌。根据科赫氏法则,确定莲藕采后的主要致腐菌为LO-1,对该病原菌进行形态学及分子生物学鉴定,确定该菌为可可毛色二孢菌。通过对其生物学特性的研究发现,该菌最适生长温度为25℃,在酸性条件下能较好地生长,在pH值为5时生长最好,菌丝致死温度为55℃(10 min),可利用多种碳氮源,其中最佳碳源为蔗糖,最佳氮源是酵母浸出粉。在多种培养基上都能生长,其中在莲藕汁-葡萄糖培养基上菌丝生长最茂盛。光照条件对该菌菌丝的生长有一定的影响,连续光照可促进其生长,该菌产孢条件较为苛刻,只有在燕麦培养基且持续光照的条件下才有少量孢子产生。

