NtCPS2对烟草光合特征及光合产物的影响
贺凌霄 韩文龙 李 波 江智敏 徐 敏 李芳芳 郑 聪 徐世晓,*
(1 河南农业大学烟草学院,河南 郑州 450002;2 浙江中烟工业有限责任公司,浙江 杭州 310008;3 中国烟草总公司河南省公司,河南 郑州 450002;4 福建省烟草公司南平市烟草公司浦城分公司,福建 南平 353400)
二萜类化合物顺-冷杉醇(cis-abienol)是部分烟草叶片腺毛分泌物中特有的萜类香气前体物之一,是由NtCPS2基因编码柯巴基焦磷酸合酶(8-hydroxy-copalyl diphosphate synthase, CPS2)后合成的[1]。顺-冷杉醇与二萜类化合物赤霉素(gibberellins,GAs)、倍半萜脱落酸(abscisic acid,ABA)具有共同的前体物质香叶基香叶基焦磷酸(geranylgeranyl-PP,GGPP)[2-5],合成途径见图1[1,6-7]。河南农业大学烟草学院育种课题组前期研究表明,8306编辑顺-冷杉醇合成基因NtCPS2后,NtCPS2基因的相对表达量和顺-冷杉醇的含量降低,同时赤霉素合成途径中相关基因受到影响,进而使赤霉素含量提高[8]。此外,有研究表明,在植物生长过程中ABA与GAs相互影响,含量发生变化从而调节植物的生长发育,如:种子的萌发与休眠[9]、植株地上部的生长[10-12]。杨卫民等[6]发现用不同浓度的外源ABA和赤霉素(gibberellin 3,GA3)分别处理木枣果实,对丙二醛(malondialdehyde, MDA)、维生素C(vitamin C,Vit C)、过氧化氢酶(Proline)含量和CAT活性均产生相反的作用,表现为相互制约或互为拮抗的特征。宋平等[13]研究表明,GAS与ABA间具有拮抗效应,且在不同籼稻半矮秆品种中的拮抗效应强弱不同。还有研究表明,在GAS处理条件下,ABA对水稻地上部生长的抑制作用被解除[11]。
ABA对气孔运动有调控作用[14-16],同时气孔是直接影响植物叶片光合作用的植物表皮结构[17-18]。在被子植物中,ABA与质膜受体或胞内受体结合,激活G蛋白,激活后的G蛋白活化磷脂酶,产生abi1-1、NAD(P)H依赖型ROS和abi2-1等因子参与Ca2+信号转导[19],通过依赖Ca2+的信号转导途径,Ca2+可抑制K+内流通道,激活K+外流通道和阴离子通道,从而促进K+外流[20-22],导致气孔关闭或抑制气孔开放[23]。此外,ABA还可通过不依赖Ca2+的信号转导途径,即通过提高细胞质pH值,激活K+外流通道和阴离子通道诱导气孔关闭[24-25]。气孔开闭变化会引起气孔导度(stomatal conductance,GS)的变化,进而影响植物的蒸腾速率(transpiration rate,Tr)和净光合速率(net photosynthetic rate,Pn)[26]。有研究表明,植物气孔导度下降导致胞间CO2浓度(intercellular carbon dioxide,Ci)下降,光合作用随之下降[27-28]。植物通过光合作用合成的有机物质是植株进行生长和发育的物质基础[29],累积的光合产物越多,越利于植株生长。同时,光合作用影响着植物体的生理代谢过程,对经济作物品质的形成有基础性作用[30-33]。因此,在一定范围内提高烟叶光合速率,可以增加烟草有机物的合成速率,有利于烟叶同化物的积累,从而提升烟叶的产量和品质[34-35]。
目前,有关NtCPS2对二萜类代谢合成途径的影响已有报道[1,4,8,36-38],但NtCPS2基因与光合作用关系的研究鲜见报道。本研究以烤烟品种(系)8306、8306B、MSK326、豫烟11号和新豫烟11号为材料,分别比较8306B与8306、新豫烟11号与豫烟11号在光合参数及相关合成基因相对表达量和酶活性,气孔开度,顺-冷杉醇、GA3、ABA含量及相关合成基因相对表达量上的差异以及产量和品质的差异,旨在明确NtCPS2基因对光合作用的调控方式,以期为萜类化合物对植物光合作用的反馈调节机制提供例证。
1 材料与方法
1.1 试验材料
试验于2020年在河南省漯河市临颍县进行,选择土壤肥力中上等且均匀、地势平坦、排灌方便、远离工业区、前茬一致的沙壤土作为试验地。供试烤烟(NicotianatabacumL.)品种(系)为自育高香气烤烟品系8306、8306B[39](8306编辑NtCPS2基因的纯合突变植株T3代)、MSK326、豫烟11号[40](MSK326×8306,YU11)、新豫烟11号(豫烟11号改良父本的新品系,MSK326×8306B,NYU11),由河南农业大学烟草学院育种实验室提供。
试验共5个处理,分别为8306、8306B、MSK326、YU11、NYU11。各处理种植面积为60.5 m2,田间行距为110 cm, 株距为55 cm,于2019年3月1日播种,同年5月1日移栽,其他栽培措施按照当地优质烟叶生产技术规范操作。移栽后75 d时,每个品种(系)随机挑选5株长势一致的烟株取样并测定指标;烤后样统一选取C3F等级[41]叶片,每个品种(系)重复3次。
1.2 试验方法
1.2.1 叶面分泌物顺-冷杉醇的测定 烟草叶片中的顺-冷杉醇提取参照陈伟等[42]的方法,通过NIST12检索谱库确定各类物质成分,并使用内标法对物质定量。
1.2.2 内源激素分析测定 采集移栽75 d后的0.50 g新鲜烟草样品,用液氮速冻后,存放于-80℃冰箱中保存,采用间接酶联免疫吸附法 (enzyme-linked immuno sorbent assay,ELISA)进行测定,酶免疫试剂盒由中国农业大学化控中心提供。
1.2.3 光合参数测定 于上午8:00-11:30,用CIRAS-3便携式光合仪(英国汉莎)测定光合相关参数,每品种(系)随机选定5株测定完全展开的功能叶,数据稳定后记录,5次重复取平均值。
1.2.4 光合相关的酶活性测定 采集0.50 g新鲜烟草样品,用液氮速冻后,存放于-80℃冰箱中保存,采用间接酶联免疫吸附法进行测定,酶免疫试剂盒由武汉普奈斯生物科技有限公司提供。
1.2.5 农艺性状调查 每个品种(系)选择有代表性的5株,根据《YC/T 142-2010烟草农艺性状调查测量方法》[43]进行烟草农艺性状调查,测定并记录株高和节距。
1.2.6 干物质积累 每个处理选择5株长势均匀一致的植株,分为根、茎、叶片,在105℃杀青30 min,80℃烘干至恒重后测定干物质量。
1.2.7 化学成分 根据《YC/T 159、160、162、217-2002烟草和烟草制品化学成分连续流动法》[44]测定烟叶总糖、烟碱、氯和钾含量。
1.2.8 产量统计 根据《GB 2635-1992烤烟》[41]对烤后烟叶分级,统计各处理产量。
1.2.9 中性致香成分含量检测 取20.00 g烤后烟样(C3F)采用内标法[45],内标为硝基苯,通过RE-52C旋转蒸发仪(上海普渡生化科技有限公司)和7200气相色谱-质谱联用仪(安捷伦,北京)(gas chromatography-mass spectrometry,GC-MS)进行检测分析。利用NIST12检索谱库定性,并使用内标法对物质进行定量,并对测得的物质按照姜慧娟等[46]的方法进行分类。
1.2.10 烟草叶片总RNA的提取 采用AM9690 Plant RNA isolation Aid(塞默飞,上海)提取供试材料叶片总RNA,于-80℃冰箱中保存。利用HiScript Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)R223-01(南京诺唯赞生物公司)将待测RNA反转录成cDNA,储存在-20℃冰箱中备用。
引物设计采用Roche LCPDS2软件(表1)并由上海捷瑞生物工程有限公司合成。实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)利用ChamQ SYBR qPCR Master MixQ311-03试剂盒(南京诺唯赞生物公司)在LightCycler®480 II型荧光定量PCR仪(Roche,瑞士)上进行反应。反应体系10 μL:2× ChamQ SYBR qPCR Master Mix 5 μL,10 μmol·L-1正、反向引物各0.2 μL,cDNA 1 μL,ddH2O 3.6 μL。PCR程序:95℃预变性30 s;95℃变性10 s,60℃退火和延伸 30 s,共40个循环。通过2-ΔΔCt法计算基因相对表达量并作图。

表1 荧光定量引物序列Table 1 Sequences of fluorescence quantitative primers
1.3 数据分析
采用Excel 2019软件进行数据整理及作图,用SPSS 20.0 软件进行方差分析,用Duncan法进行多重比较, 用RStudio 1.2.5033软件进行相关性分析及作图。
2 结果与分析
2.1 编辑NtCPS2基因对烟草编辑系和杂种F1代顺-冷杉醇的影响
由图2可知,8306B、NYU11的顺-冷杉醇含量、NtCPS2基因相对表达量分别显著低于8306、YU11。NYU11的顺-冷杉醇含量、NtCPS2基因相对表达量与双亲MSK326和8306B相比差异均不显著;YU11的顺-冷杉醇含量、NtCPS2基因相对表达量均显著高于MSK326,而顺-冷杉醇含量与8306相比差异不显著,NtCPS2基因相对表达量则显著低于8306。
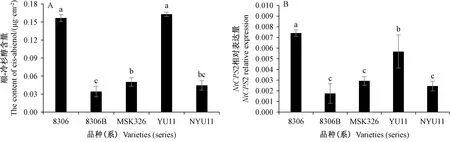
注:误差线表示标准差。不同小写字母表示品种(系)间差异显著(P<0.05)。下同。Note: The error line represents the standard deviation. Different lowercase letters represent the significant difference among varieties (series)at 0.05 level. The same as following.图2 不同品种(系)顺-冷杉醇含量及合成基因表达量的比较Fig.2 The content and the synthetic gene expression in different varieties (series)
2.2 编辑NtCPS2基因对烟草编辑系和杂种F1代内源激素的影响
由图3可知,8306B、NYU11的赤霉素含量分别显著高于8306、YU11,脱落酸含量分别显著低于8306、YU11。NYU11的赤霉素含量与双亲差异显著,且含量顺序为MSK326>NYU11>8306B,YU11的赤霉素含量显著低于MSK326,与8306差异不显著(图3-A);NYU11的脱落酸含量与双亲差异显著,表现为MSK326>NYU11>8306B,YU11的脱落酸含量显著低于双亲(图3-B)。说明NtCPS2基因编辑后赤霉素含量增加,脱落酸含量降低。

图3 不同品种(系)内源激素含量比较Fig.3 Endogenous hormones content of in different varieties (series)
由图4-A、B可知,8306B的CPS基因相对表达量显著高于8306,NYU11的CPS基因相对表达量与YU11差异不显著,8306B、NYU11的GA20ox基因相对表达量分别显著高于8306、YU11。NYU11、YU11的CPS、GA20ox基因相对表达量分别与MSK326差异不显著。由上述结果可知,NtCPS2基因对CPS的表达影响显著,其中GA20ox基因表达在杂交后代中遗传效应显著。
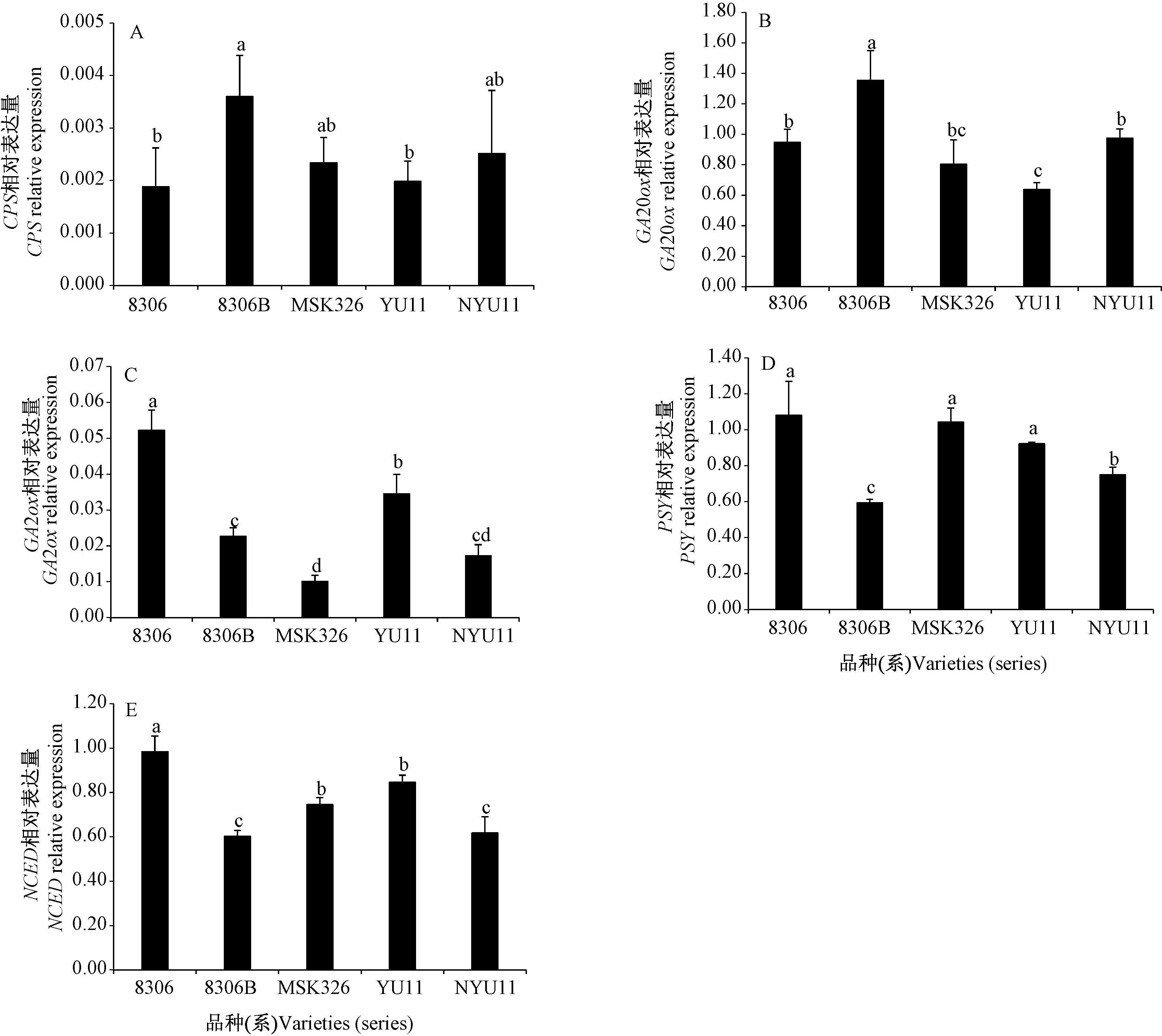
图4 不同品种(系)内源激素基因相对表达量的比较Fig.4 Endogenous hormones gene relative expression of in different varieties (series)
由图4-C~E可知,8306B、NYU11的GA2ox、PSY、NCED基因相对表达量分别显著低于8306、YU11。NYU11的GA2ox基因相对表达量与双亲差异不显著,YU11的GA2ox基因相对表达量显著差异于双亲,8306>YU11>MSK326,NtCPS2基因编辑后赤霉素合成负调控基因GA2ox的相对表达量显著降低(图4-C)。NYU11的PSY基因相对表达量显著差异于双亲,MSK326>NYU11>8306B,YU11的PSY基因相对表达量与双亲差异不显著(图4-D)。NYU11的NCED基因相对表达量显著低于MSK326,与8306B差异不显著,YU11的NCED基因相对表达量显著低于8306,与MSK326差异不显著(图4-E),NtCPS2基因编辑后脱落酸合成途径中的正调控基因PSY、NCED的相对表达量显著降低。
2.3 编辑NtCPS2基因对烟草编辑系和杂种F1代气孔开度的影响
由图5可知,8306B、NYU11的气孔闭合比率分别显著低于8306、YU11。NYU11的气孔闭合比率与双亲的差异显著,MSK326>NYU11>8306B,YU11的气孔闭合比率显著低于双亲。表明NtCPS2基因编辑后降低了气孔闭合比率且可在杂交后代中遗传。

图5 不同品种(系)气孔闭合比率的比较Fig.5 Stomatal closure ratio of in different varieties (series)
2.4 编辑NtCPS2基因对烟草编辑系和杂种F1代光合作用的影响
2.4.1 编辑NtCPS2基因对烟草编辑系和杂种F1代光合参数的影响 由表2可知,8306B、NYU11的Pr、Ci、Gs、Tr、水汽压亏缺(vapor pressure deficit,VPD)分别显著高于8306、YU11,水分利用率(water use efficiency,WUE)分别显著低于8306、YU11。YU11和NYU11的Pr、Ci、Tr在亲本之间,未发生超亲遗传现象。
2.4.2 编辑NtCPS2基因对烟草编辑系和杂种F1代光合相关酶活及基因相对表达量的影响 由图6可知,8306B、NYU11的Rubisco、GAPDH活性分别显著高于8306、YU11。YU11、NYU11的Rubisco活性均显

表2 不同品种(系)F1代光合参数比较Table 2 Photosynthetic parameters of in different varieties (series)
著高于双亲(图6-A);NYU11的GAPDH活性显著高于双亲,YU11的GAPDH活性与双亲差异显著,MSK326>YU11>8306(图6-B)。
由图7可知,8306B、NYU11的Rubisco、GAPDH基因相对表达量分别显著高于8306、YU11。NYU11的Rubisco、GAPDH基因相对表达量显著高于MSK326,与8306B差异不显著,YU11的Rubisco、GAPDH基因相对表达量与双亲MSK326和8306相比差异不显著。可知光合相关酶活性及基因相对表达量在编辑NtCPS2基因后显著增加。
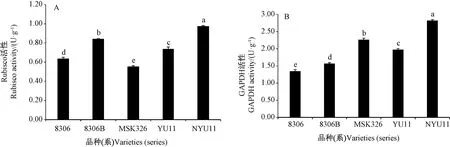
图6 不同品种(系)光合相关酶活的比较Fig.6 Photosynthesis-related enzyme activities of in different varieties (series)

图7 不同品种(系)光合相关基因相对表达量的比较Fig.7 Photosynthesis-related gene relative expression of in different varieties (series)

注:* 表示P<0.05 水平上显著相关,** 表示P<0.01 水平上极显著相关,***表示P<0.001 水平上极显著相关。Note:* indicates significant correlation at 0.05 level, ** indicates extremely significant correlation at 0.01 level, and *** indicates extremely significant correlation at 0.001 level.图8 NtCPS2基因与光合作用相关基因的相关性分析Fig.8 Correlation analysis between NtCPS2 gene and genes related to photosynthesis
2.5 萜类合成基因与光合作用相关基因的相关性分析
对8306编辑系和杂种F1代的萜类(顺-冷杉醇、赤霉素、脱落酸)合成基因、气孔闭合率与光合作用酶活相关基因进行相关性统计分析,结果见图8。烟叶中CPS、光合作用相关基因Rubisco、GAPDH相对表达量均与NtCPS2相对表达量呈负相关性,其中烟叶中的CPS相对表达量与NtCPS2相对表达量在P<0.05 水平上呈显著负相关,Rubisco、GAPDH相对表达量均与NtCPS2相对表达量在P<0.001水平上呈极显著负相关,且相关系数较大,分别为-0.776和-0.840;烟叶中CPS相对表达量与PSY相对表达量在P<0.01水平上呈极显著负相关,其相关系数为-0.651;烟叶的气孔闭合率与PSY相对表达量在P<0.001水平上呈极显著正相关,其相关系数为0.891。表明NtCPS2基因相对表达量降低可能提高光合效率。
2.6 编辑NtCPS2基因对烟草编辑系和杂种F1代农艺性状的影响
由表3可知,8306B、NYU11的株高、叶数、节距分别显著高于8306、YU11,茎围、最大叶长、最大叶宽、最大叶面积与8306、YU11相比差异不显著。NYU11的株高、茎围与双亲差异显著,表现为MSK326>NYU11>8306B;YU11的株高显著差异于双亲,表现为MSK326>YU11>8306。表明在农艺性状的各项指标中NtCPS2基因对株高和节距的影响最明显。
2.7 编辑NtCPS2基因对烟草编辑系和杂种F1代光合产物及品质的影响
2.7.1 编辑NtCPS2基因对烟草编辑系和杂种F1代干物质积累的影响 由图 9-A可知,8306B、NYU11的干物质积累总量分别较8306、YU11高19.96%、9.20%。8306B、NYU11的叶干物质积累量分别较8306、YU11高27.73%、11.94%;8306B、NYU11的根干物质积累量均显著大于8306、YU11;茎干物质积

图9 不同品种(系)干物质积累与分配的比较Fig.9 Dry matter accumulation and allocation of in different varieties (series)
累量差异不显著。由图9-B可知,烤烟干物质主要分配给烟叶,8306B、NYU11的干物质量分配给叶、根的比例分别大于8306、YU11,8306B、NYU11的叶干物质分配量分别较8306、YU11多4.46和1.54个百分点。由上述结果可知,烟株干物质积累量在编辑NtCPS2基因后显著增加,其中叶和茎干物质分配率明显增加。
2.7.2 编辑NtCPS2基因对烟草编辑系和杂种F1代产量的影响 由图10可知,8306B、NYU11的产量分别显著高于8306、YU11。NYU11的产量显著高于双亲,YU11的产量显著高于8306,与MSK326差异不显著。
2.7.3 编辑NtCPS2基因对烟草编辑系和杂种F1代化学成分的影响 由表4可知,8306B的烟碱含量显著低于8306,总糖含量、氯离子含量、钾离子含量、糖碱比显著高于8306;NYU11的烟碱含量、氯离子含量显著低于YU11,总糖含量、钾离子含量、糖碱比、钾氯比显著高于YU11。NYU11的烟碱含量、总糖含量、糖碱比与双亲差异显著;YU11的总糖含量显著低于双亲,烟碱含量显著高于8306,糖碱比在双亲之间,氯离子含量显著高于MSK326,钾离子含量、钾氯比显著低于MSK326。NtCPS2基因的表达量影响烟草化学成分的含量,其中烟碱含量显著降低,总糖含量、钾离子含量显著增加。

图10 不同品种(系)产量的差异比较Fig.10 Yield of in different varieties (series)

表4 不同品种(系)化学成分的差异比较Table 4 Chemical composition of in different varieties (series)
2.7.4 编辑NtCPS2基因对烟草编辑系和杂种F1代中性致香成分的影响 由表5可知,8306B、NYU11的芳香族氨基酸降解产物、美拉德反应产物、类西柏烷降解产物、类胡萝卜素降解产物、叶绿素降解产物含量分别显著高于8306、YU11。NYU11、YU11的中性致香产物含量未发生超亲遗传现象,表明编辑NtCPS2基因增加了中性致香成分的含量。

表5 不同品种(系)中性致香成分的差异比较Table 5 Neutral aroma components of in different cultivars (strains) /(μg·g-1)
3 讨论

图11 NtCPS2基因对烟草光合作用影响的代谢网络Fig.11 Metabolic network of the effect of NtCPS2 gene on photosynthesis in tobacco
顺-冷杉醇与GAs均是二萜化合物,由GGPP作为前体物质经过萜烯合成酶(terpene synthases, TPSs)催化分别生成顺-冷杉醇和内-贝壳杉烯,内-贝壳杉烯再经细胞色素P450单加氧酶(cytochrome P450 monooxygenases, P450s)和2-酮戊二酸依赖的双加氧酶(2-oxoglutarate-dependent dioxygenases, 2ODDs)生成GAs[47-50]。编码萜烯合成酶的基因NtCPS2被编辑后,顺-冷杉醇含量降低的同时GAs含量显著增加,推测顺-冷杉醇含量的降低可能减少了对共同前体物质GGPP的竞争[39],导致GAs含量增加[8]。此外,本研究发现,编辑NtCPS2基因影响了GAs合成途径中相关基因的表达,进而提高了GAs含量,但编辑NtCPS2基因后与顺-冷杉醇和GAs有共同前体物质的ABA含量及相关基因表达量显著降低,因此编辑NtCPS2基因对ABA含量的影响与GAs不同,ABA含量降低的原因可能是受到其与GAs的拮抗作用影响[51]。周玲等[52]研究发现外源施加不同浓度的 GA3 降低了瓜尔豆的 ABA含量,本研究结果与之相似。有研究进一步表明,GAs诱导的Ca2+/钙调素信号调节水解酶的合成和分泌,而ABA阻断水解酶的表达[53],这可能解释了GAs和ABA之间的拮抗作用[54]。
本研究发现,编辑NtCPS2基因后的烟株ABA含量降低引起叶片气孔闭合率下降、气孔导度增加、植株光合作用增强,该结果与王清泉[55]的研究结果相近,即ABA含量与气孔开度存在显著的负相关关系。Tal等[56]研究同样表明,内源ABA水平过低的植物突变体气孔开度明显增大。赵新宇等[57]研究发现将不同生育时期的离体大豆植株浸泡于含有ABA的营养液后叶片的气孔均关闭,进而对大豆叶片光合产生显著的抑制作用,本研究结果与之相似,ABA含量降低间接导致光合作用速率增加,推测ABA含量降低导致的气孔导度增大可以进一步导致Ci增高,进而使叶片净光合速率升高[58]。同时,编辑NtCPS2基因后光合作用相关酶(Rubisco、GAPDH)的活性及基因相对表达量均增加。Rubisco[59]和GAPDH活性提高可以使烟草的光合效率和光合环的运转效率增加、促进光合作用增强[60]。
此外,对顺-冷杉醇、GAs、ABA合成途径中萜烯合成酶基因NtCPS2、CPS、PSY,气孔闭合率和光合作用酶活相关基因Rubisco、GAPDH进行了相关性分析,结果表明NtCPS2基因相对表达量降低间接促进烟株的光合作用、提高了烟株的光合效率。
综上所述,NtCPS2对烟草光合特征的影响可能如图11所示。编辑NtCPS2基因后,NtCPS2基因相对表达量降低,GGPP含量增加,GAs合成正调控基因相对表达量增加,负调控基因的相对表达量降低,导致GAs含量增加,推测由于GAs和ABA之间的拮抗作用,ABA含量降低,导致气孔闭合率降低,从而由外界环境经由气孔扩散到叶肉组织的CO2浓度(Ci)增高,进而提高叶片的光合能力。
光合作用是作物产量形成的基础,作物干物质90%以上来源于光合作用[61]。本研究表明编辑NtCPS2基因后烟株光能利用效率的增加导致株高、干物质积累和产量增加,与Dalal等[62]的研究结果相近。此外,8306B、NYU11的化学成分与8306、YU11有所不同,编辑NtCPS2后烟碱含量显著降低、钾离子含量明显增加,可能是由于赤霉素含量的提高促使植物体内IAA含量增加,间接抑制了烟碱合成酶的活性导致烟碱含量降低[63-64],并且赤霉素含量的提高促进了钾离子的运输通道打开以及载体数量的增加[65]。同时,有研究表明钾离子含量增高有利于提高烟叶的中性致香物质含量[66],与本研究结果相似。
4 结论
本试验探究了JN6CPS2基因对先合作用的调控方式,为萜类化合物对植物光合作用反馈调节作用研究提供例证,发现降低NtCPS2基因相对表达量,可以增加纯合突变植株的赤霉素含量,影响赤霉素合成途径中CPS、GA20ox、GA2ox等基因的表达量,降低脱落酸含量及基因表达量和气孔闭合率,从而提高光合酶活性及基因表达量、光合色素含量,改善植株的光合效率,提高叶片干物质积累量和烟叶的品质,而且对于以纯合突变植株为亲本的杂种F1代与以野生型植株为亲本的豫烟11号有相似的变化趋势。

