甜叶菊中9种甜菊醇糖苷积累与其生物合成关键基因表达量的相关性
张 虹 路国栋 袁春春 郎思睿 陈 任
(宁夏大学生命科学学院/西部特色生物资源保护与利用教育部重点实验室/ 宁夏优势特色作物现代分子育种重点实验室, 宁夏 银川 750021)
甜叶菊(SteviarebaudianaBertoni)属菊科多年生草本植物,叶片中富含甜菊醇糖苷(steviol glycosids,SGs),甜度为蔗糖的150~350倍[1-3],热量几乎为零,是目前已知最甜且安全有效的天然糖料[4],可作为儿童、成年人及老年人嗜糖群体理想的天然甜味剂。研究发现甜菊醇糖苷不仅能明显降低Ⅱ型糖尿病患者的血糖水平[5-6],抑制高血糖素分泌,而且具有促进肥胖症患者减肥的作用,同时还具有降低血压、降低尿酸值、抗氧化、抗病毒、清除皮肤炎症等功效[7-8]。随着人们对健康的崇尚,联合国粮农组织和世界卫生组织联合食品添加剂专家委员会第 73 次会议批准纯度不低于95%的甜菊醇糖苷可作为甜味剂使用[9]。欧盟食品安全局于2011年批准纯度不低于95%的甜菊醇糖苷为食品添加剂[10],因此,甜菊醇糖苷在食品、医药、饮料、酿造、化妆品、饲料等生产领域应用非常广泛。
甜叶菊中的主要甜菊醇糖苷成分有甜菊糖苷(stevioside, ST)、莱宝迪苷A(rebaudioside A, RA)、莱宝迪苷B(rebaudioside B, RB)、莱宝迪苷C(rebaudioside C, RC)、莱宝迪苷D(rebaudioside D, RD)、莱宝迪苷E(rebaudioside E, RE)、莱宝迪苷F(rebaudioside F, RF)、甜茶糖苷(rubusoside, RBS)和杜尔可苷A(dulcoside A, DA)9种。其中,ST的甜度是蔗糖的250~300倍,带有后苦味;RA的甜度是蔗糖的350~450倍,无后苦味,味质上与蔗糖较为接近,口感和品质优于ST,近几年被广泛应用到低热量食品及饮料开发中;RD在甜叶菊叶中的含量仅次于RA,其甜度是蔗糖的250倍[11-12];RC、DA的甜度仅有蔗糖的40~60倍,伴有较强苦涩味。目前,RA、RD被简称为甜味糖苷, ST、RC、DA为苦味糖苷,其在总糖苷中的比例将影响到甜菊醇糖苷的品质及市场应用范围。为提高甜菊醇糖苷的经济价值,开发不含苦味糖苷的高纯度RA、RD产品,及对9种主要甜菊醇糖苷成分分离提纯后复配使用是今后甜叶菊产业发展的方向,因此,筛选及培育甜味糖苷高含量的甜叶菊新品系势在必行。
在9种甜菊醇糖苷的生物合成途径中,糖苷配基甜菊醇在不同的植物UDP-糖基转移酶(uridine diphosphate-glycosyltransferases, UGTs)作用下,在C-19和C-13位上分别连接不同数目的葡萄糖基、木质糖基和鼠李糖基,形成不同甜度和甜味的甜菊醇糖苷单品[13]。目前对甜叶菊UDP-糖基转移酶基因的研究多关注于SrUGT91D2e、SrUGT74G1和SrUGT76G1,其中SrUGT76G1是调控ST向RA转变的关键基因[14-15],SrUGT74G1的表达调控ST合成,SrUGT91D2e的表达可催化甜菊醇单糖苷转化为甜菊醇双糖苷[16]。SrUGT91D2e的表达还参与RD的合成,而SrUGT76G1和SrUGT74G1的表达参与RC、DA的合成[17-18]。
甜菊醇糖苷的积累是一个复杂的动力学过程[19],即使同一品种在不同的生长条件下,糖苷的积累量也不同;同一生长条件下的同一品种,在不同发育时期,糖苷含量也不同,已有研究表明在花芽形成末期到开花初期,糖苷含量达到最大值[20],且不同叶位的叶片糖苷含量不同,植株上位叶片的糖苷含量高于中间和下位叶。虽然已有一些研究表明糖苷的积累量受其生物合成途径关键基因表达量的影响,但仅限于总糖苷及RA、ST的积累研究[21],以及RA的积累与其主控基因表达量的关系,鲜有对9种甜菊醇糖苷的积累与已报道的UDP-糖基转移酶基因表达量的相关性在甜叶菊中无相关研究。本研究对3个甜叶菊品种3个生长时期的9种主要甜菊醇糖苷含量进行测定分析,同时对相关关键酶基因的表达情况进行实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)检测,并进行相关性分析,旨在探究甜菊醇糖苷积累与基因表达之间的关系,为农业生产中优质甜叶菊品种的选育提供科学依据。
1 材料与方法
1.1 材料与试剂
普赛科3号、同心、中山2号3个甜叶菊品种种植于宁夏大学生命科学学院实验用地,试验地肥水常规处理。在3个生长发育时期(幼苗期、营养生长期、花蕾期)采取每个品种随机植株的上位3对叶片作为样本,每个品种每个时期进行3次重复。
ST、RA、RB、RC、RD、RE、RF、RBS、DA(纯度≥97%)购自上海甄准生物科技有限公司。甲醇购自上海广诺科技有限公司,乙腈(色谱纯)购自美国MredATechnology公司,RE-05021植物总RNA提取试剂盒购自成都福际生物技术有限公司,AT311-03反转录试剂盒购自北京全式金生物。
1.2 仪器与设备
离子阱质谱仪(QTRAP 6500),美国AB SCIEX;色谱柱(T3 i.d.2.1, HSS T3 1.8.2),美国WATERS;超微量分光光度计(NaroDrop 2000),美国Thermo Fisher Scientific;荧光定量PCR仪(qTOWER3),德国Analytik Jena。
1.3 试验方法
1.3.1 甜菊醇糖苷提取及含量测定 试验材料经冷冻干燥后,取25 mg样本,加入500 μL 70%甲醇水溶液,超声10 min,12 000 r·min-1离心10 min,取上清,往沉淀中加入500 μL 70%甲醇水溶液重复提取1次,12 000 r·min-1离心10 min后合并上清液,上清液过滤膜后采用离子阱质谱仪(流动相0.04%乙酸超纯水/5%~95%乙睛梯度洗脱)对RA、RB、RC、RD、RE、RF、ST、RBS、DA 9种甜菊醇糖苷成分进行绝对定量检测。
1.3.2 基因表达量检测 甜叶菊叶总RNA提取采用植物总RNA提取试剂盒的方法;各RNA浓度及质量用超微量分光光度计检测,用RNase-Free双蒸水稀释至40 ng·μL-1作为样本RNA。
每个样品分别取出部分RNA混合,用RNase-Free双蒸水调整成400 ng·μL-1的RNA溶液100 μL,然后稀释4倍,配制6份作为绘制标准曲线用的RNA溶液、浓度分别为1/2、1/4、1/16、1/64、1/256、1/1 024。
反转录合成cDNA第一条链采用反转录试剂盒提供的方法,每份待测样品以及6份作为标准曲线用的样品总RNA,分别加入到每份反应液中反转录合成cDNA第一链。
1.3.3 实时荧光定量PCR引物设计及基因表达检测 采用Primer Express 3.0软件(美国Applied Biosystems)设计各个基因的qRT-PCR扩增引物,包括SrUGT76G1、SrUGT74G1、SrUGT91D2e以及作为内参的甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)基因(表1),采用荧光定量PCR仪检测每个样本的基因表达情况。每次反应(即每个96孔PCR板)分析一个基因,包括18份样本cDNA,6个标准线cDNA和2个空白对照、3次生物学重复。
qRT-PCR结束后,根据程序给定的本底基准线PCR Baseline Subtracted(PCR增殖达对数阶段),从扩增曲线上读取每个基因在各个样本的循环阈值Ct(threshold cycle),然后根据标准线,获得每个基因在各个样本的起始质量SQ值(starting quantity)。通过每个基因与内参基因SQ的比值,计算每个基因在各个样本的相对表达量和标准差。

表1 qRT-PCR引物序列Table 1 Primer sequences for fluorescent qRT-PCR

表2 不同品种不同生长发育时期9种甜菊醇糖苷含量Table 2 The contents of 9 steviol glycosides in differenTGrowth cultivars and different stages
1.3.4 数据统计与分析 采用Microsoft Excel 2016及SPSS 16.0对数据进行统计分析,Duncan法进行显著性差异分析,采用Cytoscape 3.7.0进行可视化网络分析。
2 结果与分析
2.1 9种甜菊醇糖苷在3个品种3个生长发育时期中的含量变化
甜菊醇糖苷含量的检测结果表明,RB、RE、RF、ST、RBS、DA在普塞科3号中的3个生长发育时期无显著差异,其中苦味糖苷ST的平均含量为0.49 mg·g-1(干重,下同),DA含量为0.01 mg·g-1;RA、RC、RD在不同生长发育时期其含量有显著变化,其中甜味糖苷RA在营养生长期含量最高为1.60 mg·g-1,RD在花蕾期含量最高为1.58 mg·g-1,苦味糖苷RC在营养生长期的含量显著高于花蕾期和幼苗期,为0.41 mg·g-1(表2)。
RA在中山二号的3个生长发育时期无显著差异,在营养生长期含量最高为1.26 mg·g-1;RB、RC、RD、RE、RF、ST、RBS、DA在不同生长发育时期含量有显著变化,其中甜味糖苷RD在营养生长期和花蕾期含量显著高于幼苗期,最高为0.85 mg·g-1;苦味糖苷RC在花蕾期的含量最高,为0.70 mg·g-1,且花蕾期和营养生长期的含量显著高于幼苗期;ST在花蕾期的含量最高,为0.91 mg·g-1,且幼苗期和花蕾期的含量显著高于营养生长期。
RA、ST在同心的3个生长发育时期无显著差异,其中甜味糖苷RA在幼苗期的含量为1.20 mg·g-1,苦味糖苷ST在营养生长期的含量为1.05 mg·g-1;RC、RD、RE、RF、RBS、DA在不同生长发育时期其含量有显著变化,其中甜味糖苷RD、RF在营养生长期的含量显著高于幼苗期,分别为0.70 mg·g-1和1.25 mg·g-1,苦味糖苷RC在营养生长期的含量最高,为0.71 mg·g-1,且营养生长期的含量显著高于幼苗期和花蕾期;DA在花蕾期的含量最高,为0.63 mg·g-1,且花蕾期和营养生长期的含量显著高于幼苗期。
对3个品种在3个时期的9种甜菊醇糖苷含量变化进行柱形图分析,结果表明,在幼苗期和营养生长期,甜味糖苷RA、RD在普塞科3号中的含量显著高于中山2号和同心,RA在营养生长期含量最高,为1.60 mg·g-1;苦味类糖苷RC、ST、DA在普塞科3号中的含量显著低于中山2号和同心,其中DA在普塞科3号的3个发育时期中的含量都为0.01 mg·g-1;在营养生长期和花蕾期,RE、RF、ST、DA在同心中的含量显著高于中山2号和普塞科3号(图1)。
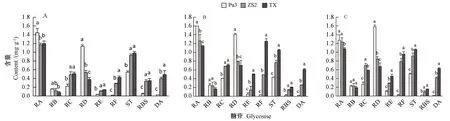
注:A:幼苗期;B: 营养生长期;C:花蕾期。不同小写字母表示同一时期不同品种间差异显著(P<0.05)。下同。Note: A: Young seedling stage. B: Vegetative stage. C: Flower budding stage. Different lowercase letters indicates significance difference at 0.05 level among differenTCultivars in same growth stages. The same as following.图1 同一时期不同品种间糖苷含量的差异性Fig.1 The content differences of 9 SGs in differenTCultivars at same growth stages
2.2 3个品种3个生长发育时期甜菊醇糖苷合成关键酶基因表达变化
对甜菊醇糖苷生物合成途径相关基因进行qRT-PCR检测分析,在同一生长发育时期,SrUGT91D2e和SrUGT76G1在普塞科3号中的表达最高,这与甜味糖苷RA、RD在3个品种的含量特点一致;而SrUGT74G1在普赛科3号中的表达量最低,这与苦味糖苷RC、ST、DA在3个品种中的含量特点一致,且与RE、RF在3个品种中的含量特点一致(图2)。
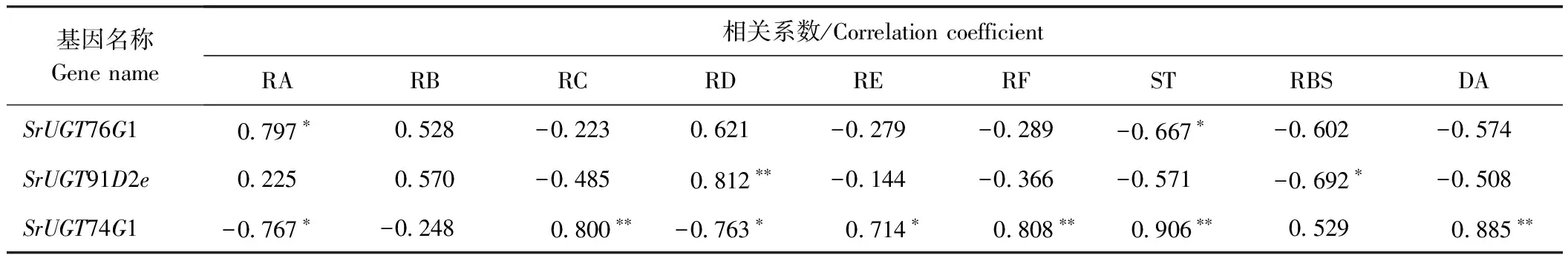
表3 甜菊醇糖苷生物合成关键基因表达量与9种糖苷含量的相关关系Table 3 The correlation between the expression levels of the key genes in SGs biosynthesis and the contents of 9 SGs
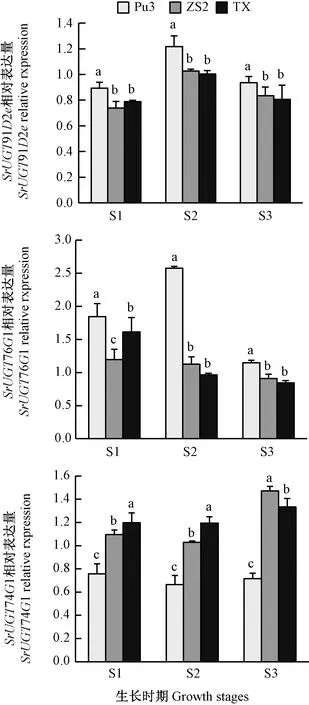
图2 甜菊醇生物合成关键基因在不同品种 不同生长发育时期表达变化Fig.2 Expression level changess of the key genes in SGs biosynthesis in differenTCultivars and growth stages
2.3 不同甜菊醇糖苷含量与其合成关键酶基因表达量的相关分析
将不同品种不同生长发育时期的各种甜菊醇糖苷含量与其合成关键酶基因的相对表达量进行相关分析,结果表明,SrUGT76G1表达水平与RA含量呈显著正相关(P<0.05),与ST含量呈显著负相关(P<0.05);SrUGT91D2e表达水平与RD含量呈极显著正相关(P<0.01),与RBS含量呈显著负相关(P<0.05);SrUGT74G1表达水平与RC、RF、ST、DA含量呈极显著正相关(P<0.01),与RA、RD含量呈显著负相关(P<0.05)(表3)。通过基因表达量与糖苷含量之间的相关系数,利用Cytoscape 3.7.0进行可视化分析,基因与所调控的甜菊醇糖苷之间均存在0.80(红色连线)以上相互关系,其中SrUGT76G1主要影响甜味糖苷RA的含量,SrUGT91D2e影响甜味糖苷RD的含量,SrUGT74G1的影响苦味糖苷ST和DA的含量(图3)。
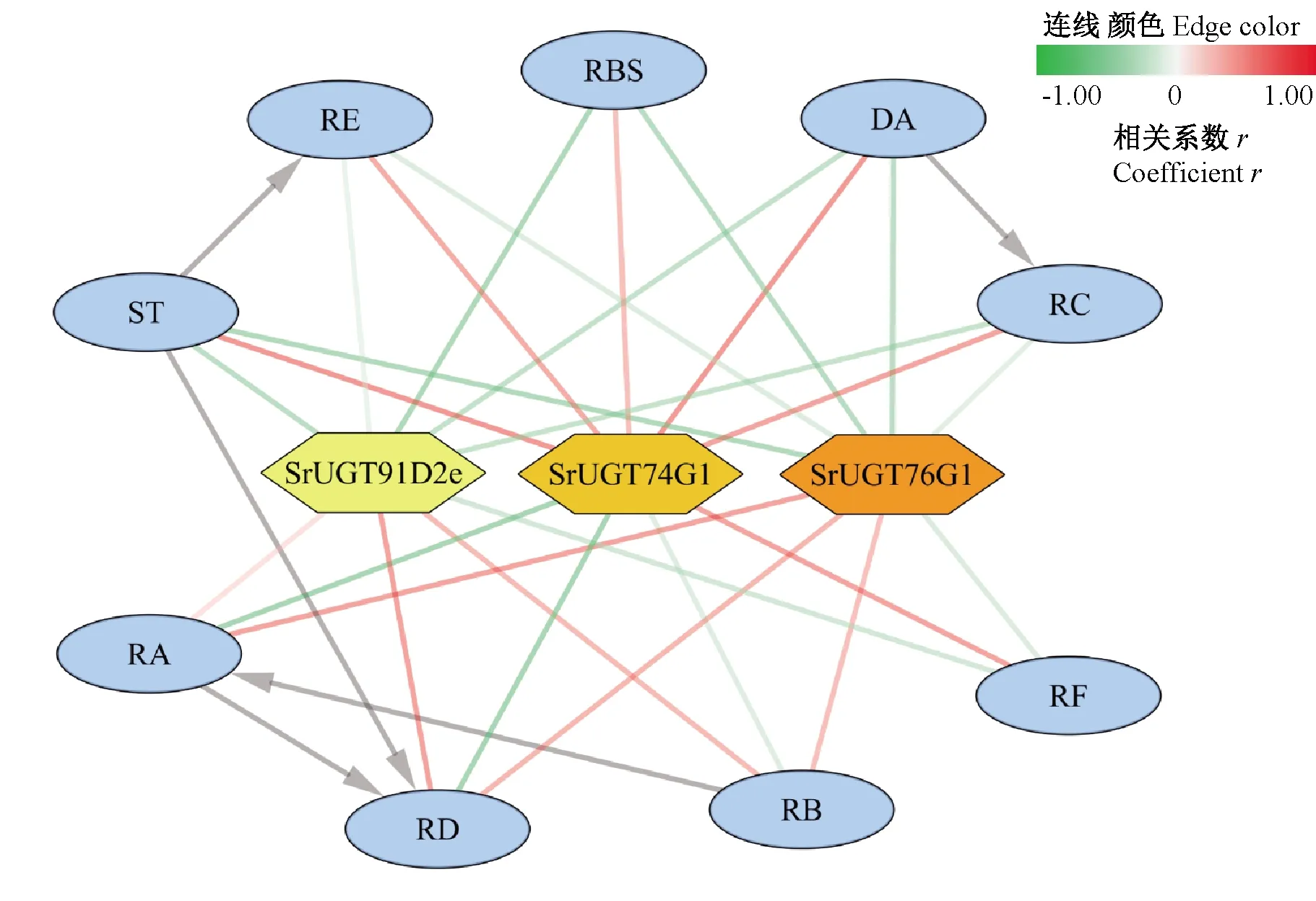
注: 基因表达量与甜菊醇糖苷含量的关联系数用直线表示, 正、负 相关分别为红色、绿色, 相关系数越大颜色越深。Note: The relationship between the expression levels of the key genes in SGs biosynthesis and the contents of 9 SGs are expressed in straight lines, positive and negative correlation are shown in red and green, and the darker color means the higher coefficient.图3 甜菊醇糖苷生物合成关键基因表达量与9种甜菊醇 糖苷含量之间相互关系Fig.3 Relationship of between the expression levels of the key genes in SGs biosynthesis and the contents of 9 SGs
3 讨论
3.1 甜菊醇糖苷在不同甜叶菊品种积累差异
各种甜菊醇糖苷在不同甜叶菊品种中的积累量不同,赵永平等[22]对引种的7个甜叶菊品种的RA进行了检测,ZS-3的RA含量为7.69%,极显著高于其他品种,HY-1的RC含量极显著高于其他品种。郭志龙等[23]对12个扦插培育的甜叶菊品系进行了5种甜菊醇糖苷含量的测定,分析出了2个RA和RD含量占比较高的品系。朱静雯等[24]对守田3号、江甜3号、谱星1号3个品种收获期RA和ST的含量进行了测定,结果表明RA在江甜3号中最高,ST在守田3号中最高。本研究对9种甜菊醇糖苷在3个品种中的积累量进行了检测,同前人分析结果相似,不同甜菊醇糖苷在不同品种中的积累量不同,普塞科3号中的甜味糖苷RA、RD的含量最高,2种甜味糖苷总量占9种糖苷总量的71%(中山2号40%,同心31%),而苦味糖苷ST、RC、DA的含量最低,3种苦味糖苷总量占9种糖苷总量的20%(中山2号38%,同心40%),可能是不同的品种具有不同的生理特性,导致糖苷的累积量不同。此外,不同生长发育时期,甜叶菊叶片接受的光照时长不同,其甜菊醇糖苷积累量也不同。Ceunen等[25-26]研究表明,糖苷的积累量受光周期的影响,在长日照条件下,甜叶菊叶生物量和总糖苷含量明显上升,且RA与ST的含量比显著增加。本试验也得到了类似的结果,甜味糖苷RA在普塞科3号的营养生长时期(长日照)含量最高为1.60 mg·g-1,而ST在3个生长发育时期的积累量无显著变化,从而导致在长日照的营养生长期RA与ST的含量比显著增加。因此,在品种选育上,普塞科3号是较好的甜味糖苷高含量可选品种,可选择在营养生长期或花蕾期进行收获,以获得较高纯度的甜味成分甜菊醇糖苷。
3.2 生物合成途径相关基因表达量对甜菊醇糖苷积累的影响
不同甜菊醇糖苷单品的积累量受其生物合成相关UGTs基因的表达调控,SrUGT76G1是RA合成的主要调控基因,在过表达SrUGT76G1的转基因植株中,相比对照,RA与ST的含量比由0.3上升为1.55[17]。Mandal等[27]对甜叶菊3个生长发育时期的11个关键基因表达水平和单糖苷含量进行了检测,结果表明,SrUGT76G1的高水平表达能够提高RA与ST的含量比,从而提高甜菊醇糖苷混合物的甜度。Yang等[28]研究了甜叶菊不同生长发育时期甜菊醇糖苷的含量及合成途径相关的15个基因的表达情况,结果显示,在整个生长发育时期,甜菊醇糖苷的含量变化明显,在花芽期RA和ST的含量都显著高于快速生长发育期和盛花期,SrUGT74G1和SrUGT76G1在花芽期和盛花期的表达量显著增加,SrUGT74G1在花芽期的表达量最高,ST在花芽期的含量最高。本试验中,在甜味糖苷RA含量较高的植株中检测到了SrUGT76G1的高水平表达,在ST含量较低的植株中检测到了SrUGT74G1的低水平表达,与前人结果一致。但不同的是,本试验检测到RA含量较高的时期是营养生长期,而非花蕾期,这可能是同一基因在不同品种中的表达时期不同。此外,本试验结果表明甜味糖苷RD含量与SrUGT91D2e的表达水平呈极显著正相关,而苦味糖苷ST、RC和DA含量与SrUGT74G1的表达水平呈极显著正相关,说明不同甜菊醇糖苷的含量受其主控基因表达量的影响。因此,可利用基因的表达来调控不同甜菊醇糖苷的含量,提高甜味糖苷和苦味糖苷的比例,以获得高质量的甜菊醇糖苷。
4 结论
通过利用液相色谱-质谱法(liquid chromatography mass spectrometry, HPLC-MS)对3个品种甜叶菊在不同生长发育时期上位3对叶片中的9种甜菊醇糖苷含量进行检测分析,普塞科3号中甜味糖苷RA和RD的含量显著高于中山2号和同心,普塞科3号中苦味糖苷ST、RC和DA的含量显著低于中山2号和同心,普塞科3号可作为理想的高甜味糖苷选育品种。对甜菊醇糖苷合成相关基因表达量及糖苷含量进行相关性分析及可视化构图分析,进一步证实SrUGT76G1是影响甜味糖苷RA含量的关键基因,推测SrUGT91D2e是影响甜味糖苷RD含量的关键基因,SrUGT74G1是影响苦味糖苷ST和DA含量的关键基因,其在9种甜菊醇糖苷合成中的具体功能需进一步利用分子生物学方法进行验证。

