来自Yeosuana marina sp. JLT21内切型海藻酸裂解酶的异源表达及酶学表征
常晴 束月蓉 王文韬 蒋昊 延泉德 钱政 高雪纯 吴金鸿 张勇
(1. 上海交通大学生命科学技术学院 微生物代谢国家重点实验室,上海 200240;2. 上海交通大学农业生物技术学院 农业与生物学院食品科学与工程系,上海 200240)
海藻酸钠是褐藻中含量最丰富的多糖,约占褐藻干重的40%[1]。它们的化学结构主要是由β-D-甘露糖醛酸(β-D-mannuronic acid,M)及其C5同分异构体α-L-古罗糖醛酸(α-L-guluronic acid,G)通过1,4-糖苷键连接而成的线性分子[2],有3种嵌段聚甘露糖酸(Poly M)、聚古罗糖醛酸(Poly G)和杂聚物(Poly MG)[3]。海藻酸钠在食品、化妆品和制药工业中被广泛用作稳定剂、乳化剂、增稠剂和成胶剂[4]。一些细菌也可以合成海藻酸钠,以使其免受抗生素和干旱等不利环境因素的影响[5]。海藻寡糖(alginate oligosaccharides,AOs)是海藻酸钠通过物理、化学方法或海藻酸裂解酶处理解聚后的低分子聚糖产物,常表现出免疫调节、抗菌、抗氧化、抗高血压、抗糖尿病、抗肿瘤、抗凝血等多种生物学功能,在食品和医药领域有着广泛应用前景[6]。酶法降解海藻酸钠生产海藻寡糖因具有高效性、专一性、条件温和等优点,已成为海藻寡糖制备领域研究的热点[6]。
海藻酸裂解酶(alginate lyases,Alys)对来自海洋的海藻酸钠降解方面发挥重要作用,可以通过β-消除机制降解海藻酸,在非还原端的C4和C5之间形成C=C双键[4]。目前,已经从海藻、海洋软体动物、细菌、真菌和病毒中分离出了海藻酸裂解酶[7]。基于底物专一性差异,海藻酸裂解酶被分为了Poly M型裂解酶(EC4.2.2.3)、Poly G型裂解酶(EC4.2.2.11)和双功能型裂解酶(EC4.2.2.-)[8]。根据氨基酸序列的相似度,在Carbohydrate-Active enZYmes(CAZy)数据库(http://www.cazy.org/)中海藻酸裂解酶可以分成10个多糖裂解酶家族(PL5、6、7、14、15、17、18、32、34和36)[9]。其中,PL7家族的海藻酸裂解酶基因在自然界中广泛存在[6]。根据裂解方式不同,海藻酸裂解酶可分为内切型和外切型[10]。外切型海藻酸裂解酶能将海藻酸钠和低聚糖降解为不饱和单糖,不饱和单糖可以转化为4-deoxy-lerythro-5-hexoseulose urinate(DEH)。作为藻类生理代谢的重要中间体,DEH也是生产生物乙醇和褐藻精炼的潜在碳源[11]。海藻酸内切酶能将海藻酸裂解酶降解成聚合度不同的不饱和寡糖(ΔDP)[12],如不饱和二糖(ΔDP2)、不饱和三糖(ΔDP3)、不饱和四糖(ΔDP4)等。内切型海藻酸裂解酶的产物主要分布在ΔDP2-ΔDP5之间[6]。海藻低聚糖(DP3-6)可作为益生元促进体内益生菌双歧杆菌和乳杆菌的生长[13]。海藻酸裂解酶与抗生素联用有望治疗细菌黏液生物膜依赖性疾病,如它们的联用发挥了降解细菌的多糖生物膜作用,被应用于治疗囊性纤维化[14]及提高对呼吸道黏液性铜绿假单胞菌的杀伤率[15]。在研究褐藻细胞壁发育制备基因工程藻类原生质方面,海藻酸裂解酶也有着重要应用价值[4]。
然而,目前已报道的外切型海藻酸裂解酶大多酶活力约为20-70 U/mg[15],使得DEH前体得率较低,同时一些海藻酸裂解酶偏好单一Poly M或Poly G底物。低活力及较窄的底物谱局限了它们在生产海藻功能性寡糖上应用前景。已有研究表明海藻酸钠内切酶和外切酶协同作用可以提高不饱和单糖得率[16],获得高活力、底物谱广阔的海藻酸裂解酶是推进功能性海藻酸钠低聚糖和生物乙醇工业化生产的关键一步。
本研究通过异源表达和表征了浅海热液中分离的Yeosuana marinasp.JLT21菌株的海藻酸裂解酶YMA-1。酶活分析显示重组YMA-1酶能够高效降解海藻酸钠、Poly M和Poly G,降解海藻酸钠主产物为不饱和三糖或四糖,是一种高活性及稳定性的内切型海藻酸裂解酶,在高效绿色制备海藻酸寡糖上有着独特应用价值。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒 YMA-1的编码序列被进行Escherichia coli密码子优化后,在上海捷瑞生物工程有限公司合成并亚克隆进pET28b,获得表达质粒pET28b-yma1,酶切位点是NheI/XhoI;E.coliBL21(DE3)感受态细胞购自上海新格元生物科技有限公司。
1.1.2 主要试剂和仪器 海藻酸钠(15-20 cps 黏度)、聚甘露糖醛酸钠(PolyM,M.W<6-8 kD)和聚古罗糖醛酸钠(PolyG,M.W<6-8 kD)购自青岛博智汇力生物科技有限公司;蛋白分子量Marker购自Bio-Rad公司;卡那霉素和Bicinchoninic acid(BCA)蛋白定量试剂盒购自上海睿谷生物科技公司。
恒温摇床Innova,德国New Brunswick Scientific;立式冷冻高速离心机,日本HITACHI;高压均质机,中国永联生物;AKTA蛋白纯化系统,重力层析柱Ni SepharoseTM6 FF,Supedex Increase 10/300 GL分子筛,美国GE Healthcare;UV-2550分光光度计,日本岛津公司;差示扫描量热仪(DSC),美国GE公司;超高效液相色谱-四极杆飞行时间质谱(G2-XS)。
1.1.3 培养基 液体LB培养基:10 g胰蛋白胨,5 g酵母粉,10 g氯化钠,添加蒸馏水定容至1 L,121℃高压蒸汽灭菌20 min。自诱导培养基:10 g胰蛋白胨,5 g酵母粉,20 mL 50×M组分,20 mL 50×5052组分,0.49 g MgSO4·7H2O,添加蒸馏水定容至1 L,115℃高压蒸汽灭菌15 min。其中,50×M组分:449.7 g/L Na2HPO4·12 H2O,170 g /L KH2PO4,133.75 g/L NH4Cl,35.5 g/L Na2SO4;50×5052组分:30% 甘油,25 g/L 葡萄糖,100 g/L半乳糖。
1.2 方法
1.2.1 海藻酸裂解酶YMA-1序列分析 使用 Compute pI /Mw(https://web.expasy.org/protparam/)分析酶的理论分子量(Mw)和等电点(pI)。使用 SignalP 5.0(http://www.cbs.dtu.dk/servi Ces/Signa LP/)预测酶信号肽。在NCBI 数据库中对海藻酸裂解酶YMA-1的蛋白氨基酸序列进行 BLASTp同源搜索。使用CLUSTALW将YMA-1与已知的PL7家族海藻酸裂解酶序列比对分析。使用ESPript 3.0(http://espri pt.ibcp.fr/ESPri pt/cgi-bin/ESPri pt.cgi)进行序列特征作图。使用MEGA 7.0软件构建PL7家族藻酸裂解酶的系统进化树。
1.2.2 海藻酸裂解酶YMA-1表达和纯化 将表达质粒pET28b-yma转化E. coliBL21(DE3)化学感受态细胞。挑取阳性单克隆接种于5 mL 补充 50 mmol/L卡那霉素的LB液体培养基,过夜培养后按1% 转接至1.0 L加入相应卡那霉素的自诱导液体培养基,37℃培养至菌体达到较高密度,在培养液OD600高于2.0时,调节摇床培养条件至 18℃,200 r/min,继续震荡培养20 h,进行重组蛋白自诱导表达。离心收集菌体细胞并重悬于250 mmol/L Tris-HCl pH 8.0,500 mmol/L NaCL缓冲液中,于高压均质机破碎,13 000×g高速离心1 h,粗酶液使用5 mL Ni-NTA预装重力柱进行纯化。以牛血清蛋白作为标准,用BCA蛋白分析试剂盒测定蛋白浓度。使用12% SDSPAGE分析海藻酸裂解酶YMA-1分子量及纯度。凝胶过滤层析在 AKTA 蛋白纯化系统的Superdex 200 increase 10/300G上进行。
1.2.3 海藻酸裂解酶YMA-1活性分析 海藻酸盐裂解酶的活性通过检查反应体系在235 nm吸光度,测定海藻酸盐裂解在C4和C5之间形成的非还原端双键。反应体系:10 mmol/L磷酸盐缓冲液 pH 8.0,100 mmol/L氯化钠,0.6 μg/mL纯酶,0.3% 海藻酸钠,30℃反应5 min,煮沸5 min后终止反应,使用紫外分光光度计读取数值。将酶催化反应体系在235 nm下吸光值每分钟增加0.1所需的酶量定义为一个酶活单位(U)。
1.2.4 海藻酸裂解酶YMA-1酶学性质分析
1.2.4.1 酶活最适pH 在不同pH的缓冲体系(pH 5.0-8.0磷酸盐缓冲液,pH 8.0-9.0 Tris-HCl 缓冲液,pH 9.0-10.0 3-(环己胺)-1-丙磺酸缓冲液)中以0.12%海藻酸钠为底物测定YMA-1酶活性最适pH。
1.2.4.2 酶活最适温度和热稳定性 以0.12%海藻酸钠为底物,在pH 9.0条件下测定酶催化最适温度。使用差示扫描量热仪(differential scanning calorimetry,DSC)测量海藻酸裂解酶YMA-1的热稳定性:参比池注入磷酸盐缓冲液,样品池注入0.5mg/mL酶液,以恒定扫描速率25-90℃加热,每次扫描之间温度保持1 min。蛋白质解聚状态的热焓是浓度正态化 DSC峰下的面积,使用热力学模型拟合数据,50% 蛋白去折叠时温度即为Tm值。
1.2.4.3 金属离子对酶活性影响 在酶反应体系中分别加入0.5 mmol/L 不同金属离子化合物,以加入相同体积的缓冲液作为对照组,测定其酶活力。
1.2.4.4 底物偏好性检测 在37℃,pH 9.0条件下分别以海藻酸钠、PolyG 和 PolyM 为底物测定酶活力,反应时间为5 min。
1.2.5 海藻酸裂解酶YMA-1动力学分析 通过测定不同海藻酸钠底物浓度(0.05 mg/mL、0.1 mg/mL、0.5mg/mL、1 mg/mL、2 mg/mL、4 mg/mL和6 mg/mL)时酶活力,并用GraphPad Prism 8.0.2软件进行Michaelis-Menten方程分析,计算酶促动力学参数。
1.2.6 海藻酸裂解酶YMA-1降解产物分析 建立1 mL反应体系:10 g/L海藻酸钠,10 mmol/L Tris-HCl 缓冲液 pH 8.0,10 U YMA-1,37℃反应12 h,煮沸5 min,加入两倍体积无水乙醇过夜沉淀蛋白,13 000×g高速离心15 min后冷冻干燥;将冻干的产物溶解于乙腈;使用超高效液色谱-四极杆飞行时间质谱(G2-XS)检测产物,色谱柱为ACQUITY UPLC BEH Amide column,流动相为含甲酸铵缓冲液(10 mmol/L)、乙腈和超纯水。
2 结果
2.1 海藻酸裂解酶YMA-1的序列特征
前期海洋嗜热菌Yeosuana marinastrain JLT21基因组已被测序并于NCBI数据库中释放(NCBI Accession:NZ_JAAKGI010000005)。分析该嗜热菌基因组序列发现,其编码一个推测的海藻酸裂解酶YMA-1(Protein ID:WP_166963834.1)。该酶含有306个氨基酸残基,SignalP 5.0预测其N端25位氨基酸残基为信号肽,提示了该酶可能是细菌分泌表达蛋白。通过在NCBI数据库进行BLASTp 分析表明,与YMA-1 序列同源性最高的是Formosa agariphilaPL7家族海藻酸裂解酶(WP_038531553.1),序列相似性76.8%。此外,为了分析YMA-1的蛋白序列进化特征,使用MEGA 7.0构建YMA-1与已知的海藻酸裂解酶Neighbor-Joining进化树,结果表明YMA-1与PL7家族海藻酸裂解酶在系统进化树上形成一个深分支的簇(图1-A)。而通过将YMA-1的蛋白氨基酸序列与PL7家族已知的海藻酸裂解酶进行多序列比对分析,揭示了YMA-1具有PL 7家族3个高度保守的区域:SA3(RSELRE)、SA4(YFKAGNYFQ)和SA5(QIH),4个典型的催化残基R(Arg121)、Q(Gln168)、H(His170)和 Y(Tyr284)(图1-B)。这些序列特征表明YMA-1是海藻酸裂解酶PL 7家族一新酶分子。

图1 海藻酸裂解酶YMA-1的系统进化树及PL7家族酶氨基酸序列比对分析Fig.1 Phylogenetic tree of alginate lyase YMA-1 and amino acid sequence alignment analysis of PL7 family enzyme
2.2 海藻酸裂解酶YMA-1的异源表达与纯化
为了大量获得YMA-1酶,在E. coliBL21(DE3)中重组酶被自诱导表达,经培养条件优化,Ni柱亲和层析初步纯化,重组酶的产率可达到不低于700 mg/L培养液。SDS-PAGE分析(图 2-A)表明,纯化的YMA-1重组酶分子量约为39 kD,接近预测的理论分子量38.5 kD,亲和层析纯化的酶蛋白纯度在90%以上。分子筛层析结果(图2-B)表明重组酶YMA-1在溶液中主要以单体形式存在。

图2 海藻酸裂解酶YMA-1的重组表达及纯化分析Fig.2 Recombinant expression,purification and analysis of alginate lyase YMA-1
2.3 海藻酸裂解酶YMA-1的酶学性质
2.3.1 海藻酸裂解酶YMA-1酶催化的最适pH,最适温度及热稳定性 海藻酸裂解酶YMA-1酶在不同pH缓存体系(pH 5.0-10.0)中催化活性如图3-A所示,重组酶在pH 7.0-9.0条件下催化活性较高,最高活性出现在pH 9.0,活性达到4.7×103U/mg。在不同温度(10-60℃)下测定了重组酶YMA-1的活性,YMA-1表现出嗜热酶催化特性,在55℃时比活力最高,为1.3×104U/mg,10℃ 催化活性仍具有最大活性的31%(图3-B)。为了分析YMA-1的热动力学稳定性,使用了差示扫描量热法(DSC)测定了重组酶YMA-1熔融温度Tm值,即在该温度下有50%重组酶去折叠,YMA-1的Tm值为37℃(图3-C)。
2.3.2 金属离子对海藻酸裂解酶YMA-1酶活性影响 金属离子对酶常有着激活或抑制作用,为了分析各种金属离子对海藻酸裂解酶YMA-1酶催化的影响,不同金属离子与酶孵育后,测定酶催化活性。结果如图3-D所示,值得注意的是Cu2+离子对YMA-1酶活性有显著促进作用,Ni2+对YMA-1酶活性表现出一定抑制作用,其他金属离子对该酶活性无较大影响。
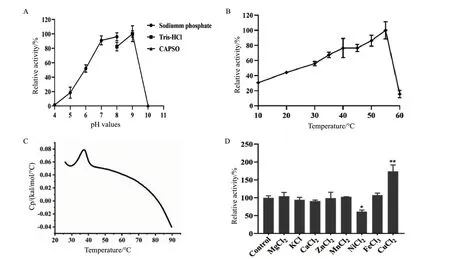
图3 海藻酸裂解酶YMA-1在不同pH、温度和金属离子条件下活性分析Fig.3 Activities of alginate lyase YMA-1 under different pH,temperature and metal ions
2.3.3 海藻酸裂解酶YMA-1的底物偏好性 为了分析海藻酸裂解酶YMA-1对不同底物的偏好性,测定了酶对不同结构的底物催化活性。如图4-B所示,该酶在37℃,pH 9.0条件下,对海藻酸钠、PolyM和PolyG的催化比活力分别为(5 201.21±86.46)U/mg、(6 399.73±253.12)U/mg和(3 751.68±116.25)U/mg。YMA-1对不同底物酶活力Poly M>海藻酸钠> Poly G;对3种不同结构的底物均具有高催化活性,表明该酶是一种双功能海藻酸裂解酶。双功能酶的宽底物谱,将利于YMA-1在制备褐藻寡糖中应用。

图4 海藻酸裂解酶YMA-1的底物偏好性分析Fig.4 Substrate preference of alginate lyase YMA-1
2.3.4 海藻酸裂解酶YMA-1的催化动力学 为了分析使用海藻酸裂解酶YMA-1的催化效率及底物亲和力,通过 Michaelis-Menten方程计算酶催化动力学参数kcat和Km,重组酶YMA-1催化海藻酸钠的米氏常数Km为0.6 mg/mL,kcat为5 000 s-1(图5)。

图5 海藻酸裂解酶YMA-1催化酶动力学米氏图Fig.5 Michaelis-Menten kinetics of alginate lyase YMA-1
2.4 海藻酸裂解酶YMA-1降解产物的质谱分析
高效液相色谱(HPLC)结果(图6-A)显示,海藻酸裂解酶YMA-1催化海藻酸降解获得4种产物保留时间分别为3.92 min,4.04 min,4.13 min和4.23 min。使用负离子电喷雾质谱(ESI-MS)鉴定降解产物分子量。ESI-MS证实这4种催化降解最终产物分别为不饱和二糖(ΔDP2)([M-H]-=351.0)、不饱和三糖(ΔDP3)([M-H]-=527.09)、不饱和四糖(ΔDP4)([M-H]-=703.12)和不饱和五糖(ΔDP5)([M-H]-=879.15)(图6-B)。LC-MS分 析 确 认 了YMA-1降解海藻酸钠主要产物为不饱和三糖和四糖,不能产生单糖,为典型的内切型海藻酸裂解酶。
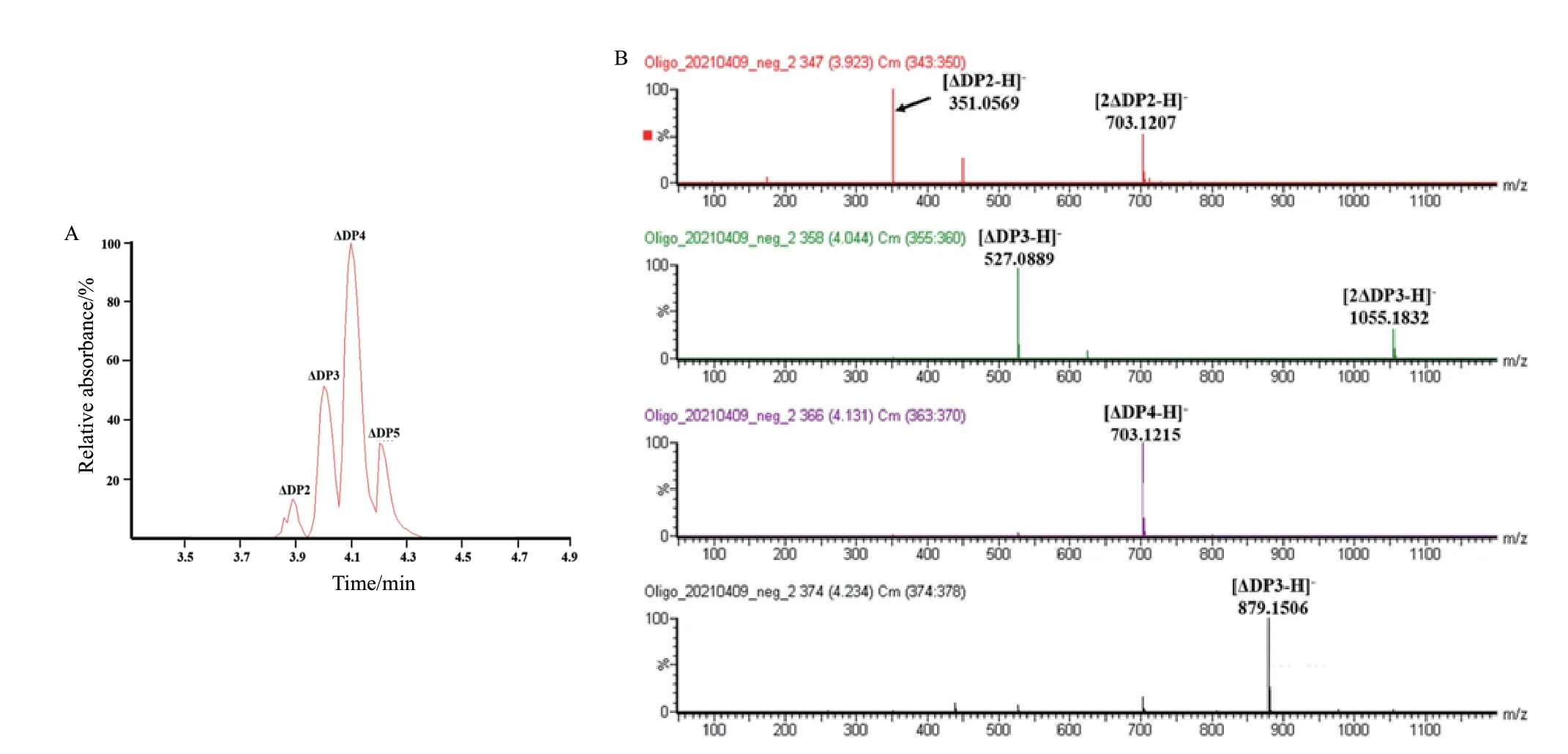
图6 海藻酸裂解酶YMA-1催化海藻酸钠降解的寡糖产物分析Fig.6 LC-MS analysis of the oligosaccharide products from degrading sodium alginates by YMA-1 catalysis
3 讨论
本研究表达并鉴定了PL-7家族海藻酸裂解酶的一个新成员YMA-1。PL-7家族海藻酸降解酶含有3个高度保守区域:(R/E)(S/T/N)EL,Q(I/V)H,YFKAG(V/I)YNQ。保守区域形成了jelly-roll β-sandwich空腔区域,具有识别、结合底物和催化功能[17]。Zhu等[4]提出Q(I/V)H结构域异亮氨酸(I)或缬氨酸(V)对于海藻酸裂解酶底物偏好性具有决定作用。保守区域为QVH结构域的海藻酸裂解酶偏好降解Poly M底物,而保守区域为QIH结构域的海藻酸裂解偏好降解Poly MG或Poly G底物。通过重组酶YMA-1与PL-7家族8个结构已知的海藻酸裂解酶进行序列比对分析,证明该酶具有3个高度保守的区域RSELRE、YFKAGNYFQ和QIH,以及4个典型的催化残基Arg121、Gln168、His170和Tyr284,具有PL-7家族海藻酸裂解酶典型序列结构特征。海藻酸裂解酶YMA-1对不同底物的偏好性顺序由高到低依次为PolyM,海藻酸钠,PolyG。在37℃ 时催化3种不同底物比活力均在3 500 U/mg以上,是PL-7家族少见的高效双功能型海藻酸裂解酶。
天然酶的催化及生化特性多与其来源生物体的生存环境密切相关[6]。例如,深海Agarivoranssp.JAM的冷适应性海藻酸裂解酶A1m在pH 9.0-10.0和30℃时活性最高[18]。PL-7家族海藻酸裂解酶NitAly最适催化反应条件为pH 6.0和70℃。在pH值为5-6的条件下孵育8 h,酶活力保留80%,适用于酸预处理工业化生产海藻酸低聚糖[19]。本研究表征来自浅海热液系统耐热菌Yeosuana marinasp.JLT21的YMA-1催化海藻酸钠降解最适反应条件分别为pH 7.0-9.0和55℃。重组YMA-1酶的Tm值为37℃。在最适反应条件下,重组酶在含100 mmol/L NaCl 缓冲液中降解海藻酸钠比活力为1.3×104U/mg,这些酶学特性与其来源菌株Yeosuana marinasp. 的耐盐、耐热生存环境相关。金属离子Cu2+对重组酶降解海藻酸钠活性有显著促进作用,除Ni2+外,其他金属离子对该酶活性无显著影响,这表明重组酶YMA-1具有金属离子耐受性,能在复杂的工业化环境中降解海藻酸钠。
海藻酸内切酶和外切酶的协同使用有望建立高效生产功能性海藻酸低聚糖和生物乙醇前体的工艺。Li等[20]报道两种内切型海藻酸裂解酶OalC6和OalC17的协同催化降解海藻酸钠和海藻酸低聚物效率明显要高于单一酶。Lu等[16]使用分离于Photobacteriumsp. FC615的内切型海藻酸裂解酶AlyPB1和外切性海藻酸裂解AlyPB2协同作用于海藻酸钠,使得海藻酸低聚糖降解为不饱和单糖效率提高近7倍。LC-MS分析结果表明重组酶YMA-1是一种内切双功能型酶,降解海藻酸钠终产物多为不饱和海藻酸三糖和四糖,底物谱广阔,可应用于工业化生产功能性海藻低聚糖,或与外切型海藻酸裂解酶联合使用,提高单糖得率,用于生物能源开发。
4 结论
本研究从浅海热液系统耐热菌Yeosuana marinasp. JLT21中表征内切型海藻酸裂解酶YMA-1。重组YMA-1酶表现出双功能内切型海藻酸裂解酶活性,对海藻酸钠、PolyM和PolyG均具有很高的活性,降解海藻酸钠终产物主要为不饱和三糖和四糖。YMA-1酶催化最适温度为55℃,同时在低温度下也表现出较高的活性。