油酸促进粗糙脉孢菌发酵高产番茄红素的条件优化
王瑞琪,陈 钢,熊文能,朱宏林,简素平
(南昌大学 食品科学与技术国家重点实验室,南昌 330047)
番茄红素是一种亲脂性类胡萝卜素,广泛存在于番茄、西瓜、胡萝卜等红色果蔬中[1]。番茄红素属于高不饱和碳氢化合物[2],含有11个共轭双键和2个非共轭双键,这种独特的共轭多烯结构决定其具有极强的抗氧化、抗炎症[3]、活化免疫系统[4]等生物活性。在人类营养和疾病预防方面的研究发现,膳食补充番茄红素可有效预防和改善心血管疾病[5]、2型糖尿病[6]和多种癌症[7]的发生和发展。因此,番茄红素在食品、营养保健、医药等行业具有很高的研究和应用价值。
微生物发酵法具有工艺操作简便、不受季节限制等优势,通过此法生产番茄红素已受到高度关注。其中,粗糙脉孢菌对营养条件需求低,可在多种类型的培养基中生长,并通过甲羟戊酸途径合成黄-橙类胡萝卜素[8]。此外,迄今为止,在粗糙脉孢菌中尚未检测到有害物质的生成,这有利于其在学术及工业领域中的更多应用[9]。因此,粗糙脉孢菌可作为生产番茄红素的潜在菌株。据报道,在培养基中添加脂类物质(如植物油、脂肪酸)可有效促进类胡萝卜素的积累[10],尤其以油酸、亚油酸、亚麻酸等脂肪酸的促进作用更为显著[11]。Vereschagina等[12]以富含亚麻酸植物油的培养基对三孢布拉氏霉菌进行发酵培养,番茄红素的产量显著增加。Hu等[13]报道,培养基中添加花生四烯酸作为代谢刺激物可诱导与类胡萝卜素合成相关基因转录水平的提高,从而提高β-胡萝卜素的产量。外源脂质的添加可影响菌体生长、底物同化及胞内的代谢变化等[14]。菌体吸收脂肪酸后经β-氧化可生成大量的乙酰辅酶A和能量,不仅有利于菌体生物量的积累,亦可为甲羟戊酸途径合成番茄红素提供更多的前体物质及能量[15],进而促进番茄红素的合成。
本研究以经济实惠的油酸为外源脂肪酸,探究其对粗糙脉孢菌发酵产番茄红素的影响,采用响应面优化法得到最佳发酵培养条件,并进一步探究油酸对番茄红素合成相关酶的影响,为脂类物质促进番茄红素生产的研究与应用提供新的思路和理论支持。
1 材料与方法
1.1 实验材料
1.1.1 菌种
粗糙脉孢菌(Neurosporacrassa)3.1608,购于中国普通微生物菌种保藏管理中心。
1.1.2 培养基
PDA培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂15 g/L,自然pH。
发酵培养基:葡萄糖30 g/L,蛋白胨20 g/L,NaNO33 g/L,KCl 0.5 g/L,MgSO40.5 g/L,FeSO40.01 g/L,K2HPO41 g/L,自然pH。油酸经0.22 μm微孔滤膜过滤除菌,在发酵起始添加,其余培养基成分于121℃灭菌20 min。
1.1.3 主要试剂
油酸(分析纯),阿拉丁试剂(上海)有限公司;乙酸乙酯(分析纯),天津市大茂化学试剂厂;丙酮(分析纯),西陇科学股份有限公司;乙腈、二氯甲烷(色谱纯),德国Merck公司;番茄红素标准品(纯度≥98%),北京Solarbio公司;乙酰辅酶A ELISA试剂盒、HMG-CoA合成酶(3-hydroxy-3-methyl glutaryl coenzyme A synthase,HMGS)ELISA试剂盒、HMG-CoA还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR)ELISA试剂盒、香叶基香叶基焦磷酸合酶(geranylgeranyl diphosphate synthase,GGPPS)ELISA试剂盒,江苏科特生物科技有限公司。
1.1.4 仪器与设备
SW-CJ-2D双人单面垂直净化工作台,上海尚道仪器制造有限公司;TS-1210B恒温摇床,苏州市国飞实验室仪器有限公司;Agilent 1100型高效液相色谱仪,美国Agilent公司;MK3型多功能酶标仪,芬兰Thermo公司。
1.2 实验方法
1.2.1 菌种活化
取150 μL甘油管保藏的菌种涂布接种于PDA培养基中,30℃活化培养72 h,全程光照。
1.2.2 发酵培养
挑取活化好的菌种孢子至30 mL液体发酵培养基中混匀制得孢子悬浮液。取2.5 mL(接种量5%)接种至50 mL发酵培养基中,于一定振荡速率、一定温度条件下摇瓶振荡培养19 h,继续在一定温度下静置培养87 h,全程光照。以不含油酸的培养基为空白对照组,以添加油酸的培养基为油酸组。
1.2.3 生物量及生长曲线的测定
发酵结束后,经8 000 r/min、5 min离心去除发酵液,蒸馏水洗涤3次并收集菌体,于45℃鼓风干燥箱中烘干48 h,称量得到的干燥菌体质量即为生物量。以开始静置培养时间(19 h)为首个记录点,然后每间隔12 h收集并称量记录生物量。以培养时间为横坐标,生物量为纵坐标,绘制生长曲线。
1.2.4 番茄红素产量的测定
1.2.4.1 番茄红素的提取
待发酵结束后,在处理得到的干燥菌体中(按1.2.3方法)加入适量石英砂以辅助研磨至粉末状,加入25 mL乙酸乙酯-丙酮溶液(体积比2∶3)为萃取溶剂,于40 kHz、25℃条件下超声25 min,再经33℃水浴锅中暗室提取2.5 h,离心(8 000 r/min,10 min)后收集上清的色素浸提液并适当稀释,通过0.22 μm微孔滤膜过滤后,经高效液相色谱进行测定。
1.2.4.2 高效液相色谱条件
Agilent Eclipse Plus C18色谱柱(150 mm×4.6 mm,3.5 μm);流动相为乙腈-二氯甲烷溶液(体积比3∶2);柱温28℃;流速1 mL/min;进样量10 μL;运行时间10 min;检测波长472 nm。
1.2.4.3 番茄红素标准曲线的绘制
100 μg/mL番茄红素标准品母液的配制:精确称量1 mg番茄红素标准品,用乙酸乙酯-丙酮溶液(体积比2∶3)定容至10 mL。再经稀释后得到质量浓度分别为80、60、40、20、0 μg/mL的标准溶液,于1.2.4.2色谱条件下进行测定,以番茄红素质量浓度(x)为横坐标,峰面积(y)为纵坐标,得到番茄红素标准曲线回归方程:y=24.246x+51.938,R2=0.998 8。
1.2.4.4 番茄红素产量的计算
根据公式(1)计算番茄红素产量(Y)。
Y=(y-51.938)/24.246×(V1/V2)
(1)
式中:y为样品的番茄红素峰面积;V1为样品浸提稀释液总体积;V2为发酵液体积。
1.2.5 乙酰辅酶A及番茄红素合成相关酶质量浓度的测定
待发酵结束后,离心(8 000 r/min,5 min)去除发酵液,经磷酸盐缓冲液(pH 7.4)洗涤3次后收集菌体,经真空冷冻干燥48 h得到干燥菌体。分别精确称量50 mg干燥菌体,根据ELISA试剂盒的方法分别测定乙酰辅酶A和番茄红素合成相关酶(HMGS、HMGR、GGPPS)的OD值。使用试剂盒中所提供的标准品稀释至不同质量浓度测定其OD值,以标准品的质量浓度为横坐标,OD值为纵坐标绘制标准曲线。根据标准曲线及样品的OD值计算各样品乙酰辅酶A和番茄红素合成相关酶的质量浓度。每组实验设置5组平行。
1.2.6 数据分析
除特别说明,所有实验均设置3组平行,数据结果以“平均值±标准差”表示。应用SPSS 26.0软件对数据进行单因素ANOVA分析,P<0.05时表明具有显著差异。采用Excel 2019作图,并通过Design-Expert 8.0.6软件进行响应面实验设计与分析。
2 结果与分析
2.1 孢子浓度对菌体生物量及番茄红素产量的影响
接种孢子浓度是影响微生物生长及合成次级代谢产物的关键因素[16]。将孢子悬浮液浓度分别调整至2.5×105、5.0×105、1.0×106、2.0×106、4.0×106个/mL,接种至发酵培养基中。采用不含油酸的发酵培养基,在振荡速率100 r/min、振荡培养温度及静置培养温度均为30℃条件下,考察孢子浓度对菌体生物量及番茄红素产量的影响,结果见图1。

图1 孢子浓度对菌体生物量及番茄红素产量的影响
由图1可知,在实验浓度范围内,随着孢子浓度的增大,番茄红素产量及菌体生物量均表现为先上升后下降的变化趋势,分别在孢子浓度为1.0×106、2.0×106个/mL时达到最大。当孢子浓度较低时,菌体生长缓慢,不能保证足够的菌体量使其代谢产物产量最大化[17]。当孢子浓度较高时,番茄红素产量下降。这是由于粗糙脉孢菌生产番茄红素受氧气影响[18],在提高接种浓度而含氧量不变的条件下,培养基黏度增加引起溶氧不足;同时在发酵后期,处于衰老期的菌体细胞可能会积累一些自身抑制物质,影响番茄红素的合成[19]。因此,最佳孢子浓度为1.0×106个/mL,采用此浓度进行后续实验。
2.2 生长曲线测定
图2为振荡速率100 r/min、振荡培养温度及静置培养温度均为30℃条件下,空白对照组及添加0.6 g/L油酸组的菌体生长曲线,反映了粗糙脉孢菌在一定环境条件下的群体生长规律[20]。

图2 粗糙脉孢菌在添加或不添加油酸培养基中的生长曲线
由图2可知,在整个生长周期内,两组菌体生长变化趋势一致,大约在31 h进入稳定生长期,且油酸组的菌体生物量显著高于空白对照组。可见,当以含有油酸的培养基对粗糙脉孢菌进行发酵培养时,其生长活性稳定,促进了菌体生物量的增加。因此,进一步探究培养基中添加油酸对粗糙脉孢菌发酵产番茄红素的影响。
2.3 单因素实验
2.3.1 油酸质量浓度对菌体生物量及番茄红素产量的影响
在振荡速率100 r/min、振荡培养温度及静置培养温度均为30℃条件下,考察油酸质量浓度对菌体生物量及番茄红素产量的影响,结果见图3。
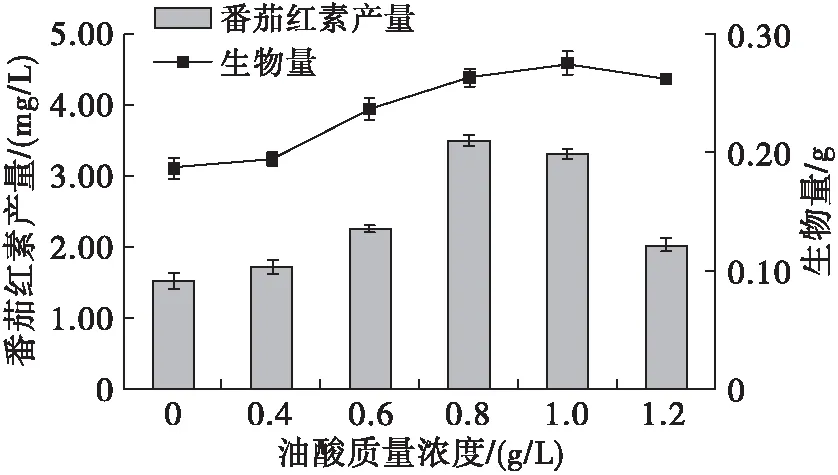
图3 油酸质量浓度对菌体生物量及番茄红素产量的影响
由图3可知,当油酸质量浓度分别为0.8、1.0 g/L时,番茄红素产量和菌体生物量达到最大,其番茄红素产量是空白对照组(油酸质量浓度为0 g/L)的2.31倍。当以含有油酸的培养基对粗糙脉孢菌进行发酵培养时,油酸经β-氧化分解生成大量的乙酰辅酶A和能量,不仅促进了菌体的生长,同时可供利用更多的乙酰辅酶A经甲羟戊酸途径合成番茄红素,有利于番茄红素的积累。当油酸质量浓度过高时,由于不饱和脂肪酸的自动氧化作用会产生对菌体自身不利的氧脂质和短链醛[21],进而影响了粗糙脉孢菌的生长及番茄红素的合成。该结果与Hu等[13]的报道一致,在添加0.4 g/L花生四烯酸的培养基中,三孢布拉氏霉菌中β-胡萝卜素的产量达到最大,而花生四烯酸质量浓度继续增加时其产量显著下降。因此,选择油酸质量浓度为0.8 g/L用于响应面实验设计。
2.3.2 振荡速率对菌体生物量及番茄红素产量的影响
本文以二阶段培养方式对粗糙脉孢菌进行发酵培养,即先经过一段时间的振荡培养再继续静置培养。第一阶段振荡培养是积累生物量,此时菌株主要以菌丝球的形态生长,较少产生分生孢子[22]。振荡速率直接影响培养液中的溶解氧及剪切力[23],对菌体初始生长过程具有重要意义,进而影响代谢产物的合成。在油酸质量浓度0.6 g/L、振荡培养温度及静置培养温度均为30℃条件下,考察振荡速率对菌体生物量及番茄红素产量的影响,结果见图4。

图4 振荡速率对菌体生物量及番茄红素产量的影响
由图4可知,菌体生物量随着振荡速率的增大而减小,在振荡速率为100 r/min时番茄红素产量最大。当振荡速率较低时,菌体所受剪切力较小,形成的菌丝球较大[24],有利于菌体生物量的积累;但可能使培养环境中氧气过多消耗,从而影响番茄红素的合成。当振荡速率较高时,会对菌体产生一定的剪切作用,加快菌体自溶,不利于菌体生物量的积累,影响番茄红素的合成[25]。因此,选择振荡速率为100 r/min用于响应面实验设计。
2.3.3 振荡培养温度对菌体生物量及番茄红素产量的影响
适宜的温度有益于微生物的生长和代谢活动,对代谢产物的合成具有重要影响[26]。在油酸质量浓度0.6 g/L、振荡速率100 r/min、静置培养温度30℃条件下,考察振荡培养温度对菌体生物量及番茄红素产量的影响,结果见图5。
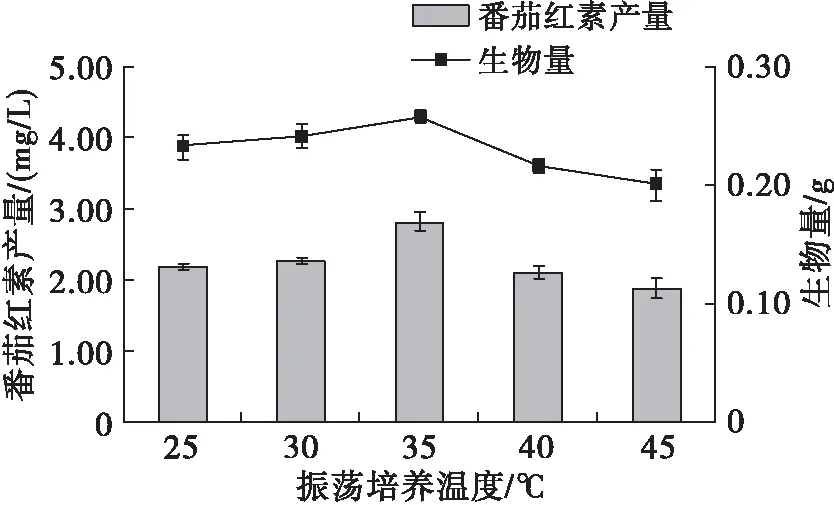
图5 振荡培养温度对菌体生物量及番茄红素产量的影响
由图5可知,当振荡培养温度为35℃时,菌体生物量和番茄红素产量均达到最大。振荡培养阶段是菌体快速积累生物量的过程,当温度低于35℃时,减弱了菌体对环境中营养物质的吸收速率[27],不利于生物量的积累,番茄红素的产量亦较低。当温度较高时,菌体细胞内整体酶的代谢活动受到影响[28],生物量下降,进而影响番茄红素的合成。因此,选择振荡培养温度为35℃用于响应面实验设计。
2.3.4 静置培养温度对番茄红素产量的影响
在油酸质量浓度0.6 g/L、振荡速率100 r/min、振荡培养温度30℃条件下,考察静置培养温度对菌体生物量及番茄红素产量的影响,结果见图6。

图6 静置培养温度对菌体生物量及番茄红素产量的影响
由图6可知,在实验温度范围内,菌体生物量和番茄红素产量均呈先升高后下降的变化趋势。当静置培养温度为30℃时,番茄红素产量和生物量均达到最大。经分析可知,当静置培养温度升高至35℃时,番茄红素产量及菌体生物量与空白对照组无显著差异(P>0.05);当静置培养温度高于35℃时,番茄红素产量及菌体生物量均低于空白对照组。静置培养阶段主要诱导粗糙脉孢菌生长气生菌丝进而产生孢子;同时,此阶段培养时间较长,当温度较高或较低时,不利于粗糙脉孢菌气生菌丝及孢子的生长,影响菌体生物量和番茄红素的合成。另一方面,在较高温度下可能使番茄红素合成相关酶的活性降低甚至失活,亦对番茄红素的合成造成影响。因此,30℃是粗糙脉孢菌气生菌丝及孢子的最适生长温度。综合考虑,恒定静置培养温度为30℃进行后续实验。
2.4 响应面优化实验
2.4.1 响应面优化实验设计及结果
根据单因素实验结果,固定静置培养温度为30℃,以油酸质量浓度(A)、振荡速率(B)及振荡培养温度(C)为考察因素,以番茄红素产量(Y)为响应值,依据Box-Behnken设计原理进行三因素三水平响应面优化实验。响应面实验因素及水平见表1,响应面实验设计及结果见表2。

表1 响应面实验因素及水平
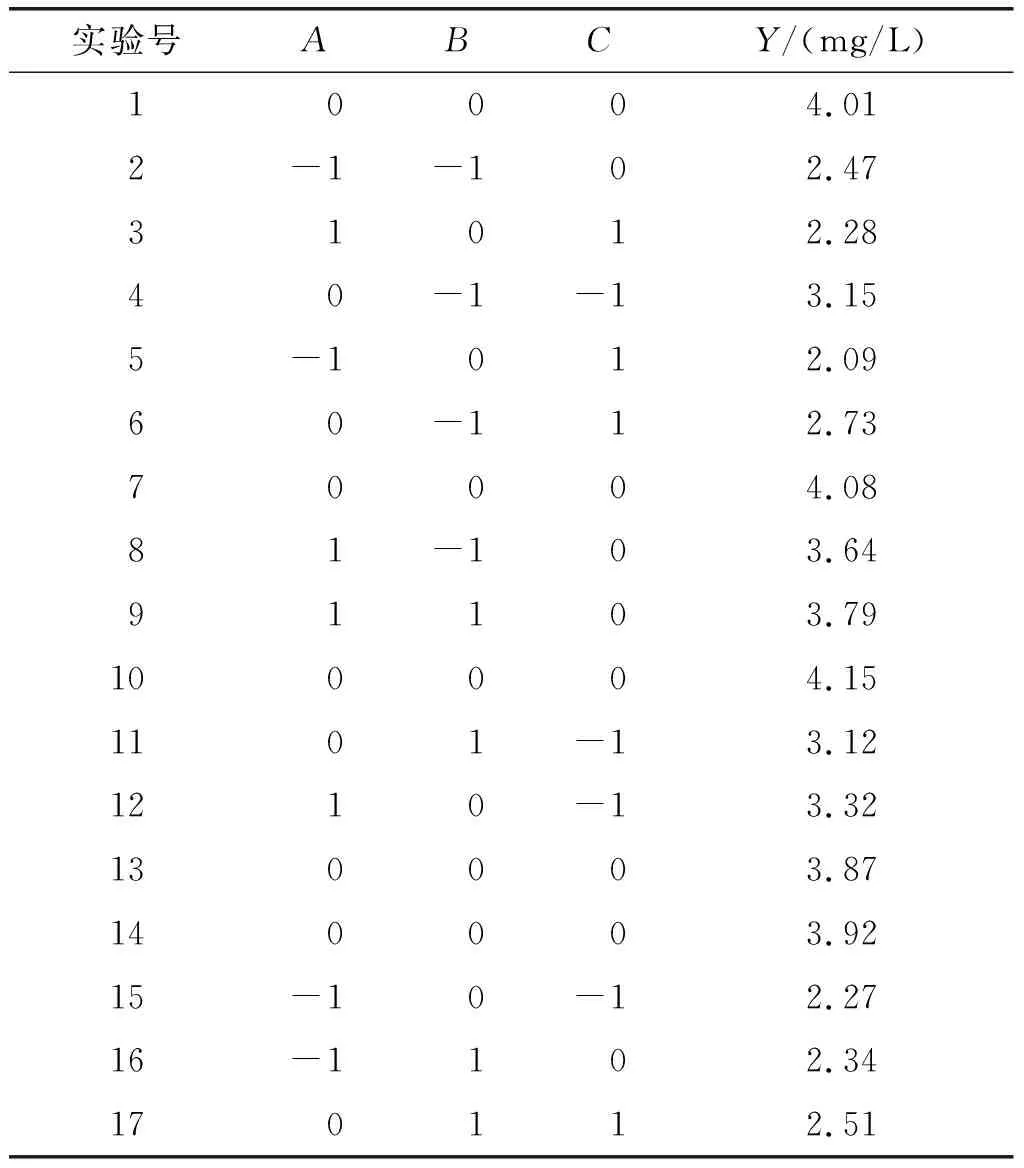
表2 响应面实验设计及结果
2.4.2 模型的建立及方差分析
通过Design-Expert 8.0.6软件对表2中结果进行多元回归拟合,得到以番茄红素产量(Y)为响应值的二次多项式回归方程:Y=4.01+0.48A-0.029B-0.28C+0.07AB-0.22AC-0.048BC-0.67A2-0.28B2-0.85C2。
对回归方程进行方差分析,结果如表3所示。

表3 回归模型方差分析
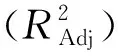
2.4.3 粗糙脉孢菌发酵产番茄红素最佳培养条件的确定
根据优化模型可知,当油酸质量浓度为0.88 g/L、振荡速率为100.23 r/min、振荡培养温度为33.92℃时,粗糙脉孢菌的番茄红素产量达到最高值,预测值为4.13 mg/L。对优化后的参数进行验证实验,考虑到实际操作的方便性,将培养条件修正为油酸质量浓度0.90 g/L、振荡速率100 r/min、振荡培养温度34℃,经3次平行实验后得到番茄红素产量为4.21 mg/L,与模型预测结果相近,此时番茄红素产量是空白对照组的2.77倍。
2.5 油酸对粗糙脉孢菌内乙酰辅酶A及番茄红素合成相关酶的影响
按研究确定的最佳发酵培养条件,以不含油酸的培养基为空白对照组,以添加质量浓度为0.8 g/L油酸的培养基为油酸组,测定两组菌体中乙酰辅酶A及番茄红素合成相关酶的变化。
2.5.1 对乙酰辅酶A的影响(见图7)

注:不同小写字母表示差异显著(P<0.05)。下同
由图7可知,以含油酸的培养基对粗糙脉孢菌进行发酵培养时,其乙酰辅酶A的水平显著高于空白对照组,提高了37.64%(P<0.05)。β-氧化是脂肪酸分解代谢生成乙酰辅酶A的重要步骤,并且乙酰辅酶A可进一步作为合成番茄红素的起始物质。因此,粗糙脉孢菌摄取油酸后通过分解可获得更高含量的乙酰辅酶A,有利于更多的前体物质进入甲羟戊酸途径合成番茄红素。
2.5.2 对番茄红素合成相关酶的影响(见图8)
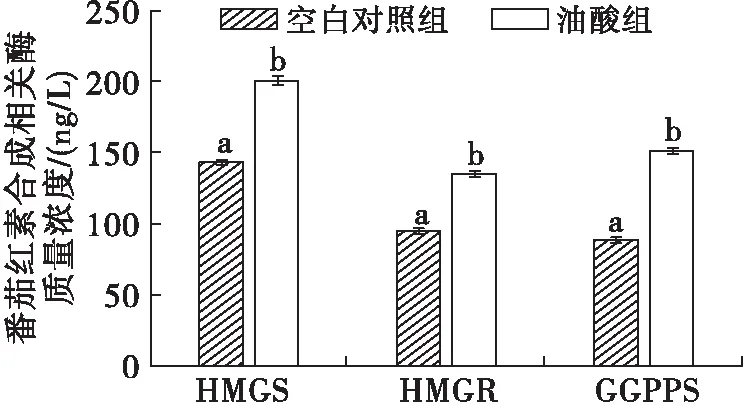
图8 培养基中添加油酸对HMGS、HMGR和GGPPS水平的影响
由图8可知,空白对照组中HMGS、HMGR及GGPPS的水平分别为142.40、94.83 ng/L和88.81 ng/L,油酸组中HMGS、HMGR及GGPPS的水平分别提高至200.71、134.84 ng/L和151.28 ng/L,均显著高于对照组(P<0.05)。
图9为粗糙脉孢菌经甲羟戊酸途径合成番茄红素的代谢路径。
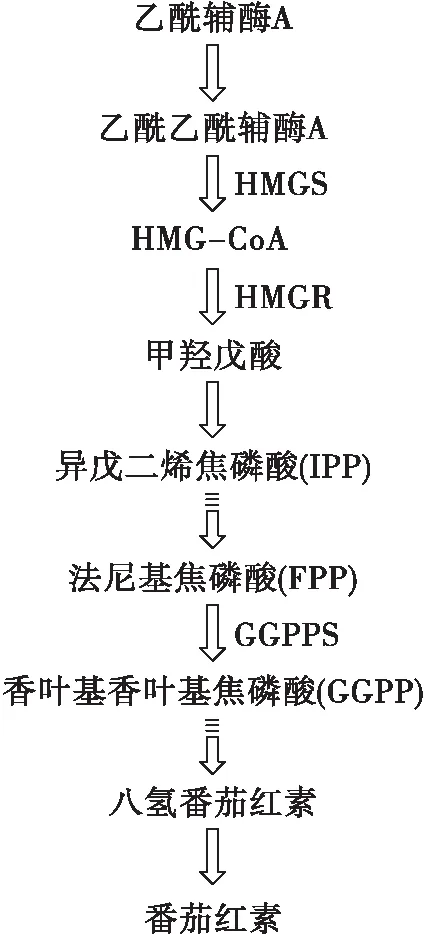
图9 粗糙脉孢菌中番茄红素的生物合成途径
由图9可以看出,在整个过程中,HMGS、HMGR及GGPPS对番茄红素的合成具有重要影响。HMGS催化乙酰乙酰辅酶A合成HMG-CoA,其是番茄红素合成的重要前体物质;HMGR是番茄红素合成途径中的第一个限速酶,催化HMG-CoA不可逆地生成甲羟戊酸[29];GGPPS控制着另一个重要中间代谢物质的生成,诱导加快FPP向GGPP的转换,促进GGPP的合成[30]。因此,油酸组中上述酶水平的上调有利于调节更多的乙酰辅酶A用于合成番茄红素,提高番茄红素产量。这与先前的报道相似,花生四烯酸通过诱导HMGR的表达促进了类胡萝卜素的积累[31]。未来可进一步探究油酸促进番茄红素合成的机理。
3 结 论
当培养基中添加油酸后,可显著提高粗糙脉孢菌的番茄红素产量。通过响应面法优化得到最佳发酵培养条件为油酸质量浓度0.90 g/L、振荡速率100 r/min、振荡培养温度34℃、静置培养温度30℃,在此条件下粗糙脉孢菌的番茄红素产量为4.21 mg/L,是空白对照组的2.77倍。在培养基中添加油酸不仅有利于粗糙脉孢菌生物量的积累,胞内乙酰辅酶A和番茄红素合成相关酶(HMGS、HMGR、GGPPS)的水平均显著增加,可供利用更多的前体物质朝向甲羟戊酸合成途径,有利于番茄红素的合成。

