有限元分析融合器高度与位置对TLIF术后节段性腰椎前凸和融合器下沉的影响
尚志恒,吴威,李聪,王文静,涂广宝
(开封市人民医院骨科三病区,河南开封 475000)
经椎间孔腰椎间融合术(transforaminal lumbar interbody fusion,TLIF)是治疗腰椎间盘突出、椎管狭窄和/或腰椎滑脱等腰椎退行性病变的经典外科手术,可获得理想的减压效果,且对于恢复椎间隙高度和腰椎生理曲度、重建脊柱稳定性均有明显益处[1-2]。但TLIF术后融合器下沉较常见,由于融合器尾端沉入椎体,导致椎间隙高度丢失甚至对节段性腰椎前凸(segmental lumbar lordosis,SLL)造成明显影响。有研究指出,融合器的形状、基质密度和材料组成均是影响其下沉的主要因素之一[3];Zhou等[4]分析认为,不规则的终板形态将明显增加融合器下沉的风险。目前关于融合器下沉的相关因素研究较多,但关于TLIF术中融合器高度和位置对其术后下沉的影响,罕有文献报道。为此,本研究通过生物力学三维有限元分析,试图对比TLIF术中融合器在不同高度和不同放置方式情况下,对骨质量正常和骨质疏松患者骨-融合器交界处的应力和SLL的影响,为临床提供参考依据。
1 材料与方法
1.1 建立有限元模型
基于学者们既往提出的脊柱有限元模型相关经验[5-6],本研究建立了L4-5节段三维有限元模型,并参照Agrawal和Resnick[7]、Gum等[8]的经验,进行了修改和完善,对椎间隙准备、植入融合器及后方固定等的TLIF手术过程进行生物力学模拟。
该模型的图像由一位50岁健康男性的CT扫描(0.6 mm层厚)所得,其既往无腰背部外伤史[5];该模型包括椎体(松质骨和皮质骨)、椎弓、椎间盘、小关节和7条韧带组成,即前纵韧带(anterior longitudinal ligament,ALL)、后纵韧带(posterior longitudinal ligament,PLL)、黄韧带(ligamentum flavum,LF)、关节囊韧带(capsular ligaments,CL)、横韧带(intertransverse ligament,ITL)、棘间韧带(interspinous ligament,ISL)和棘上韧带(supraspinous ligament,SSL),见图1a。每个椎体由四面体实体网格划分,代表松质骨被一层皮质骨包围,皮质骨厚度在五个区域内均有变化:椎体终板和前壁(厚度0.4 mm)、椎弓根上部(2.0 mm)、椎弓根下部(1.87 mm)、后突(1.0 mm)和椎弓根螺钉拧入区(0.8 mm)(Silva等[9],Bianco等[10]),见图1b)。纤维环(annulus fibrosus,AF)模型采用5层同心层的八面体网格划分,由弹簧单元增强,模拟胶原纤维在±35°方向的取向。髓核(nucleus pulposus,NP)用八面体网格划分。除CL用三面体网格表示外,其余韧带均采用四面体网格化。为了平衡这项研究的计算成本和分析精度,笔者进行了网格收敛,以确定合适的单元大小(图1a-b)。
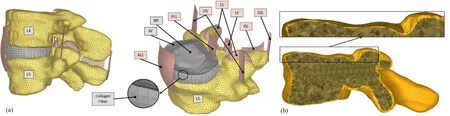
图1 L4-5节段的三维有限元模型图
采用非线性材料特性模拟生理载荷条件下的脊柱单元的力学特征。皮质骨和松质骨均由均质各向同性材料建模,符合Johnson-Cook塑性材料模型参数(Wagnac等[11])。NP和AP被建模为Mooney-Rivlin超弹性材料,而胶原纤维被合并为只受拉伸力的一维弹簧单元。脊柱韧带的非线性行为用广义的Maxwell-Kelvin-Voigt模型参数建模,并基于最大拉伸应变水平并入了破坏标准(Wagnac等[11])。各部位的材料属性均由上述相关文献中的数值结果来定义。通过降低皮质骨的杨氏模量(33%)和松质骨的杨氏模量(66%),来塑造骨质疏松骨的材料特性(Salvatore等[12])。
为了模拟关节突关节,使用了初始间隙为0.5 mm的通用接触,两个关节之间的库仑摩擦系数为0.2。在韧带和其附着处的皮质骨之间建立捆绑接触模型。笔者调整和校准了上述建模元件的生物力学性能,使得功能载荷模拟的载荷-位移结果与Heuer等[13]的身体腰椎上的实验结果一致。将完整模型在模拟8 Nm纯弯曲下的屈伸、侧弯和轴向旋转的ROMs,与文献报道中的人体ROMs进行比较(Dahl等[14];Jaramillo等[15]),验证了该有限元模型的有效性。为了支持TLIF中存在融合器沉降风险的使用环境条件,笔者建立了有限元模型的可信度:在模型中的设定范围内进行输入检验,以确保其结果仍然可用于量化预测不确定性的使用环境。
1.2 TLIF手术的模拟
TLIF手术是通过单侧入路做椎间盘部分切除,以去除AF和NP左后侧部对应的元素来模拟TLIF的手术过程。通过移除与关节突关节相对应的元素,来模拟小关节切除,以虚拟出一个用于椎间融合器插入的间隙(图2a)。将4枚椎弓根螺钉(长40 mm,直径6.5 mm)建模为刚体,外表面用三面体单元划分网格。根据经典的椎弓根螺钉置入技术,将其与相应的椎体对齐(Agarwal等[7];Bianco等[10])。为了确定合适的单元尺寸,进行网格收敛研究:首先,终板-融合器界面斜向不对称置入高度为10 mm规格的融合器,测试其不同尺寸的单元格大小(0.5-1.5 mm),直至骨-融合器界面的最大VonMises应力变化在5%以内。在螺钉与椎体模型之间执行Boolean运算,以移除皮质层与松质骨的核心模型元素(Bianco等[10])。同时,建立Columb摩擦系数为0.2的点对面接触模型,以表示骨-螺钉界面。
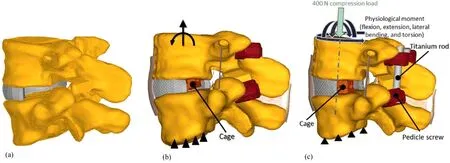
图2 TLIF手术模型
椎间融合器的模型基于临床常用的Cage设计(商品名:Capstone,美敦力),该模型长26 mm、宽10 mm,本次分别测试了8 mm和10 mm高度的两种规格Cage;每个规格Cage均测试斜向不对称放置和前位对称放置的两种植入位置(图3)。采用1.0 mm的4节点四面体单元进行Cage的网格化,并将其材料特性定义为聚醚醚酮(polyether ether ketone,PEEK),E=3.4 GPa、v=0.4(Faizan等[16])。Cage植入的模型以日常手术中的常规操作作为参考。首先,将Cage模型与L5的上终板对齐,并对其界面施加最小距离为0.5 mm、Columb摩擦系数为0.2的点-面接触。而后,在L4和L5之间施加撑开力,使椎间隙增加,Cage与终板的几何形状之间没有重叠。最后,在Cage与相邻终板间的点对面接触建模后,释放载荷(图2b)。
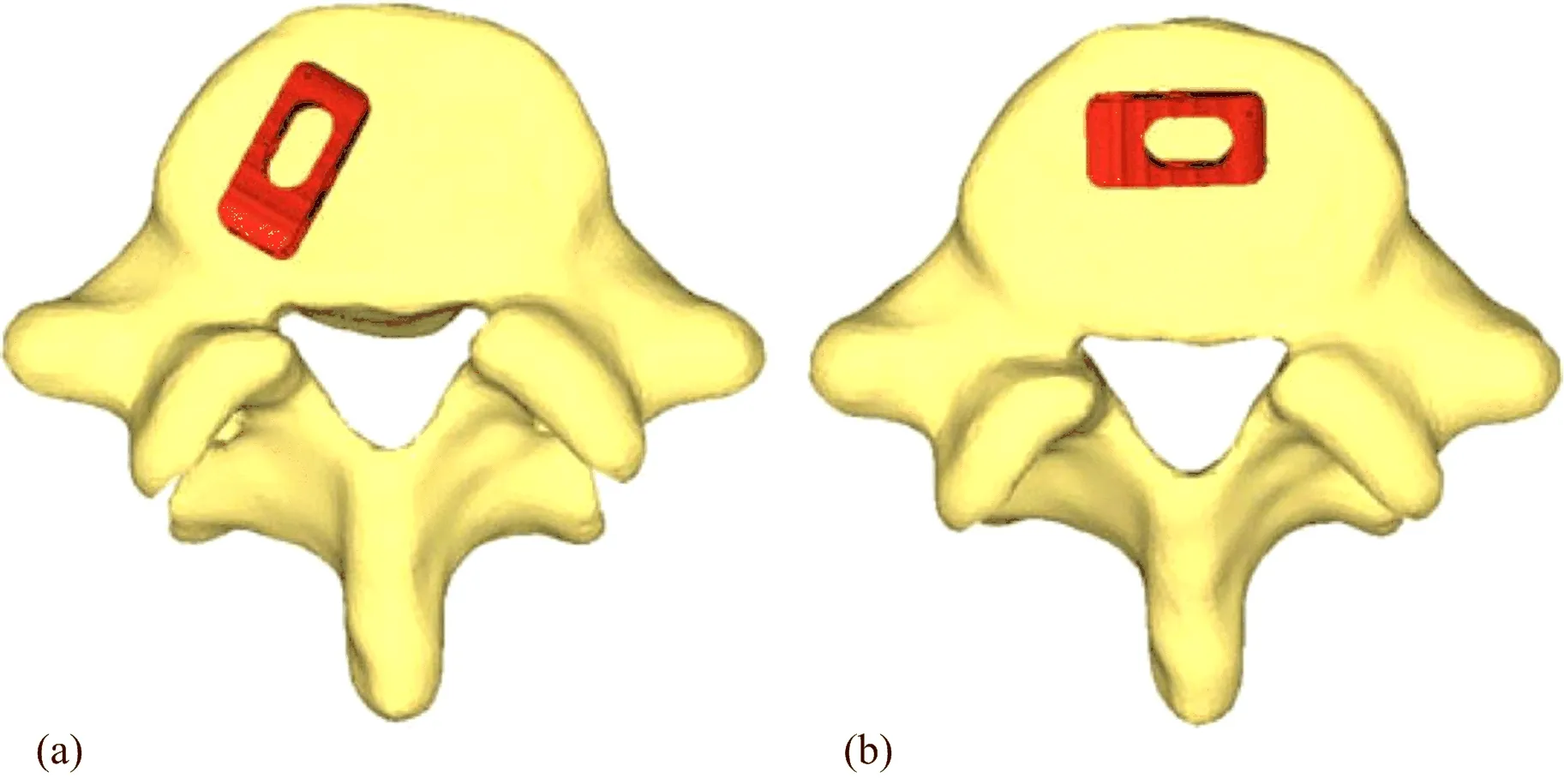
图3 Cage的不同放置位置
通过测量L4上终板和L5下终板之间的夹角,以评估Cage模拟植入前后的SLL。在模拟植入Cage后,将2根钛棒模型(4.5 mm)与螺钉尾部对齐,并进行两者之间的捆绑接触以模拟后路固定(图2c)。钛棒以0.5 mm的4节点四面体实体单元进行网格划分,钛合金的材料性能参照相关文献[16]进行修正(E=115 GPa、v=0.34)。将所得的有限元模型用于模拟生理载荷。将体重模拟为L4上节段400 N的垂直力,L5的下终板被固定在空间中。分别在3个解剖平面模拟10 Nm的功能载荷,分别模拟屈曲(flexion,Fe)、伸展(extension,Ex)、右侧弯(right lateral bending,RLB)、左侧弯(left lateral bending,LLB)、右轴旋转(right axial rotation,RAR)和左轴旋转(left axial rotation,LAR)。计算ROM和最大的VonMises应力作为椎间融合器下沉风险的量度。
1.3 分析软件
本研究所采用的三维有限元模型模拟过程,均是在准静态条件下使用RADIOSS v14.0有限元软件包运行处理。
2 结果
2.1 有限元模型验证
该L4-5节段有限元模型的屈曲、侧弯和轴向旋转ROM值分别为9.3°、7.6°和4.1°。将此数值与Dahl等[14]和Jaramillo等[15]的有限元模型进行比较,其ROM值均较为相近,提示本研究的有限元建模较合理。具体见图4。
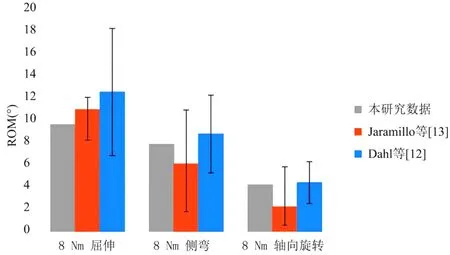
图4 本研究有限元模型与既往研究的模型参数比较
2.2 Cage高度、位置对SLL的影响
SLL:在模拟骨质正常的情况下,8 mm高度的Cage前对称放置和斜向不对称放置分别增加了0.9°和1.0°的SLL,10 mm高度的Cage分别增加了1.4°和1.7°的SLL。与骨质正常模型相比,骨质疏松模型的SLL增加值变化在1.2%以内。具体见表1。

表1 不同Cage高度和位置下的SLL增加值(°)
2.3 Cage高度、位置对手术节段ROM的影响
在骨质正常和骨质疏松的TLIF手术后模型中,所有加载方向上的ROM值均在1°以内,其中骨质疏松模型的各项ROM值略高于骨质正常模型(约高8%左右);与Cage的前对称放置相比,斜向不对称放置Cage后,在骨质正常和骨质疏松模型的ROM值分别增加了66%和72%左右;与10 mm规格的Cage相比,8 mm的Cage置入后,在骨质正常和骨质疏松模型的ROM值分别增加了43%和48%左右。具体见图5。
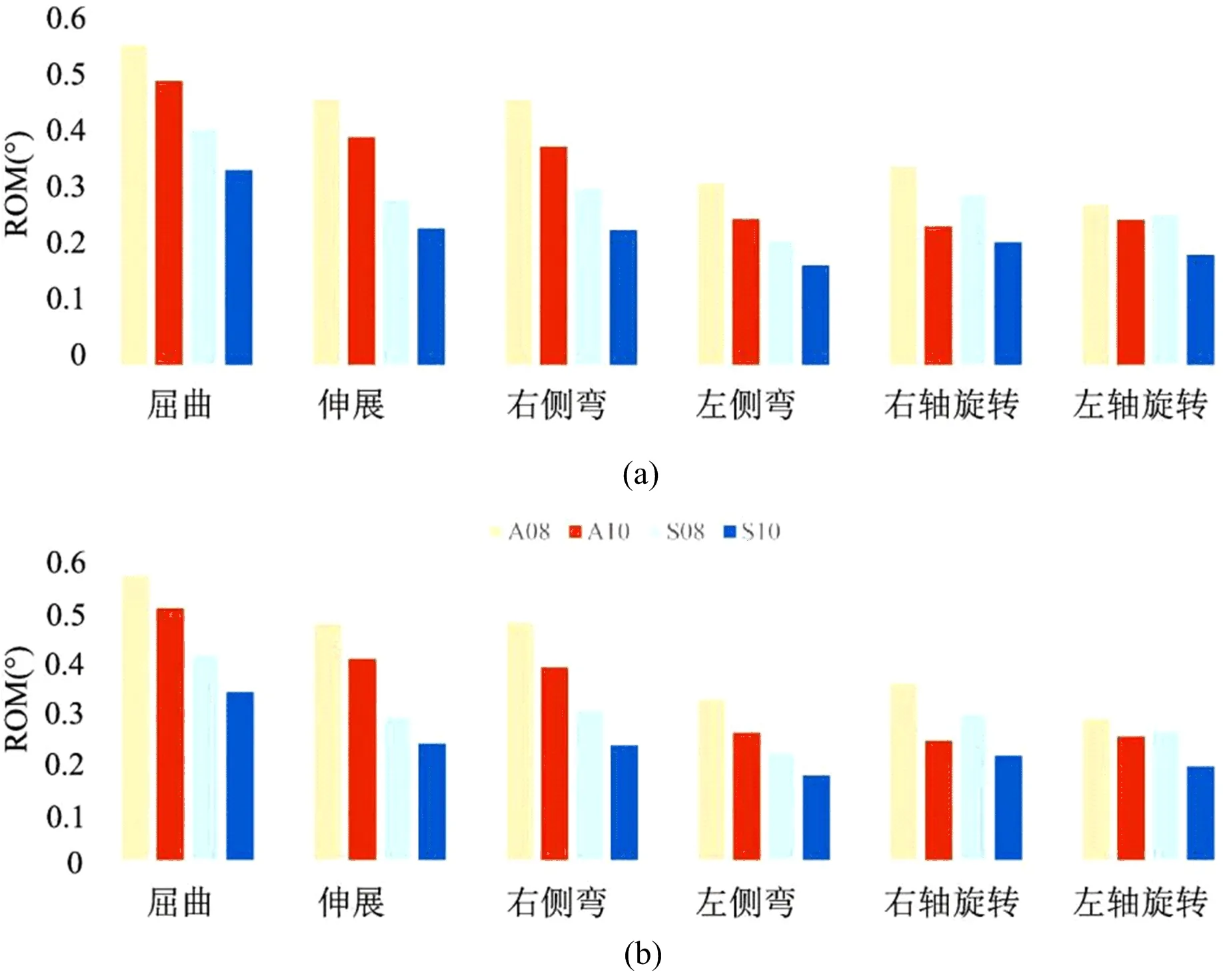
图5 内固定节段置入Cage后在不同加载条件下的ROM值(a:骨质正常模型;b:骨质疏松模型。A08:斜向不对称放置8 mm高度的Cage,A10:斜向不对称对称放置10 mm高度的Cage,S08:前对称放置8 mm高度的Cage,S10:前对称放置10 mm高度的Cage)
2.4 Cage高度、位置对终板-融合器界面的应力变化
在骨质正常模型中,8 mm高度Cage的终板-融合器界面应力变化范围为:前对称放置82.1~98.4 MPa和斜向不对称放117.9~155.5 MPa;10 mm高度Cage的变化范围为:前对称放置88.2~107.2 MPa和斜向不对称放置134.4~176.4 MPa,见图6a。相较于骨质正常模型,骨质疏松模型的上述应力平均降低约2.5%左右,见图6b。相较于Cage的前对称放置,斜向不对称放置在骨质正常和骨质疏松模型的最大应力分别增加了41%和43%左右。具体见表2和图6。

表2 不同Cage高度和位置下的终板-融合器界面应力变化范围(MPa)
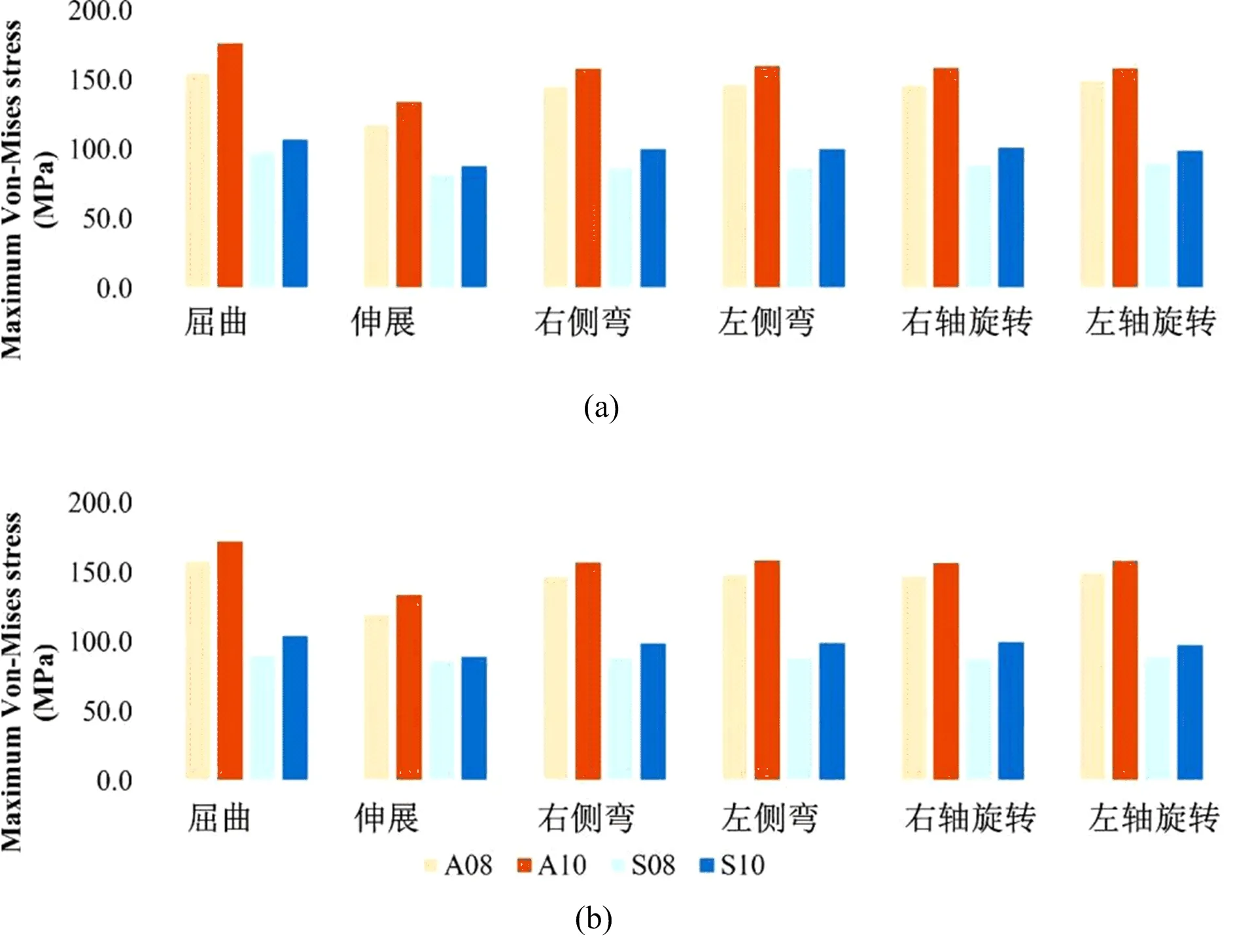
图6 内固定节段置入Cage后在不同加载条件下的ROM值(a:骨质正常模型;b:骨质疏松模型。A08:斜向不对称放置8 mm高度的Cage,A10:斜向不对称对称放置10 mm高度的Cage,S08:前对称放置8 mm高度的Cage,S10:前对称放置10 mm高度的Cage)
2.5 Cage高度、位置对L5上终板应力变化
在骨质正常和骨质疏松模型中,与置入8 mm规格的Cage相比,置入10 mm规格Cage均可增加16%左右的L5上终板应力;在10 Nm和400 N动态载荷的模拟弯矩下,四种测试配置的L5上端板上应力云图见图7。
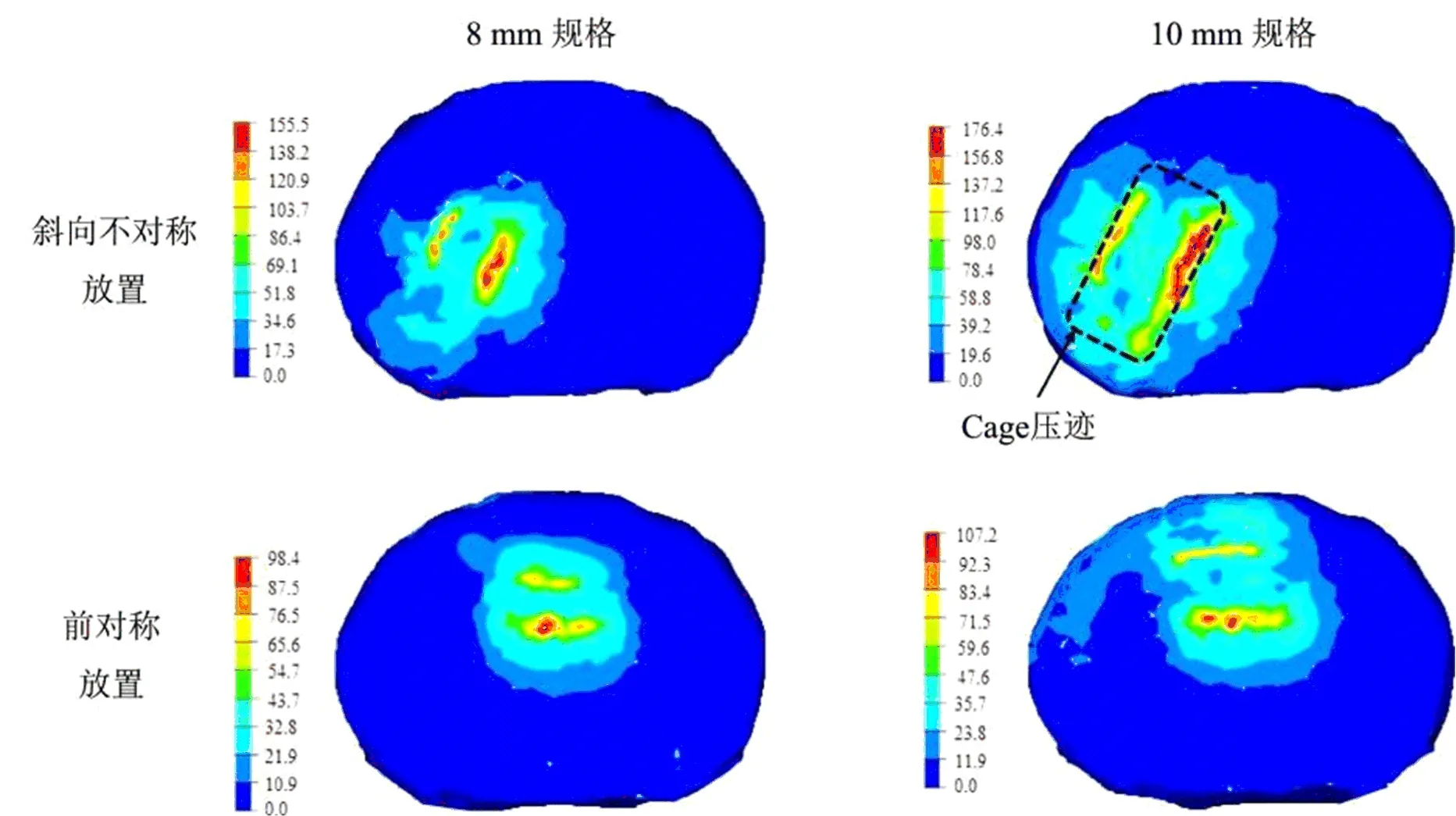
图7 不同Cage高度和位置对L5上终板的应力变化云图
2.6 Cage高度、位置对内固定物的应力变化
主要观察Cage高度和位置对钛棒的应力影响。表3可见:在正常骨质模型下,当Cage高度为8 mm时,前对称放置的钛棒最大应力范围为128.9~230.3 MPa,斜向不对称放置的范围为114.9~326.6 MPa;当Cage高度为10 mm时,前对称放置的钛棒最大应力范围为60.3~218.0 MPa,斜向不对称放置的范围为69.6~262.5 MPa。骨质疏松模型下,上述应力均增加了120%左右(见图8b)。与前对称位置相比,Cage的斜向不对称放置在骨质正常和骨质疏松模型中的最大应力分别增加了55%和48%左右(见图8)。此外,在斜向不对称放置时,Cage一侧的钛棒应力明显高于另一侧;相对于10 mm规格的Cage,8 mm规格可使骨质正常和骨质疏松模型的钛棒最大应力分别增加59%和54%左右。

表3 不同Cage高度和位置下的钛棒应力变化范围(MPa)
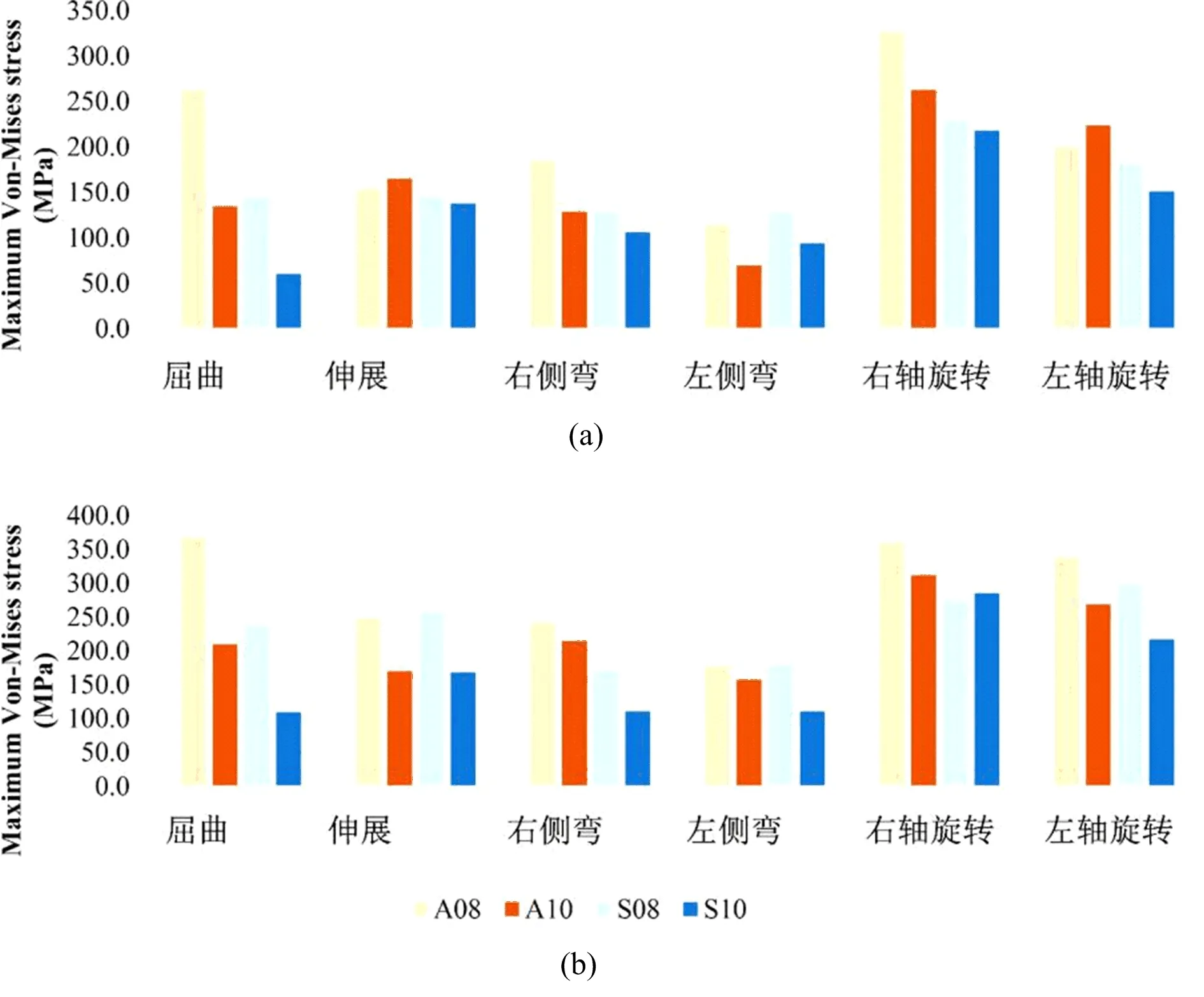
图8 不同Cage高度和位置对内固定物的应力变化(a:骨质正常模型;b:骨质疏松模型。A08:斜向不对称放置8 mm高度的Cage,A10:斜向不对称对称放置10 mm高度的Cage,S08:前对称放置8 mm高度的Cage,S10:前对称放置10 mm高度的Cage)
3 讨论
在TLIF手术中,Cage植骨融合是重建腰椎稳定性的关键性因素[17]。但Cage下沉问题并不少见,研究表明,手术节段的术前椎间隙高度、术后椎间隙高度以及SLL值均是影响Cage下沉的相关因素[18]。然而目前,关于融合器规格和术中置放位置对其术后下沉的影响,国内尚未见文献报道。为此,本研究模拟了不同高度的Cage和不同植入位置对于SLL、手术节段ROM、终板-融合器界面应力、L5上终板应力、内固定物应力等方面的影响,为临床提供了参考数据。该模型构建后,笔者将之与Dahl等[14]和Jaramillo等[15]的类似模型进行了屈曲、侧弯和轴向旋转ROM值比较,均在相近范围内,证实了该模型的合理性。
3.1 Cage高度所致的影响
在SLL的影响方面,无论8 mm还是10 mm高度的Cage植入后,SLL数值均有所增加,但10 mm高度Cage所增加的SLL值更高。从几何学的角度来看,该结果在意料之中,因为更大的椎间高度则意味着更大的椎间隙前缘高度,从而使SLL值增加。在终板-融合器界面应力方面,10 mm高度Cage应力要高于8 mm。这是由于,Cage的高度越大,则需更多的椎间牵张力才能放置,使得软组织紧绷所产生的终板-融合器界面的压力也明显增加;与此同时,由于椎间韧带的非线性力学特性,使得该节段的结构刚度更高,而ROM则相应更低,如图5所示。由此也可解释,10 mm高度Cage所致的内固定钛棒生物力学负荷有所减少,导致其应力明显低于8 mm的Cage。
3.2 Cage位置所致的影响
笔者选择了临床常用的前对称植入和斜向不对称植入方式,在SLL的影响方面,两个位置的数值非常接近(8 mm高度分别为0.9°和1.0°,10 mm高度分别为1.4°和1.7°);但前对称植入的Cage,在终板-融合器界面的应力始终低于斜向不对称植入(8 mm高度分别为82.1~98.4 Mpa和117.9~155.5 Mpa,10 mm高度分别为88.2~107.2 Mpa和134.4~176.4 Mpa)。这可能是由于前对称放置的终板-Cage界面处的合力有更长的杠杆力臂,从而提供了平衡外部负荷的力学优势。从这一角度而言,若使用类似的椎间融合器,且终板-融合器界面的压缩力较小时,可预见前对称放置的应力较低。
此外,Cage位置对于终板-融合器界面的应力分布也有显著影响,这一现象应引起重视,因为在斜向不对称放置时,8 mm和10 mm高度Cage的终板-融合器界面应力最大值(分别为117.9~155.5 MPa和134.4~176.4 MPa)均超过了皮质骨的抗破坏应力(126 MPa)[19],有引起融合器下沉的风险。此外,在斜向不对称放置时,融合器一侧钛棒相对于上下椎体中心支点的杠杆力臂较短,导致该侧钛棒的应力明显高于Cage的前对称放置(8 mm高度分别为114.9~326.6 Mpa和128.9~230.3 Mpa,10 mm高度分别为69.6~262.5 Mpa和60.3~218.0 Mpa)。
3.3 骨密度所致的影响
本研究比较了正常骨质和骨质疏松模型的上述方面变化,两者在SLL的影响方面并无明显差异,后者仅增加1.2%以内的幅度;在终板-融合器界面应力方面,虽然与骨质正常模型相近(仅降低2.5%),但有人指出,由于骨密度降低,导致终板抗破坏的力学强度降低20%~40%[15],因此,可视为显著增加了Cage下沉的风险。Oh等[20]也指出,相对于骨质正常人群,骨质疏松人群的Cage下沉风险将增加3倍。与此同时,在钛棒应力方面,骨质疏松模型的应力平均增加了120%左右,这可能与骨质疏松椎体的刚度较低,对功能载荷的承受力较小,使得钛棒承受了较高的载荷和应力所致。
综上所述,本研究通过建立L4-5节段的TLIF手术三维有限元模型,分别针对Cage高度、Cage位置和骨质量对各项生物力学指标的影响进行评测,结果表明,相较于8 mm高度,10 mm高度的Cage可增加SLL值,增加终板-融合器界面应力,降低钛棒的应力;前对称或斜向不对称植入Cage时,对SLL的影响较小,但斜向不对称植入可增加终板-融合器界面的应力,同时增加钛棒的应力值;而骨质疏松可增加Cage下沉风险,同时使钛棒承受较高的应力。由此可认为,对于骨质正常的人群,选择8 mm高度的Cage、前对称植入椎间隙时,可降低终板-融合器界面应力,使Cage下沉的风险降低,但可增加内固定钛棒的应力。
本研究的结论仅基于三维有限元模型所得,尚有待于大宗样本临床数据的分组队列研究来验证;此外,由于仅选择L4-5节段来建模,在L3-4或L5-S1节段是否也有相似的结论,还有待进一步评估。因此,本研究仅可视作一种理论参考,尚不具备临床指导价值。

