盐碱地高盐废水电解脱氯同步制氢特性
赵培轩,刘慧敏,2,潘启成,陈思懿,徐斯华,刘洪光,姚 洪,胡红云
盐碱地高盐废水电解脱氯同步制氢特性
赵培轩1,刘慧敏1,2,潘启成1,陈思懿3,徐斯华1,刘洪光4,姚 洪1,胡红云1※
(1. 华中科技大学煤燃烧国家重点实验室,武汉 430074;2. 深圳华中科技大学研究院,深圳 518000;3. 中南民族大学资源与环境学院,武汉 430074;4. 石河子大学水利建筑工程学院,石河子 832000)
就近利用风光能电解盐碱地治理过程中产生的高盐废水,是同步实现风光消纳、废水处理和H2/Cl2生产的有效途径。然而,盐碱地治理废水盐浓度较低且盐离子种类众多,直接电解严重影响脱氯制氢效率。该研究通过开展盐碱地治理废水的电解试验,讨论了盐浓度及不同除杂工艺对废水脱氯制氢特性的影响规律。结果表明,不同盐浓度废水电解的H2/Cl2产率与电流密度呈线性关系,且产H2速率稍大于产Cl2速率。电流密度和pH值均随盐浓度升高先增大后减小,废水中盐浓度为3.5 mol/L时,电解后最终电流密度和阴极的pH值均最大,电解效果最优。添加Ca(OH)2对废水进行电解前除杂,可将浓缩废水中Ca2+、Mg2+和SO42-浓度分别降低至0.02 、0.1 和0.2 mol/L。电解过程中通入CO2能够进一步降低杂质离子对废水电解的不利影响,使电解脱氯制氢性能相比对照组提升10%左右,研究结果可为高盐废水处理提供理论支持。
盐碱地;废水;电解;脱盐;制氢;除杂
0 引 言
以太阳能、风能等可再生能源发电部分替代化石能源发电是实现双碳目标的关键措施之一[1]。中国明确提出,到2030年风电、太阳能发电总装机将达12亿kW以上[2]。然而,由于风光波动性大的特点,可再生能源发电过程中存在弃风弃光严重的问题[3]。2021年1—9月,全国弃风电量约147.8亿kW·h,弃光电量约50.2亿kW时。其中“三北”地区弃风弃光现象尤为突出[4]。同时“三北”地区盐碱地面积为2 984.98万hm2,占全国盐碱地面积的82.2%,盐碱地治理过程中产生的废水问题突出、亟待处理[5]。为实现能源利用与资源再生的深度耦合,利用废弃风光能电解盐碱地治理过程中产生的含盐废水,是同步实现风光消纳、废水处理和H2/Cl2生产的有效途径,具有重要的现实意义。
利用可再生能源电解制氢是现阶段诸多学者关注的焦点,但多数研究集中于电解纯水或电解海水[6-10]。一些学者对废水电解资源化利用开展了研究,但多以酸或碱为副产物[11-13],对盐碱地治理废水进行电解脱氯制氢的研究还鲜有报道。值得说明的是,前人对海水、饱和食盐水等典型盐水的电解研究表明,电解析氯效果与盐浓度密切相关。Williams[14]采用了双碳电极进行直接电解海水制氢试验,发现在析氢效率最大(89%)的电流密度(90 mA/cm2)下,O2和Cl2同时在阳极产生。Yumashev等[15]的研究报道盐水浓度较低时,不利于析氯反应的发生。Luna-Trujillo等[16]在探究活性氯的生成机理时发现盐水中NaCl浓度由0.1 mol/L提高到0.2 mol/L后电流密度增大,脱氯效果显著增强。鉴于盐碱地喷灌产生的废水含盐浓度通常较低(0.2 mol/L左右),对盐碱地废水进行浓缩是实现其电解脱氯制氢的前提,因此有必要探究适宜的盐水浓度以保证稳定析氯效果。
另一方面,废盐水中含有Ca2+、Mg2+和SO42-等众多盐离子[17],均会对废水脱氯制氢造成不利影响。Han等[18]在电解海水过程中观察到阴极电极表面和附近形成不溶沉淀导致装置硬件寿命降低。Jwa等[19]和Adnan等[20]学者的研究也证实废水里过高浓度的Ca2+、Mg2+会在阴极侧生成氢氧化物沉淀,而沉淀附着在电极或隔膜上会降低电解脱氯制氢的性能。Cheng等[21-22]发现在阴极附近生成的Mg(OH)2、Ca(OH)2会覆盖电极催化活性位点,导致催化剂中毒。为此,工业化盐水电解过程对盐水品质提出了极为苛刻的要求,即钙镁离子的质量浓度之和不高于0.03 mg/L,其中一次盐水中Ca2+、Mg2+的浓度应分别小于2 mg/L和1 mg/L,而经过离子交换树脂后,对Ca2+浓度的要求更是达到了小于0.01 mg/L的标准[23]。为了去除盐水中的杂质离子,Xu等[24]用阳离子交换树脂使Ca2+、Mg2+浓度分别降到5 mg/L和2 mg/L,但该工艺一次性投资成本较高。王伟等[25]用化学沉淀法将高盐水中的钙、镁协同去除至20、5 mg/L以下。总体而言,现有研究在保障电解盐水纯度的过程中极易导致除杂工艺繁琐、成本较高。为形成可行的高盐废水治理技术,亟待探索低碳经济的含盐废水电解除杂工艺,在降低杂质离子影响的同时提升系统经济性。
针对上述问题,本文选取三北地区典型盐碱地治理产生的废水开展电解试验研究,讨论盐浓度及不同除杂工艺对废水脱氯制氢特性的影响,重点探索电解过程通入CO2前后废水的脱氯制氢性能,以期为盐碱地治理废水及其他领域含盐废水的资源化处置提供理论参考。
1 试验装置及方法
1.1 样品
试验中所取的废水为新疆图木舒克市盐碱地治理过程中产生的废水,且水样1、2是在2个不同地点收集的。对2个水样中可溶性离子进行分析(表1),新疆图木舒克市盐碱地治理废水中主要的阳离子为Na+,同时含有K+、Ca2+和Mg2+,而阴离子中,Cl-和SO42-含量较多。
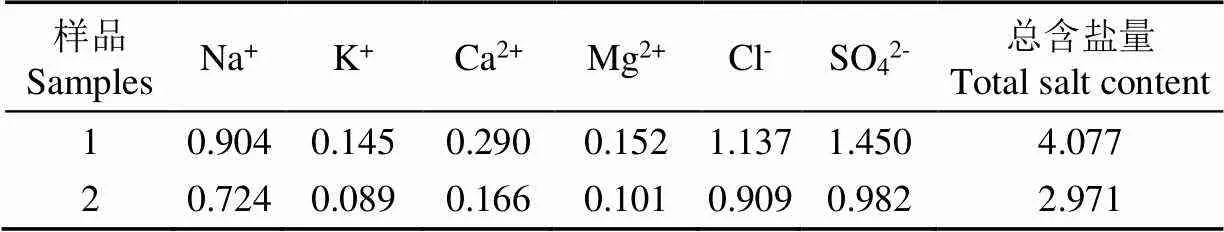
表1 新疆图木舒克市水样含盐特性分析
试验过程中所用的模拟废水均是用化学试剂(分析纯)与去离子水混合配置而成。废水中包括Na+、K+、Ca2+、Mg2+、Cl-和SO42-离子。废水盐浓度指废水中4种阳离子(Na+、K+、Ca2+和Mg2+)或2种阴离子(Cl-和SO42-)所带电荷浓度之和。在分析废水盐浓度对脱氯制氢特性影响时,为方便探究,使用NaCl试剂配置不同浓度的溶液。在探究电解前除杂工艺时根据表1中样品含盐情况使用NaCl、Na2SO4、KCl、CaCl2和MgCl2试剂配置模拟废水,除杂时添加Ca(OH)2。此外使用电解前除杂得到的废水进行电解中除杂工艺探究。
1.2 试验过程
电解过程中使用的电解池如图1所示。该电解池为可换膜电解池,电解池包括3个容积均为150 mL单池体,分别为阳极电解池、阴极电解池和CO2调节池。其中阳极电解池与阴极电解池相连,且两单池体之间设有隔膜(杜邦公司N117膜)。未进行试验时,隔膜保存在去离子水中。阴极电解池与CO2调节池相连,且两单池体之间没有设置隔膜。阳极电极使用钌铱钛电极(尺寸:15 mm×15 mm;0.5 mm厚),阴极电极均使用Q235碳钢(尺寸:10 mm×10 mm;0.5 mm厚),两电极间的间距为8.7 cm。试验在室温(20 ℃±5 ℃)下分批进行。试验过程中通过可调直流稳压电源(MS1510DS,广东)为电解池供电,输入电压稳定在12 V。阳极电解池的排气口连接到一个500 mL的洗气瓶中,洗气瓶中装有400 mL的10%NaOH溶液,之后连接排水装置。阴极电解池的排气口则连接另一个排水装置。CO2调节池则与进气管连接,同时CO2调节池的排气口与大气接通。预试验中测得最大H2产率在5~10 mL/min,CO2理论通入流量是产氢速率的2倍,但由于CO2难以全部反应,因此CO2实际通入流量设置为最大理论流量的2倍,即40 mL/min左右(试验中为44.3 mL/min)。在分析不同含盐浓度下废水电解脱氯制氢特性过程中,依据适宜电解脱氯同步制氢的盐水浓度,设置盐水浓度浓度分别为2、2.75、3.5、4.25和5 mol/L,并对不同盐浓度下的阴极侧pH值与最终电流密度进行监测分析。

图1 废水电解原理图
1.3 测试与表征
利用微波等离子体原子发射光谱仪(MP-AES,美国)对废水中阳离子进行分析,离子色谱仪(IC-2010,日本)对废水中阴离子进行分析。电解过程中通过可调直流稳压电源以恒压模式运行,电流通过读取电源上数字屏幕显示的数字得到。此外,电流密度采用阴极电极上相对于与溶液接触的隔膜的投影面积而言(200 mm2)的电流密度。电解过程中产生的气体通过排水装置用排水法测得。pH则通过pH计测得(PHSJ-4F,上海),不做特殊说明,本文中测得的反应后pH值为阴极电解池的pH值。
1.4 分析方法
利用电流密度、电解速率(包括制氢速率和制氯速率)、电解效率和pH值对脱氯制氢性能进行分析。电解速率指单位时间内产气速率,根据排水法测得氢气和氧气体积,再按照公式(1)进行计算得到电解过程中测得的氯气体积。
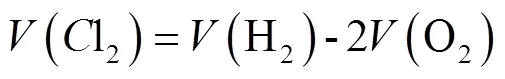
式中(Cl2)表示产生的氯气体积,mL;(H2)表示产生的氢气体积,mL;(O2)表示产生的氧气体积,mL。

式中F为电解过程中单位时间内生产的氢气所具有的能量,kJ;E为实际盐水电解过程中单位时间内生产氢气所消耗的能量,kJ。
具体试验中,F为一定电解时间内产生的氢气所具有的能量,E为每15 min内电源输入的总能量,F、E的计算见公式(3)~(4)。


式中氢气的高位热值为286 kJ/mol,常温差压下1 mol氢气的体积为24 414 mL。为电解过程中稳压直流电源的输入电压,V;为电解过程中该输入电压下对应的电流,由于电解过程中经过一段时间后电流密度一般会发生变化,因此计算中取为前后两次测得电流的平均值,A;为一定电解时间段的时间长度,本试验中取为15 min。
2 结果与讨论
2.1 不同盐浓度下废水电解脱氯制氢特性
不同盐浓度下的废水电解电流密度及对应的脱氯制氢速率如图2a所示。可知产H2和产Cl2的速率与电流密度呈现出良好的线性关系,制氢速率曲线的决定系数2=0.950 7,制氯速率曲线的决定系数2=0.887 5。对比同一电流密度下的产H2速率和产Cl2速率发现,制氢速率稍大于制氯速率,这是因为在电解过程中,阴极只发生析氢反应(式(5))而阳极不仅发生析氯反应(式(6)),还会发生析氧反应(式(7)),因此产Cl2速率比产H2速率低。但同时也可以看出,产H2速率和产Cl2速率相差不大,说明析氧副反应在阳极反应中所占份额较小。
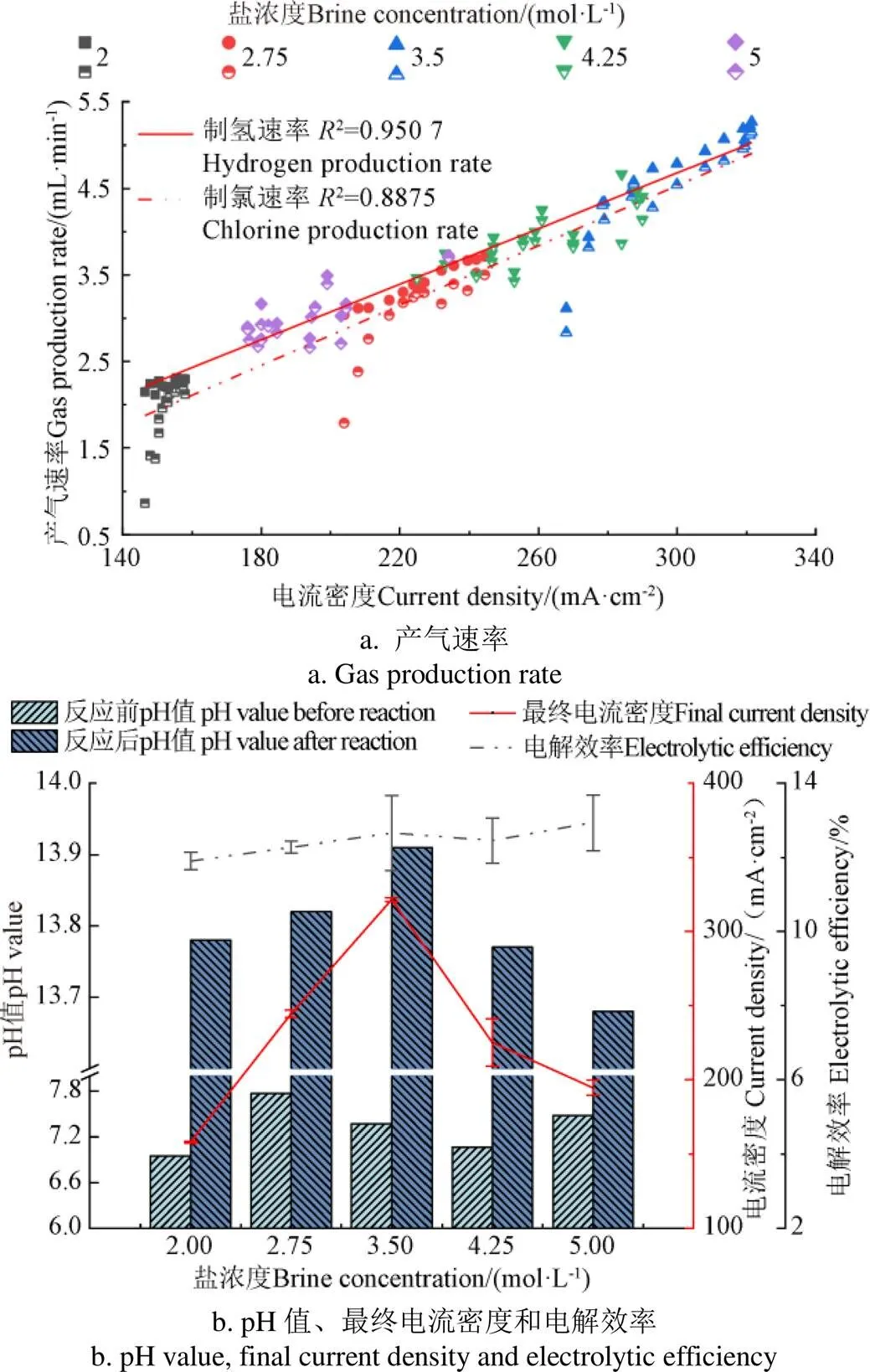
图2 不同浓度下NaCl溶液电解特性
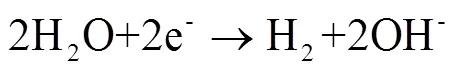


进一步对比不同盐浓度下废水电解反应前后pH值、最终电流密度和电解效率的变化情况(图2b)。由图2b可知,保证输入电压等其他条件不变时,随盐浓度的改变,反应前的pH值在中性附近且变化不大,同时反应后的pH值(呈强碱性)和最终电流密度会随之发生变化。盐浓度在较低范围(2~3.5 mol/L)时,随盐浓度增大,最终电流密度逐渐增大,同时电解反应后的pH值也逐渐增大;盐浓度在较高范围(3.5~5 mol/L)时,随盐浓度增大,最终电流密度逐渐减小,同时电解反应后的pH值也逐渐减小。不难看出,电解反应后的pH值随盐浓度的变化趋势与最终电流密度随盐浓度的变化趋势相同,且当盐浓度在(2~5 mol/L)变化时,随盐浓度升高,反应后的pH值与最终电流密度均先增大再减小。当盐浓度为3.5 mol/L时,反应后的pH值与最终电流密度最佳。电解反应后的pH值反应的是整个电解过程中电解情况,体现整个电解过程中的状态;最终电流密度是对最终稳定时电解情况的描述,体现电解稳定时的状态。但一般情况下,整体电解情况越好,最终稳定时的电解情况也最有利,因此两者的趋势往往相同。电解过程中电流密度越大,析氢反应速率越快,OH-生成速率越快,反应后的pH值越大。此外发现不同盐浓度下电解效率基本相同,主要是由于制氢速率和电流密度呈正相关关系(图2a),因此两者比值为一定值。同时电解时间固定,通过式(8)可知电解效率只与输入电压有关,且两者呈负相关关系。因此电解效率本质上和输入电压有关,而与盐浓度没有直接关系。但恒压下电流密度的提高意味着相同电流密度下需要提供的电压降低,电解效率提高。综合电解后的pH值、最终电流密度和电解效率来看,废水浓缩后最适盐浓度为3.5 mol/L。

随着废水由0.07 mol/L浓缩至3.5 mol/L(浓缩了50倍),对比同浓度下浓缩后的废水和NaCl模拟废水电解情况(图3),发现整体上同浓度下废水的电解情况要低于NaCl模拟废水的电解情况,且最终稳定电流密度相对模拟废水要低21.47%。进一步发现废水电解时电流密度出现了明显下降,这突出反映了杂质离子对电解脱氯制氢的不利影响。因此杂质离子除杂工艺的设计极为关键。
2.2 电解前除杂对废水脱氯制氢的影响
鉴于废水直接浓缩后电解脱氯制氢性能不佳,设计了电解前向废水中加入Ca(OH)2的除杂工艺。将是否添加Ca(OH)2后各离子浓度情况进行对比,如图4所示。未添加Ca(OH)2时,废水浓缩后Mg2+浓度很高,这是由于废水直接浓缩时Mg2+未除杂。而添加Ca(OH)2后Mg2+浓度大幅降低。此外SO42-浓度有所下降,这是由于Ca(OH)2加入导致CaSO4沉淀增多。综上,添加Ca(OH)2后浓缩实现废水中Ca2+、Mg2+和SO42-浓度分别低于0.02 、0.1和0.2 mol/L。

图4 添加Ca(OH)2前后浓缩废水离子组成
废水中钙镁离子浓度之和约等于硫酸根离子浓度,当向废水中加入一定量Ca(OH)2时,首先发生Mg2+与Ca(OH)2的反应,即Mg2+以Mg(OH)2的形式被去除。伴随Mg2+的去除,废水中Ca2+和SO42-浓度相近。进一步浓缩时Ca2+和SO42-均以CaSO4的形式被去除。综上,向废水中添加Ca(OH)2并进一步浓缩,不仅同时除去了废水中的Ca2+、Mg2+和SO42-,还将废水的盐浓度达到3.5 mol/L,满足了盐水电解时对盐浓度的要求。
2.3 电解中除杂对废水脱氯制氢的影响
进一步,电解过程中的除杂以通入CO2来实现,CO2通入前后废水电解的脱氯制氢特性对比如图5所示。从图5a中可以看出,未通入CO2时,废水电解过程可分为Ⅰ、Ⅱ、Ⅲ 3个阶段。阶段Ⅰ为电解启动阶段(0~60 min),电流密度随电解时间的延长而逐渐增大。阶段Ⅱ为杂质离子影响阶段(60~120 min),此阶段电流密度的变化情况与阶段Ⅰ相反,即电流密度不断下降。Ⅲ为电解稳定阶段(120~270 min),随电解时间的延长,电流密度先升高再趋于稳定。而电解过程中通入CO2(图 5b),电解过程只包含Ⅰ和Ⅲ两个阶段。阶段Ⅰ(0~90 min)的趋势不变,但电解启动阶段的时间有所延长。CO2的通入主要影响了阶段Ⅲ(90~270 min)。该阶段电流密度先在虚线附近不断波动,最终趋于稳定且电流密度相对无电解中除杂时提高10%左右。
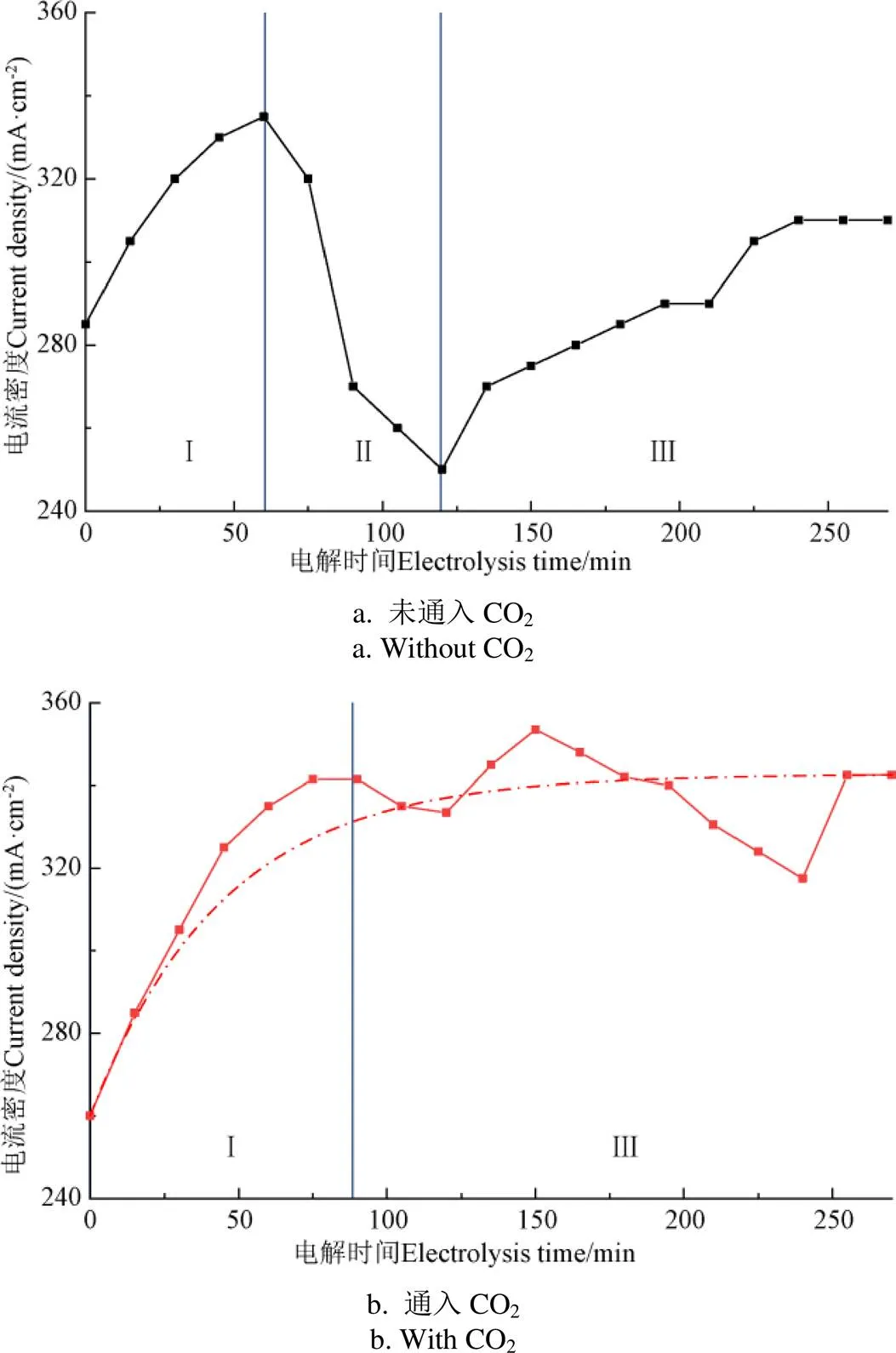
图5 CO2通入前后电流密度随电解时间的变化特性
未通入CO2时,废水中Ca2+和Mg2+等杂质离子在碱性环境下不断形成氢氧化物沉淀并附着在隔膜上,隔膜通透性下降引起离子传质速率降低,导致电流密度不断下降(阶段Ⅱ)。随着附着在隔膜上的沉淀不断积累并部分脱落,沉淀对电解的不利影响有所降低,因而电流密度呈现一定程度的回升(阶段Ⅲ),但电流密度的大幅度波动不可避免地制约了电解的脱氯制氢性能。通入CO2后,阶段Ⅱ中沉淀生成累积带来的不利影响消失。这是由于Ca2+、Mg2+离子的碳酸氢盐溶解度远大于其氢氧化物的溶解度,在电解中通入过量CO2,最终将Ca2+、Mg2+的氢氧化物转化为碳酸氢盐,提高了其在废水中的溶解度,进一步降低了其对电解脱氯制氢的不利影响。此外,CO2调节池的设计避免了向阴极电解池直接通入CO2带来的CO2气泡影响H+在电极上进行吸附和反应的问题,同时避免了部分未完全反应的CO2混入制取氢气中而降低氢气纯度的问题。
3 结 论
1)不同盐浓度废水电解的H2/Cl2产率与电流密度呈线性关系,且产H2速率稍大于产Cl2速率。电流密度和pH值均随盐浓度升高先增大后减小,盐浓度为3.5 mol/L时电解效果最佳。
2)电解前向废水中加入Ca(OH)2的除杂工艺,可实现废水中Ca2+、Mg2+和SO42-浓度分别降低至0.02、0.1和0.2 mol/L。
3)电解中通入CO2将Ca2+、Mg2+离子的氢氧化物沉淀转化为高溶解度的碳酸氢盐,可以消除电解过程沉淀生成累积带来的不利影响,使电流密度提高10%左右。
[1] 王季康,李华,彭宇飞,等. 碳中和目标下可再生能源的3种应用模式[J]. 现代化工,2022,42(5):1-6.
Wang Jikang, Li Hua, Peng Yufei, et al. Three application modes of renewable energy under carbon neutralization target[J]. Modern Chemical Industry, 2022, 42(5): 1-6. (in Chinese with English abstract)
[2] 习近平在气候雄心峰会上的讲话(全文)[EB/OL]. [2022-07-11]. https: // www. ccps. gov. cn/xxsxk/zyls/ 202012/t20201213_145612. shtml.
[3] Yasuda Y, Bird L, Carlini E M, et al. C-e (curtailment- energy share) map: An objective and quantitative measure to evaluate wind and solar curtailment[J]. Renewable and Sustainable Energy Reviews, 2022, 160: 112212.
[4] 国家能源局组织召开6月份全国可再生能源开发建设形势分析会[EB/OL]. [2022-07-11]. http: //www. nea. gov. cn/2022-07/07/c_1310639100. htm.
[5] 王晓丽,马世贤,王生辉,等. 反渗透在盐碱地改良淋洗水处理工程中的应用[J]. 水处理技术,2022,48(1):147-149, 156.
Wang XiaoLi, Ma Shixian, Wang Shenghui, et al. Application of A/O+MBR process in decentralized wastewater treatment project[J]. Technology of Water Treatment, 2022, 48(1): 147-149, 156. (in Chinese with English abstract)
[6] 孙鹤旭,李争,陈爱兵,等. 风电制氢技术现状及发展趋势[J]. 电工技术学报,2019,34(19):4071-4083.
Sun Hexu, Li Zheng, Chen Aibing, et al. Current status and development trend of hydrogen production technology by wind power[J]. Transactions of China Electrotechnical Society, 2019, 34(19): 4071-4083. (in Chinese with English abstract)
[7] Mohammadi A, Mehrpooya M. A comprehensive review on coupling different types of electrolyzer to renewable energy sources[J]. Energy, 2018, 158: 632-655.
[8] Xia J, Eigenberger G, Strathmann H, et al. Flow battery based on reverse electrodialysis with bipolar membranes: single cell experiments[J]. Journal of Membrane Science, 2018, 565: 157-168.
[9] Chi J, Yu H. Water electrolysis based on renewable energy for hydrogen production[J]. Chinese Journal of Catalysis, 2018, 39(3): 390-394.
[10] Jing K, Liu C, Cao X, et al. Analysis, modeling and control of a non-grid-connected source-load collaboration wind-hydrogen system[J]. Journal of Electrical Engineering & Technology, 2021, 16(5): 2355-2365.
[11] Feng L, Tian B, Wang B, et al. Purification of hydrazine hydrate waste salt using a water washing based integrated process for the production of sodium hydrate via ion-exchange membrane electrolysis[J]. Journal of Cleaner Production, 2021, 319: 128626.
[12] Lu S, Zhao B, Chen M, et al. Electrolysis of waste water containing aniline to produce polyaniline and hydrogen with low energy consumption[J]. International Journal of Hydrogen Energy, 2020, 45(43): 22419-22426.
[13] Frank I. Ab‐Initio molecular dynamics simulation of the electrolysis of waste water[J]. ChemistrySelect, 2019, 4(14): 4376-4381.
[14] Williams L O. Electrolysis of sea water[J]. Hydrogen Energy, 1975, 2: 424-427.
[15] Yumashev A V, Fateminasab S M, Marjani A, et al. Development of computational methods for estimation of current efficiency and cell voltage in a chlor-alkali membrane cell[J]. Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, 2021, 43: 1-14.
[16] Luna-Trujillo M, Palma-Goyes R, Vazquez-Arenas J, et al. Formation of active chlorine species involving the higher oxide mox+1 on active ti/ruo2-iro2 anodes: A dems analysis[J]. Journal of Electroanalytical Chemistry, 2020, 878: 114661.
[17] 杜疆,苏裕,孔轶众,等. 离子膜电解盐水中杂质含量的控制[J]. 氯碱工业,2009,45(6):8-9.
Du Jiang, Su Yu, Kong Yizhong, et al. Control of impurity contents in brine for ion-exchange membrane electrolysis[J]. Chlor-Alkali Industry, 2009, 45(6): 8-9. (in Chinese with English abstract)
[18] Han J H. Exploring the interface of porous cathode/bipolar membrane for mitigation of inorganic precipitates in direct seawater electrolysis[J]. 2022: 10. e202200372.
[19] Jwa E, Yun Y M, Kim H, et al. Energy-efficient seawater softening and power generation using a microbial electrolysis cell-reverse electrodialysis hybrid system[J]. Chemical Engineering Journal, 2020, 391: 123480.
[20] Adnan F H, Mousset E, Pontvianne S, et al. Mineral cathodic electro-precipitation and its kinetic modelling in thin-film microfluidic reactor during advanced electro-oxidation process[J]. Electrochimica Acta, 2021, 387: 138487.
[21] Cheng F, Feng X, Chen X, et al. Synergistic action of co-fe layered double hydroxide electrocatalyst and multiple ions of sea salt for efficient seawater oxidation at near-neutral pH[J]. Electrochimica Acta, 2017, 251: 336-343.
[22] Lu X, Pan J, Lovell E, et al. A sea-change: manganese doped nickel/nickel oxide electrocatalysts for hydrogen generation from seawater[J]. Energy & Environmental Science, 2018, 11(7): 1898-1910.
[23] Blöcher C, Schießer Y, Weber R. Closing water‐related loops in high‐tech polymer production - status, perspectives and limitations[J]. Chemie Ingenieur Technik, 2019, 91(10): 1409-1416.
[24] Xu X F, Zhou X P, Liu Z F, et al. Study on causticization and purification of salt lake lithium ore and recovery of fluorine-containing lithium carbonate[J]. Inorganic Chemicals Industry, 2020, 52(7): 62-65.
[25] 王伟,仝胜录,刘捷,等. 煤化工高盐水中无机杂质协同去除技术研究[J]. 水处理技术,2022,48(6):30-33.
Wang Wei, Quan Shenglu, Liu Jie, et al. Study on the synergistic removal technology of inorganic impurities in high-salt wastewater of coal chemical industry[J]. Technology of Water Treatment, 2022, 48(6): 30-33. (in Chinese with English abstract)
[26] 密路祥. 风电电解水制氢系统的电解特性的研究[D]. 乌鲁木齐,新疆农业大学,2021.
Mi Luxiang. Study on Electrolytic Characteristics of Hydrogen Production System in Electrolytic Water of Wind Power[D]. Urumqi: Xinjiang Agricultural University, 2021. (in Chinese with English abstract)
H2/Cl2production performance of wastewater electrolysis from saline-alkali land treatment
Zhao Peixuan1, Liu Huimin1, 2, Pan Qicheng1, Chen Siyi3, Xu Sihua1, Liu Hongguang4, Yao Hong1, Hu Hongyun1※
(1.,430074,; 2., 518000,; 3.,430074,; 4.,832000,)
Solar and wind resources are usually abundant in saline-alkali lands of China. These renewable energies can be expected to partially replace fossil fuel energy for the carbon peaking and carbon neutrality goals in recent years. Specifically, energy utilization and resource regeneration can also be realized for the waste of solar and wind energy nearby to electrolyze wastewater from the saline-alkali land treatment. It is of practical significance to utilize renewable energy for the treatment of wastewater and the production of H2/Cl2. Correspondingly, the first step is to concentrate the wastewater, due to a very low salt concentration (about 0.2 mol/L) after sprinkler irrigation in the saline-alkali land. It is necessary to explore the appropriate concentration of saline water for the better stable production of Cl2. In addition, the existing purification cannot fully meet the high requirement so far, particularly in the complicated process with the high cost. This study aims to explore a low-carbon and economic process for the removal of impurities from saline wastewater. A feasible treatment technology was also proposed to reduce the impurity ions for the cost-saving purification of high-salt wastewater. A series of electrolysis experiments were carried out on the wastewater from saline-alkali land treatment. A systematic investigation was then implemented to clarify the effects of salt concentration and the impurity removal processes before/during electrolysis. The CO2regulation cell was added in this case. The influence of Ca(OH)2was explored in the process of impurity removal before electrolysis. The electrolytic experiment was set without or with the CO2input flow of 44.3 mL/min. Results showed that there was a linear correlation of the current density with the production of H2/Cl2in the wastewater electrolysis under different salt concentrations. More importantly, the rate of H2production was slightly higher than that of Cl2production. The side reaction of oxygen evolution took a small proportion in the anodic reaction. The suitable concentration of salt for the wastewater electrolysis was 3.5 mol/L, which contributed to the largest current density and cathode pH. In the optimal process, Ca(OH)2was added to the wastewater followed by concentration. The concentrations of Ca2+, Mg2+and SO42-were also achieved lower than 0.02, 0.1, and 0.2 mol/L, respectively. The reason was that the Mg2+and Ca(OH)2reacted first, when a certain amount of Ca(OH)2was added to the wastewater. Subsequently, the Mg2+was removed in the form of Mg(OH)2. The concentrations of Ca2+and SO42-were then similar in the wastewater after the removal of Mg2+. Therefore, the Ca2+and SO42-were both removed as CaSO4by the concentration. Moreover, the continuous injection of CO2during electrolysis can be expected to convert the hydroxide precipitation of Ca2+and Mg2+ions into bicarbonate with high solubility. As such, only a few adverse effects were caused by precipitation generation and accumulation in the process of electrolysis. In the end, the adverse effect of impurity ions was further reduced, with which the H2/Cl2yield increased by about 10%.
saline and alkaline land; wastewater; electrolysis; desalination; H2production; impurity removal
10.11975/j.issn.1002-6819.2022.22.018
X712
A
1002-6819(2022)-22-0166-06
赵培轩,刘慧敏,潘启成,等. 盐碱地高盐废水电解脱氯同步制氢特性[J]. 农业工程学报,2022,38(22):166-171.doi:10.11975/j.issn.1002-6819.2022.22.018 http://www.tcsae.org
Zhao Peixuan, Liu Huimin, Pan Qicheng, et al. H2/Cl2production performance of wastewater electrolysis from saline-alkali land treatment[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(22): 166-171. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.22.018 http://www.tcsae.org
2022-08-01
2022-10-23
深圳市国际合作研究项目(GJHZ20210705142541013) ;湖北省重点研发计划项目(2021BCA157)
赵培轩,研究方向为废物处置及资源化利用。Email:pxz@ hust.edu.cn
胡红云,副教授,博士生导师,研究方向为废物处置及资源化利用领域。Email:hongyunhu@hust.edu.cn

