IDO1抑制剂临床研究进展
刘伊彤,周霞,山广志
肿瘤免疫疗法是继传统手术、化疗、放疗等后出现的肿瘤治疗新手段,其通过对免疫细胞进行正向调节进而激活、重建自身的免疫系统,实现对肿瘤细胞的捕获与清除。目前临床主要的肿瘤免疫疗法包括肿瘤免疫治疗药物 IFN-α、细胞免疫疗法(CAR-T)、免疫检查点抑制剂(PD1/PDL1)等。色氨酸是 T 细胞活化的关键氨基酸,同时吲哚胺 2,3 双加氧酶 1(IDO1)是 L-色氨酸(L-Trp)主要代谢通路的第一步骤的催化限速酶,IDO1 过度表达可导致局部微环境中L-色氨酸耗竭及随后的 T 细胞功能受损,使肿瘤细胞逃脱机体免疫系统的监控与杀灭,诱发肿瘤免疫耐受。近年来,在胃癌、乳腺癌、脑癌等多种肿瘤细胞中均发现了 IDO1 的过表达,且发现 IDO1 酶水平上调与多种癌症类型的不良预后相关。因而 IDO1 已成为一个潜在的重要免疫检查点,其抑制剂的成功开发与应用将是一种有效的肿瘤控制策略。
1 IDO1 与色氨酸代谢
L-色氨酸是人体 8 种必需氨基酸(婴儿为 9 种)之一,只可通过外界食物摄取而无法自身合成,约占氨基酸总量的1%,在人体血浆中的浓度为 40 ~ 80 μmol/L,是当前已知与人体免疫系统功能失调有关的关键氨基酸[1]。在人体内,约 5% 的 L-色氨酸用于蛋白质合成或通过 5-羟色胺途径代谢为 5-羟色胺与褪黑素,其余 95% L-色氨酸均通过犬尿氨酸(Kyn)途径代谢为色氨酸代谢产物即系列犬尿氨酸衍生物[2]。多种研究表明,经犬尿氨酸途径代谢生成的色氨酸代谢产物可诱导免疫抑制,促进免疫系统效应细胞的凋亡,在自身免疫性疾病、炎症、感染和妊娠期间对免疫系统的调节起着关键作用[3-4]。
IDO1、IDO2 和色氨酸 2,3 双加氧酶(tryptophan 2,3-dioxygenase,TDO)是机体内 L-色氨酸经犬尿氨酸途径分解代谢的首个反应的关键限速酶,三种同工酶发挥作用时在色氨酸的吲哚环上插入一个氧分子,催化 L-色氨酸转化为 N-甲酰犬尿氨酸(N-formylkynurenine,NFK),均属于双加氧酶[5],但其分布、机制及底物识别特异性各不相同。
IDO 家族分为两个亚型:IDO1 与 IDO2。IDO1 首次发现于 1967年[6],由位于第 8号染色体的INDO基因编码(IDO1; EC 1.13.11.52)[7],蛋白大小约 45 kD,是一种广泛分布于肺、脾、肝、肾、脑等各个器官的胞质酶,可在不同的细胞中表达,包括抗原呈递细胞(APCs),如单核细胞来源的巨噬细胞、树突状细胞(DCs)和成纤维细胞[8]。IDO2 于 2007年被首次发现[9],由位于第 8 号染色体上的INDOL1 基因编码(EC:1.13.11.-)[7],蛋白大小约 47 kD,其主要表达于小鼠肝脏和肾脏,以及人类的肝脏、肾脏及生殖器官中[10]。TDO 首次发现于 1936年,由位于第 4 号染色体上的TDO2基因编码(TDO; EC 1.13.11.11)[7],蛋白大小约 48 kD,主要分布于肝脏及大脑[6]。IDO1 与 IDO2间的序列相似性为 43%,与 TDO 蛋白基因的序列同源性只有 10%[6]。
IDO2 与 TDO 均对底物 L-色氨酸具有高度特异性,而 IDO1 可广泛识别 L-色氨酸、D-色氨酸、5-羟基色氨酸、色胺等多种色氨酸类似物[8,11]。IDO1 与 TDO 均具有较高的催化效率,而 IDO2 的酶活性只有 IDO1 的 3% ~5%[12]。因 IDO1 分布广泛,具有较高的 L-色氨酸底物催化活性,是促进色氨酸降解的主要亚型,近年来一直被作为重要靶点进行广泛研究。
犬尿氨酸代谢途径是 L-色氨酸代谢的主要途径(图1)。首先,在 IDO1、IDO2 或 TDO的催化下,L-色氨酸吲哚环上的 2,3-双键氧化断裂转化为 NFK,此步是该途径的第一步也是限速步骤[13]。NFK 自发地或基于犬尿氨酸甲酰胺酶的活性水解成第一个稳定的中间代谢产物——L-犬尿氨酸(L-kynurenine,KYN),然后通过 3 种途径生成不同的酶代谢产物。其中,犬尿氨酸氨基转移酶(kynurenine aminotransferase,KATs)可催化 KYN 生成犬尿喹啉酸(kynurenic acid,KYNA);犬尿氨酸-3-单加氧酶(kynurenine-3-monooxygenase,KMO)可将 KYN 转化为3-羟基犬尿氨酸(3-hydroxy-kynurenine,3-HK),再经犬尿氨酸酶(kynureninase,KYNU)催化生成 3-羟基邻氨基苯甲酸(3-hydroxyanthranilic acid,3-HAA),而 KYN 在KYNU 直接催化下可生成产物邻氨基苯甲酸(anthranili acid,AA),进而转化为 3-HAA。3-HAA 经多阶段酶反应可转化为吡啶甲酸(picolinic acid,PIC)与喹啉酸(quinolinic acid,QUIN),而 QUIN 是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)生物合成的前体物质[8,13]。NAD 是一种关键的酶辅助因子,参与多种基本生物学循环,包括在糖酵解和氧化磷酸化过程中作为电子传递因子,以及被蛋白质和信号酶的共价修饰所消耗,可调节细胞衰老和维持机体正常功能[7,13]。
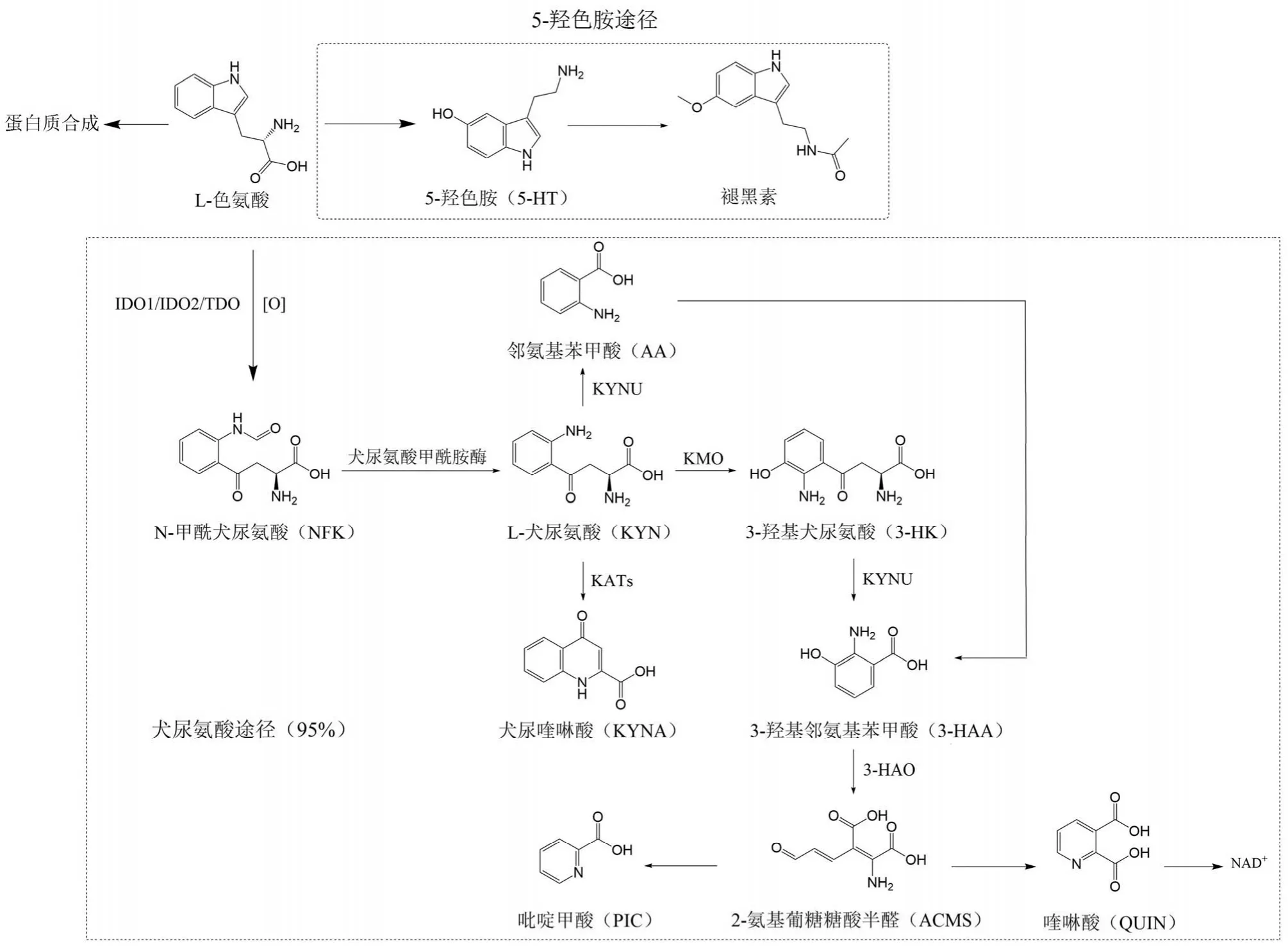
图1 L-色氨酸代谢通路(KYNU:犬尿氨酸酶;KATs:犬尿氨酸氨基转移酶;KMO:犬尿氨酸-3-单加氧酶;3-HAO:3-羟邻氨苯丙酸-3,4-双加氧酶;NAD+:烟酰胺腺嘌呤二核苷酸)
2 IDO1 与肿瘤免疫逃逸
与正常生理情况相比,发生肿瘤免疫逃逸的多种癌细胞中呈现 IDO1 酶水平显著增加,1 型辅助性 T 淋巴细胞(T helper 1,Th1)免疫应答的促炎症因子是激活 IDO1 过表达的主要因素,尤其是 IFN-γ、IL-1β、TNF-α 和 IL-6 等炎症因子也诱导 IDO1 进行不同程度的诱导表达[7,14]。研究表明,IDO 过度活跃时将导致局部微环境的 L-色氨酸耗竭及犬尿氨酸途径代谢产物蓄积,这是诱导肿瘤免疫耐受效应的关键机制[15](图2)。
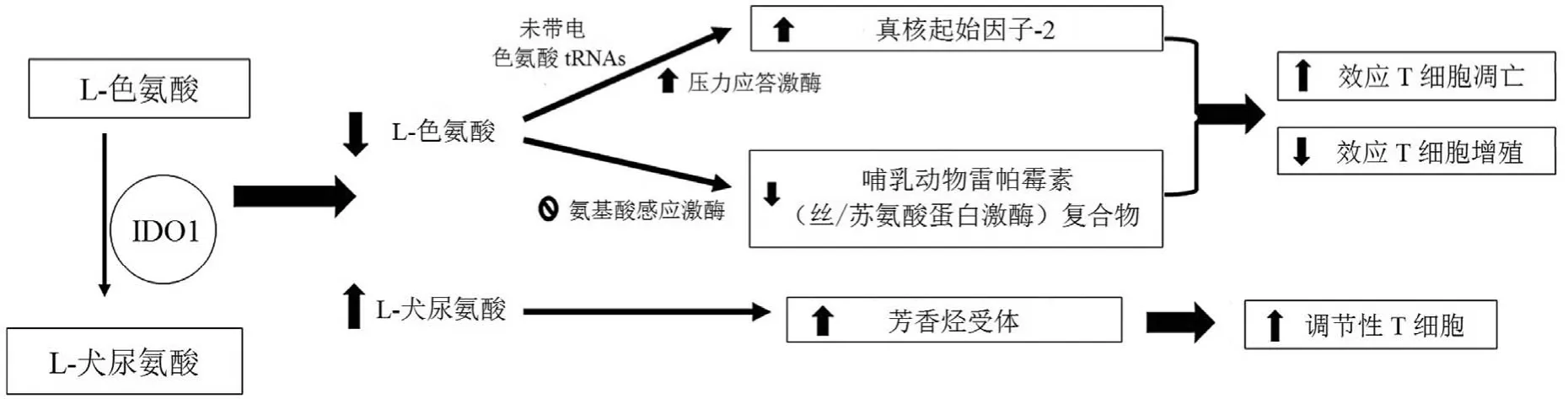
图2 IDO1 介导肿瘤免疫逃逸的机制[16]
目前关于 IDO1 蛋白介导肿瘤免疫逃逸的机制主要有下述通路:①T 细胞对低色氨酸水平特别敏感,当 T 细胞通过未带电的 tRNAs 感知低色氨酸水平后,压力应答激酶(general control nonderepressible 2,GCN2)被激活,干扰T 细胞的信号调节通路,导致 G1 期细胞周期阻滞及细胞凋亡[17]。②L-色氨酸的过度消耗抑制了氨基酸感应激酶(GLK1),进而抑制了哺乳动物雷帕霉素(丝/苏氨酸蛋白激酶)复合物(mammalian target of rapamycin1,mTORC1)信号通路,启动氨基酸饥饿效应,进而触发了 T 淋巴细胞在肿瘤微环境中的自噬及免疫无能。③KYN、3-HK、KA、QC 等色氨酸代谢产物是芳香烃受体(AhR)的内源性配体[18],AhR 的激活促进了人叉头框蛋白 P3(FOXP3)调节 T 细胞(Tregs)的分化,抑制了抗肿瘤免疫反应,最终导致效应 T 细胞无能及 Tregs 免疫抑制功能激活[19-21]。犬尿氨酸代谢通路是肿瘤细胞建立肿瘤抗原免疫耐受的关键途径之一,多种免疫抑制机制协合调控导致肿瘤细胞逃脱了机体的免疫监控。IDO1 作为肿瘤细胞中过表达的免疫检查点,其抑制剂的开发已成为抗肿瘤治疗的重要手段。
3 IDO1 抑制剂临床前生物学评价
3.1 酶抑制活性评价
酶抑制活性评价是最常见且基础的生物学评价方法。IDO1 的酶学试验包括高效液相色谱分析、KYN 加和物试验法、NFK 试验法、KYN 试验法、NFK 或 KYN 衍生荧光试验法及 NFK-green(染料)法等[15]。其中,KYN 加和物试验法已成功应用于临床抑制剂如 NLG-919 等的酶学试验评价。该研究将浓度为 100 μmol/L ~ 200 pmol/L 的待测化合物加至含有 70 nmol/L IDO1 蛋白的 37 ℃ 孵育体系中反应 15 min,加入 5% 总体积的 30% 三氯乙酸终止反应,并于 60 ℃ 下孵育 30 min 以促进 NFK 的生成。离心后取上清加入等体积 2%(W/V)二甲胺基甲硼烷(DMAB)醋酸溶液,25 ℃ 反应 10 min 得到黄色加和衍生物,并于 480 nm 下检测其荧光强度,进而测定其酶抑制活性,最终测得 NLG-919 的 IC50值为 28 nmol/L[22]。研究显示,该方法具有良好的重复性,但准确度易受到 3-HK与 3-HAA 吸光度的干扰[15]。
3.2 细胞活性评价
细胞水平活性评价是另一常见生物学评价方法。HEK293 试验及 HeLa 试验是最为常用的 IDO1 细胞活性评价方法。HEK293 试验是将 IDO1 真核表达质粒转染至HEK293 细胞中从而过表达 IDO1 蛋白,而 HeLa 试验是IFN-γ 的刺激下过表达 IDO1 蛋白,进而建立 IDO1 蛋白细胞水平筛选评价体系。此外,其他研究也已成功应用了IFN-γ 激活下的 MDA-MB-231 细胞、A172 细胞与 A431细胞筛选体系[15]。基于 HeLa 试验进行的 INCB024360 抑制活性测定目前已被报道。于 HeLa 细胞密度为 5 × 103/孔的 96 孔板中添加 IFN-γ 至终浓度为 50 ng/μl 及系列稀释化合物共孵育 48 h,后移取每孔上清 140 μl 并分别加入6.1 mol/L 三氯乙酸 10 μl,于 50 ℃ 下孵育 30 min。离心后取 100 μl 上清后,各加入等体积 2%(W/V)DMAB 醋酸溶液,480 nm 下测定其黄色加和物的荧光强度,最终测得临床抑制剂 INCB024360 IC50值为 7.4 nmol/L[23]。
3.3 X-射线衍射技术
X-射线衍射技术是解析蛋白质三维晶体结构的主要技术,近年来已逐步应用于复杂生物大分子及复合物晶体结构的测定。该技术从原子层面上辅助科研人员深入理解蛋白质的生物学功能,以及精确认识蛋白-小分子相互作用的空间取向与结合特征,可辅助验证配体与受体靶点的结合,进而通过进一步分析,对小分子抑制剂进行基于结构的药物设计,最终得到活性更佳的候选化合物[24]。Peng 等[25]为深入解析小分子抑制剂与 IDO1 间的相互作用,共晶得到了复合物晶体结构,通过后续构效关系分析及优化,寻找到了可更好拟合 IDO1 蛋白口袋的取代基,最终得到具有更高效力的候选化合物。
3.4 表面等离子体共振
表面等离子体共振(SPR)技术是目前研究、分析分子间相互作用的重要手段,其原理为 SPR 信号与结合在金属薄膜表面的生物分子质量成正比,进而可实时监测生物分子间的相互作用,精确获得其亲和力及动力学等数据[26]。目前,此技术已广泛应用于 IDO1 蛋白小分子抑制剂的高通量筛选,及分子层面与其抑制剂的相互作用研究。Gao 和Li[27]通过酶活实验及细胞实验测定茚酮类小分子化合物的IC50及 EC50分别为(2.780 ± 0.408)μmol/L 和(9.171 ±0.356)mmol/L。为进一步验证抑制剂与 IDO1 蛋白之间的相互作用,此研究利用 Biacore T200 光学生物传感器,在HBS-EP 缓冲液体系下将 IDO1 蛋白固定于 CM5 芯片上,最终测定该茚酮类抑制剂的平衡解离常数(KD)为9.828 μmol/L,证实了其与 IDO1 靶标蛋白的结合亲和力。
3.5 等温滴定量热法
等温滴定量热法(ITC)是直接测定生物分子(如蛋白-小分子,蛋白-蛋白)缔合过程中释放或吸收热量的一种简便而广泛应用的方法,并可定量测定相互作用的亲和力。ITC 是当前唯一可以在单个实验中同时测定所有结合参数的技术,它提供了有关分子相互作用的完整热力学信息。此外,ITC 无需对受体蛋白进行荧光标记或固定,因而可测定自然状态下反应物之间的准确、真实的亲和力结果[28]。目前也已有文献报道了应用 ITC 技术进行 IDO1 酶生物学评价的应用[29]。
4 进入临床试验的 IDO1 抑制剂
近年来,随着 PD1、PDL1 单抗上市、CAR-T 疗法获批,免疫肿瘤学领域的研究非常活跃。基于 IDO1 在免疫抑制和癌症中的关键作用,其成为了肿瘤免疫治疗的极具吸引力的新型药物靶点。近年来,多种新结构类型 IDO1 抑制剂被发现,少部分已经进入临床阶段(表1),如indoximod、epacadostat 和 navoximod 等,目前尚未有成功上市的药物。本文根据小分子抑制剂化学骨架,分别综述了不同结构类型的 IDO1 抑制剂的主要临床研究进展。

表1 IDO1 抑制剂及其临床研究项目
4.1 色氨酸衍生物
色氨酸衍生物类抑制剂是最早报道的一种 IDO1抑制剂,其中最具有代表性的是 1-甲基-色氨酸(1-methyl-DL-tryptophan,1-MT)。1-MT 存在两种同分异构体,即 D-1-MT 与 L-1-MT(图3)。研究结果显示,体外细胞实验中,L-1-MT 可更好地抑制 IDO1 的酶活性,而 D-1-MT 具有更佳的体内外 T 细胞增殖激活及抗癌活性[19]。当肿瘤细胞中由于 IDO1 过表达而造成色氨酸耗竭时,D-1-MT 作为色氨酸模拟物,可恢复 mTORC1 蛋白活性,能够抑制下游 IDO1 介导的 mTORC1 靶蛋白信号通路和氨基酸敏感通路。
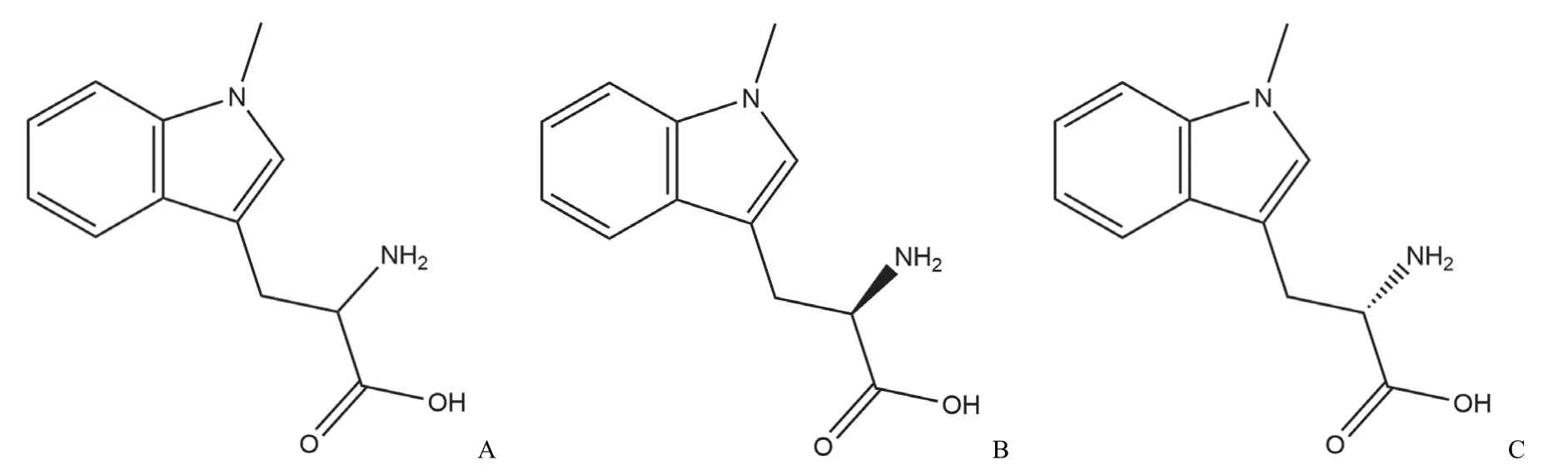
图3 1-MT(A)、D-1-MT(B)、L-1-MT(C)的化学结构
目前 D-1-MT 是一种由 NewLink Genetics 公司研发的 IDO1 临床在研抑制剂(indoximod,NLG8189),研究数据显示,indoximod 与多种药物联合用药时,可在一定程度上逆转多种癌症相关的免疫抑制作用。第一例应用于人体的临床试验研究了 indoximod 治疗恶性实体肿瘤的安全性、毒性及最大有效剂量。在剂量增加试验中,口服剂量达每日两次、每次 2000 mg,仍表现为耐受性较好。每日摄入200 mg indoximod 的 7 名受试者试验数据显示,4 名患者表现出了病情稳定,3 名出现了病情进展,分析推测与D-1-MT 对炎症反应的不同影响有关[30]。另外一项临床研究试验中,在晚期黑色素瘤患者中,联合使用 indoximod 和PD-1 抗体派姆单抗的总缓解率为 61%,包括 10 个完全缓解(20%)和 21 个部分缓解(41%)。联合治疗的中位无进展生存期为 12.9 个月,1年生存率为 56%,提示indoximod 与派姆单抗协同抗肿瘤治疗效果明显[31]。
4.2 羟基脒类及其衍生物
Epacadostat(INCB024360)是由 Incyte 公司开发的临床上最先进的羟基脒类口服 IDO1 抑制剂(图4)。Epacadostat 是 IDO1 底物 L-色氨酸的竞争性底物,竞争结合 IDO1 的酶活性催化结构域,干扰肿瘤细胞内色氨酸的异常代谢,进而降低 Kyn 水平并抑制肿瘤生长[20]。Epacadostat 已在小鼠模型中显示出抑制肿瘤生长的作用。在头颈癌相关临床试验中,一份关于 38 例既往治疗患者的临床报告表明,联合使用 PD-1 抗体时,epacadostat 可提高整体应答率和疾病控制率,且未增加明显副作用[32];针对黑色素瘤的临床试验数据显示,epacadostat 与 CTLA-4抗体伊匹单抗联合使用,7 名患者中的 6 名在停止治疗前均显示疾病稳定,7 名患者的后续治疗时间均大于 90 d,其中有 4 名大于 180 d;另一组相同剂量下试验数据显示,8 名患者中的 6 名在 9 周后评估时呈现肿瘤体积减小,后续跟踪数据显示,疾病控制率约为 62.5%,应用联合免疫治疗方案的新患者较之前未接受过免疫治疗的患者的中位无进展生存期提高了 5.7 个月。研究人员进而得出结论,epacadostat 可以安全地与伊匹单抗联合使用,并可能增强晚期或转移性黑色素瘤患者的伊匹单抗临床活性[33]。

图4 Epacadostat 化学结构及与 IDO1 结合模式图(PDB ID:5WN8)
4.3 4-苯基咪唑类及其衍生物
Navoximod(NLG919,GDC-0919)是一种由 NewLink Genetics 公司研发的苯基咪唑类 IDO1 抑制剂(图5),该化合物通过与 IDO1 活性位点的血红素结构中亚铁分子结合从而抑制 IDO1 的酶活性,进而抑制色氨酸异常代谢和恢复 T 细胞的功能。体内研究显示,口服 NLG919 可使血浆和组织中的犬尿氨酸浓度降低约 50%,且 NLG919治疗显示效应性 T 细胞的剂量依赖性激活和增殖,并导致肿瘤大小的急剧消退[34]。在同系小鼠 B16-F10 黑色素瘤模型中,navoximod 增强了紫杉醇的抗肿瘤疗效而不增加副作用。Navoximod、抗 PD1/PD-L1/PD-L2 抗体、indoximod与化疗和糖蛋白 100 (gp100)肽疫苗的联合使用获得了显著的协同抗肿瘤效果[32]。目前 navoximod 单独使用及与阿特珠单抗联用治疗实体瘤的 1 期临床试验均已完成,但暂时无公开的数据。
4.4 喹啉类及其衍生物
BMS-986205 是由 Bristol-Myers Squibb 公司研发的一种新型 IDO1 抑制剂(图6)。临床前研究表明其存在剂量依赖性疗效,即使在低浓度下,BMS-986205 也能成功抑制 IDO1 并降低 KYN 血清水平,相较于 epacadostat 具有更好疗效和药代动力学[8]。该药物已成功完成多组 I 期临床试验,目前正在进行多个 II 期和两个 III 期临床试验,已在黑色素瘤或肌肉浸润性膀胱癌患者中与纳武单抗联合试验。其中,BMS-986205 与纳武单抗用于治疗晚期膀胱癌的临床数据显示,两者联用后对晚期膀胱癌具有初步疗效,且可改善 100 mg 剂量下 BMS-986205 的副作用耐受性[35]。

图6 BMS-986205 化学结构及与 IDO1 结合模式图(PDB ID:6DPR)
4.5 其他类
PF-06840003 是一种色氨酸非竞争性、非血红素结合IDO1 抑制剂,由 iTeos SA 授权辉瑞进行临床开发(图7)。该化合物具有良好的人体药代动力学特性,具有较长的半衰期,可每日单剂量给药,且具有神经系统穿透特性,因而有望用于脑转移瘤的治疗[36]。在几项临床前小鼠肿瘤模型中,PF-06840003 显著降低了肿瘤内 KYN 水平,并抑制了肿瘤生长,无论是在单一疗法中,还是在与 PD-L1 或 CTLA4阻断剂的组合方案中,疗效均有所提高。PF-06840003 单独应用于复发恶性胶质瘤的临床 I 期数据显示,此抑制剂应用剂量至 500 mg BID(一日两次)时耐受性普遍良好,具有临床药效学效应[37]。

图7 PF-06840003 化学结构及与 IDO1 结合模式图(PDB ID:5WHR)
BGB5777 也是一种有效的穿透中枢神经系统的 IDO1抑制剂,联合纳武单抗进行放疗,在晚期胶质母细胞瘤患者中实现了持久的生存获益[38]。
5 展望
肿瘤免疫治疗是一种很有前景的癌症治疗方法,得益于对肿瘤免疫及色氨酸代谢机制的日益深入的理解,多项研究发现 IDO1 参与并介导了多种免疫逃逸机制,因而其小分子抑制剂的开发是解除肿瘤微环境免疫抑制的研发热点。虽然当前仍未有成功上市的药物,但多种抑制剂的临床前及初步临床数据表明,IDO1 抑制剂的单独用药及与其他免疫检查点抑制剂、疫苗等的联合使用均呈现出较好的抗肿瘤疗效。当然,某些抑制剂的临床试验失败也提醒我们,需要对基础机制进行更为深入的研究,合理制订联合应用免疫调节策略,进行更为科学、全面的免疫监测临床试验。相信随着检测技术及科研方法的不断创新,疗效好、毒副作用小的IDO1 抑制剂及与其他抗肿瘤疗法联用的成功上市将指日可待,为攻破肿瘤免疫带来新希望!

