抗分枝杆菌海洋微生物的分离与鉴定
关艳,蒙建州,刘忆霜,肖春玲,杨延辉
近年来,耐药结核病的发病率与死亡率明显回升,使其再次成为严重威胁人类健康的传染病之一。但在过去的 60 多年,仅开发出了两种能用于临床的抗结核药物——贝达喹啉[1]和德拉马尼,因此开发新型抗结核药物任重道远。耻垢分枝杆菌作为模式菌进行抗结核药物的前期筛选评价,具有生长速度快,可在普通实验条件下进行,与结核分枝杆菌的同源性高等优点,发现的诸多抗结核活性化合物也会对耻垢分枝杆菌体现出敏感性,例如苯并噻酮类化合物对结核分枝杆菌和耻垢分枝杆菌都体现出较好的抗菌活性,并且具有较高的抗耐药菌株的能力和极低的毒性[1-3]。因此,可用于抗结核先导化合物的初步快速评价。
微生物次级代谢产物是开发新型抗生素的重要来源。利用海洋微生物资源,联合使用耻垢分枝杆菌替代模型筛选并发现具有抗结核分枝杆菌活性的次级代谢产物,将为抗生素的开发提供新骨架来源。新菌株的分离鉴定是获得新功能微生物次级代谢产物的前提。由于核糖体 16S rDNA 基因几乎存在于所有原核生物的细胞中,并且在结构上,同时具有相嵌的高度保守区域和可变异或高度变异的区域,在生物进化的漫长历程中相对恒定,可作为生物演化的分子钟。根据 16S rDNA 基因序列的比对来确定原核生物物种之间的亲缘关系,尤其是较远的亲缘关系分析是可靠的[4]。早在 1987年,已有研究者分析了微生物的 16S rDNA 序列间的系统发生学关系,并提出生物分类的三界论:真细菌生物界、古菌生物界和真核生物界[5]。更有学者提出可以应用 16S rDNA 序列对海洋细菌进行种属的鉴定[6]。因此,原核生物的核糖体 16S rDNA基因可被应用于微生物菌株初步鉴定。
本文从深海底土样中分离得到一株细菌——IMBGY10-46,经抗菌活性评价发现该菌株的发酵产物具有显著抑制耻垢分枝杆菌的特征。对细菌的形态、菌落、16S rDNA 序列同源性、基因组Tm值等进行了研究。再通过构建系统进化树,初步鉴定了其分类进化地位,为进一步从海洋微生物中寻找并开发新型的抗结核药物奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株 从印度洋靠近赤道地区(经度85°02',纬度 11°03',水深 4888 m)的样品中分离得到;新生霉素敏感型耻垢分枝杆菌 MC2155 由本科室诱变保存。
1.1.2 主要仪器设备 pico21R 高速低温离心机为美国 Thermo 公司产品;HH-ZK2 电热恒温水浴槽为上海平轩科学仪器有限公司产品;PCR 仪和Gel Doc XR+ 凝胶成像系统为美国 Bio-Rad 公司产品;DYCP-31BN 琼脂糖凝胶电泳仪为北京六一生物科技有限公司产品;实时定量分析仪为澳大利亚 Corbett 公司产品。
1.1.3 主要试剂和培养基 16S rDNA 通用引物:27F-AGAGTTTGATCCTGGCTCAG 和 1492R-GG TTACCTTGTTACGACTT 由上海生工生物工程有限公司合成;蛋白酶 K、dNTP-mix、Platinum DNA聚合酶购自美国 Invitrogen 公司;AxyPrep 凝胶回收试剂盒购自美国 Axygen 公司;荧光染料购自美国 Roch 公司;琼脂糖购自美国 Amresco 公司;2216E 琼脂和液体培养基、单糖发酵管、吲哚试剂和触酶试剂均购自青岛海博生物技术有限公司。
1.2 方法
1.2.1 样品的富集 海底沉积物按取样的深度不同,分成 3 份(0 ~ 10 cm、10 ~ 19 cm和 19 ~34 cm),4 ℃ 保存。每份取 1 g 置于 10 ml 的2216E 液体培养基中,于 16 ℃、200 r/min 振荡1 h 后,以 1000 r/min 离心 10 min,取上清,再用无菌棉花过滤,滤液稀释为 10-1、10-2和 10-33 个浓度。
1.2.2 菌株分离 取上述 3 个浓度的样品 100 μl分别涂布于加 50 μg/ml 新生霉素和 50 μg/ml 制霉菌素、加 50 μg/ml 氨苄青霉素、不添加任何抗生素的 3 种 2216E 固体培养基平板上。20 ℃ 培养 1 ~ 8 周挑取单个菌落用 2216E 固体培养基平板进行划线后,于 20 ℃ 培养一周,重复这一过程,对菌株进行纯化,所得纯培养物用无菌的 15 % 甘油水溶液保存于 -80 ℃。
1.2.3 发酵培养 将斜面保存的 IMBGY10-46接种到 2216E 和 54 号液体培养基中,20 ℃、200 r/min 培养 8 ~ 20 d 后,4000 r/min 离心5 min,收集发酵液。
1.2.4 抗耻垢分枝杆菌活性测定(纸片法) 将直径为 7 mm 无菌纸片浸入发酵液样品中,取出后放在添加 0.1% 的OD600为 1.6 的耻垢分枝杆菌菌液的 54 号琼脂平板上,48 h 后测量抑菌圈大小。
1.2.5 电镜观察的样品处理 向菌泥中加入0.2 mol/L pH 为 7.0 的磷酸缓冲液冲洗 3 遍,每次4000 ×g离心 5 min;向洗好的菌泥中加入 0.5 ml 2.5% 的戊二醛进行预固定;再经 3 次 0.2 mol/L pH 为 7.0 的磷酸缓冲液漂洗后,用 1% 锇酸后固定 1 ~ 2 h;漂洗后,采用梯度乙醇脱水(30%、50%、70%、80%、90%、95% 和 100%),每个浓度处理15 min;经临界点干燥后,进行离子溅射法镀膜。最后样品放入扫描电镜样品室中进行观察。
1.2.6 细菌理化特性测定 从 2216E 固体培养基平板上挑取单菌落,分别接种于单糖发酵管、H2S和尿素发酵管中 37 ℃ 培养 48 h。通过裸眼观察同阴性对照比色的方法进行鉴定,单糖发酵管呈现黄色为阳性,蓝色为阴性;尿素发酵管呈现红色为阳性,黄色为阴性。挑取单菌落在载玻片上与触酶试剂混匀,有气泡产生的为阳性,无气泡的为阴性。
1.2.7 基因组 DNA 抽提 液体发酵培养离心得到的菌泥用无菌水清洗 3 次,4000 r/min 离心5 min,弃上清液。得到的约 50 μl 沉淀中加入 300 μl裂解液(40 mmol/L Tris-acetate pH 7.8、20 mmol/L乙酸钠、1 mmol/L EDTA、1% SDS)后[7],加入 10 μl蛋白酶 K,于 56 ℃ 水浴中,孵育 1 h,100 ℃ 煮沸 10 min,12 000 r/min 离心 10 min,得到的上清即为菌株的基因组 DNA 抽提液,该溶液经紫外吸收法定量(40.2 μg/ml)后,可直接应用于后续的PCR 反应模板。
1.2.8 荧光法测定基因组Tm值 取 5 μl 基因组与 5 μl 稀释过的 SYBR Green 1 染料充分混合,在实时定量 PCR 仪上测定融解曲线。测定条件设为 25 ~ 99 ℃,温度梯度为 1 ℃,每个梯度的停留时间是 1 min。
1.2.9 16S rDNA 基因扩增 用 16S rDNA 通用引物 16SF 和 16SR 进行 PCR 扩增。反应体系为:10 × PCR buffer(不含Mg2+),2.5 μl;dNTP(各2.5 mmol/L),0.5 μl;引物 16SF(10 μmol/L)和16SR(10 μmol/L),分别 0.5 μl;Taq 酶(5 U/μl),0.2 μl;模板 DNA(40 ng),1 μl;ddH2O,19.8 μl;总体积 25 μl。扩增条件:94 ℃ 预变性 5 min;94 ℃ 变性 30 s,52 ℃ 退火 30 s,72 ℃ 延伸1 min,共 30 个循环;72 ℃ 充分延伸 10 min,4 ℃保存。
1.2.10 PCR 产物测序 通过 1.5% 琼脂糖凝胶电泳进行检测,得到条带清晰,且大小正确的片段,进行切胶。用 Axygen 凝胶回收试剂盒参照说明书对 PCR 产物进行回收纯化。回收的 16S rDNA 基因片段委托上海英俊工程公司测序。
1.2.11 系统进化树的构建 将测得的序列提交NCBI 的 GeneBank 数据库,选择 others 进行相似性比对检索。比对结果显示前 100 株菌中有75 株为假单胞菌属,选取一致性在 96% 以上的51 个代表性序列与 IMBGY10-46 的 16S rDNA基因序列进行比对,应用 MEGA 7.0 软件构建系统进化树,确定该菌株的进化位置。
2 结果
2.1 IMBGY10-46 的抗耻垢分枝杆菌活性
分离获得所有菌株经发酵培养后,离心获得发酵液上清。用纸片法测定抗耻垢分枝杆菌的活性,菌株 IMBGY10-46 在各个时间段不同培养基中均具有抗分枝杆菌的活性(图1)。结果显示在 2216E液体培养基中培养 12 d 的发酵液抗菌活性最强(图1D)。
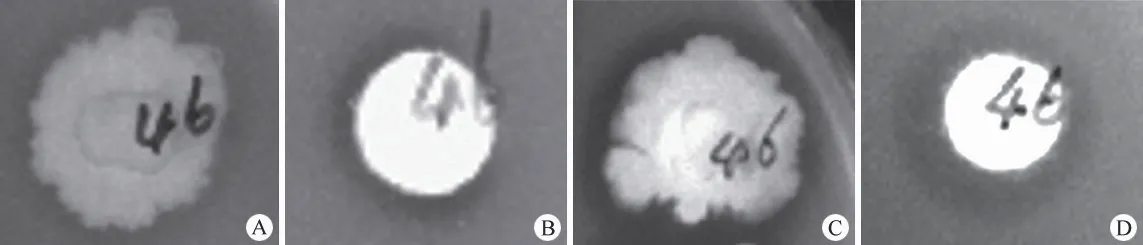
图1 IMBGY10-46 发酵液的抗分枝杆菌活性测定(A:54 号液体培养 8 d;B:54 号液体培养 11 d;C:54 号液体培养19 d;D:2216E 液体培养 12 d)Figure 1 The assay of anti-mycobacterium activity by IMBGY10-46 fermentation (A: Grown for 8 d in 54 liquid culture; B:Grown for 11 d in 54 liquid culture; C: Grown for 19 d in 54 liquid culture; D: Grown for 12 d in 2216E liquid culture)
2.2 IMBGY10-46 菌落形态
经过 2216E 固体培养基上 37 ℃ 培养 40 h得到的菌落呈白色、质地较硬、半透明,在普通光学显微镜下放大 100 倍以上可观察到圆形中间凸起、边缘不规则如卷发状(图2)的菌落。革兰氏染色呈红色说明其为革兰氏阴性菌。

图2 IMBGY10-46 的菌落(A:54 号固体平板;B:放大 20 倍;C:放大 100 倍;D:放大 400 倍)Figure 2 The colony of IMBGY10-46 (A: 54 agar plate; B: The magnification is 20; C: The magnification is 100; D: The magnification is 400)
2.3 IMBGY10-46 菌体形态
经环境扫描电子显微镜观察,结果表明细菌的形态多数为微弯的杆状,(0.5 ~ 1.0)×(1.0 ~ 1.5)μm;少部分呈现出圆球状。菌体表面附有菌毛,极易黏附在一起(图3)。
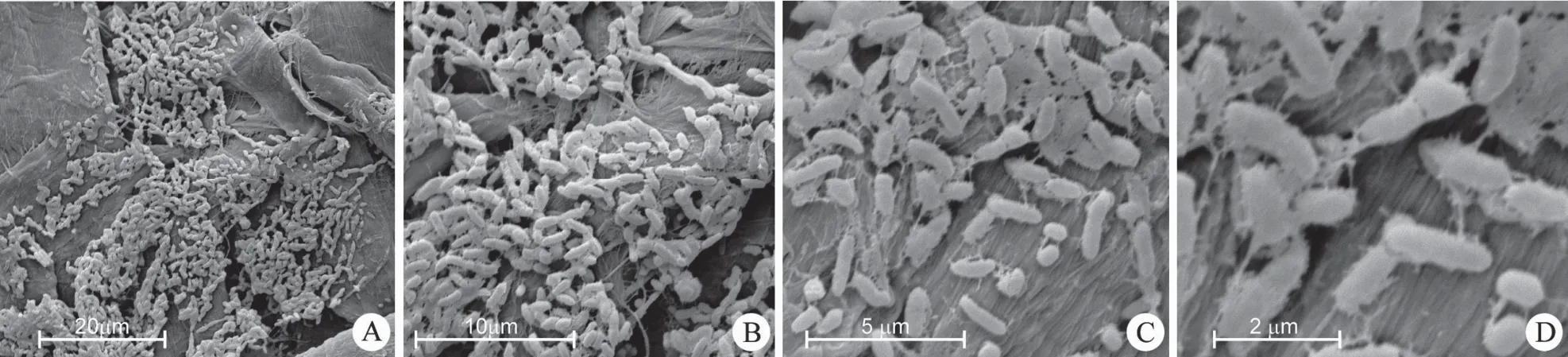
图3 IMBGY10-46 的形态Figure 3 Morphology thallus of IMBGY10-46
2.4 温度和培养基对 IMBGY10-46 生长的影响
在 4 ℃ 和 42 ℃ 条件下,IMBGY10-46 均可生长,其中 35 ℃ 条件下细菌生长最好(图4)。相同培养时间下,4 ℃ 和 35 ℃ 条件下,IMBGY10-46 在 54 号固体培养基中生长优于2216E 固体培养基。在 42 ℃ 条件下,2216E 固体培养基中 IMBGY10-46 可生长,而 54 号固体培养基中不能生长。

图4 温度和培养基对 IMBGY10-46 菌落的影响Figure 4 The effect of temperature and media to the colony of IMBGY10-46
2.5 IMBGY10-46 的理化特性鉴定结果
IMBGY10-46 经单糖发酵试验和生化反应鉴定,结果显示该菌株不能够利用葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖和枸橼酸盐;尿素和吲哚试验均为阴性;触酶试验(又称过氧化氢酶试验)结果为阴性,其中过氧化氢酶试验与大多数假单胞菌不同。
2.6 IMBGY10-46 的基因组和 16S rDNA
取 5 μl 提取的基因组,用 1.5% 的琼脂糖凝胶电泳检测,结果显示基因组的完整性较好(图5A),基因组大于 10 kb。
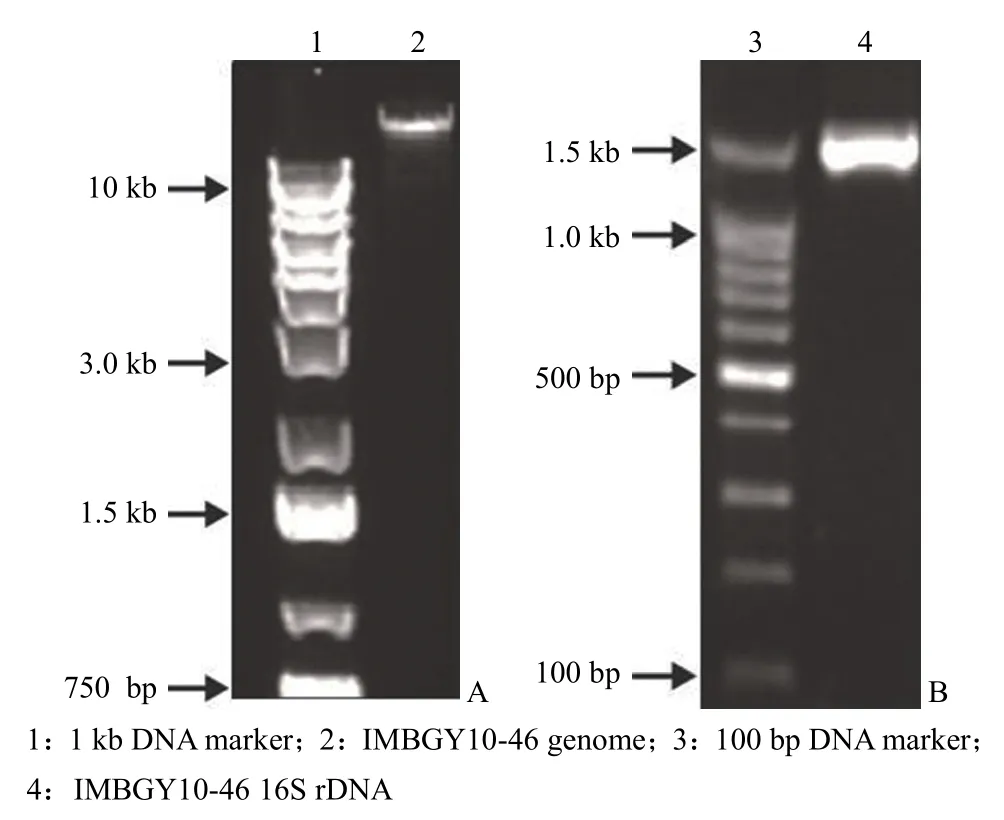
图5 IMBGY10-46 的基因组(A)和 16S rDNA(B)Figure 5 The genome (A) and 16S rDNA (B) of IMBGY10-46
取 5 μl PCR 扩增产物用 1.5% 的琼脂糖凝胶进行电泳检测,电泳结果见图5B,目的片段的长度约为 1.5 kb,说明菌株 IMBGY10-46 的 16S rDNA 已经被成功扩增。
2.7 DNA 的碱基组成
DNA 的 G+C 含量采用荧光法测定[8],通过荧光强度和时间求导得到菌株IMBGY10-46 的Tm值为(88.2 ± 0.8)℃(图6)。应用不含甲酰胺的拟合方程式:%GC = 1.98 ×Tm- 106.91 计算出菌株IMBGY10-46 DNA 的 G+C 含量约为 67.7%,这与假单胞菌属菌株 DNA 的 G+C 含量(58% ~70%)[9]相一致。但这与Pseudomonas sabulinigriJ64的 DNA G+C 含量 58.1%[10]有显著差异。
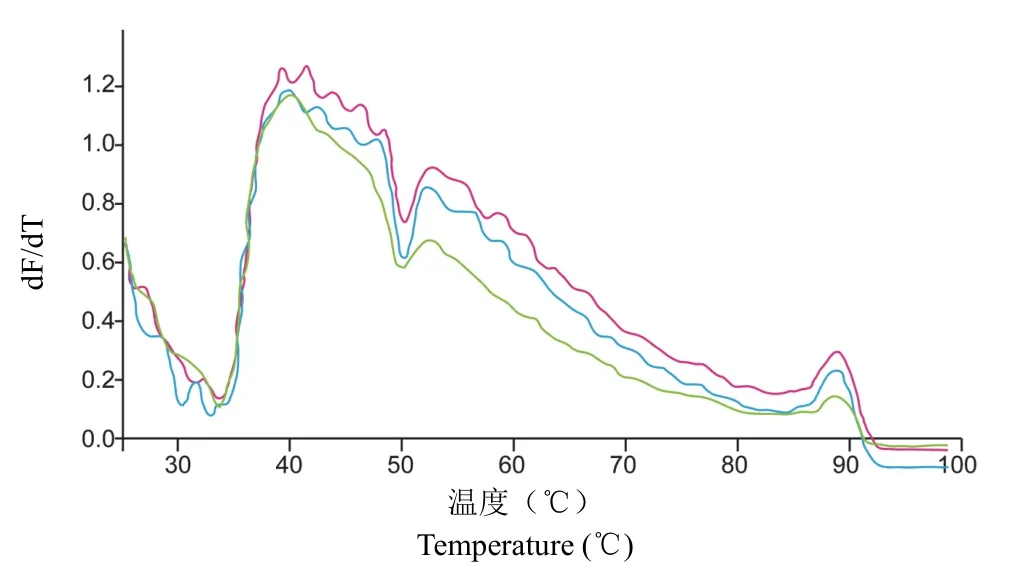
图6 菌株IMBGY10-46基因组融解曲线(红色、蓝色和绿色线代表3 次生物学重复)Figure 6 The melting curve of IMBGY10-46 (The red, blue and green lines represent 3 biological repetitions)
2.8 序列测定及结果分析
菌株 IMBGY10-46 的 16S rDNA 序列经测定为 1417 bp,具体核苷酸序列提交GenBank(Accession No. JQ362457)。并在 Pubmed 数据库进行 BLAST 比对,发现与Pseudomonas sp. ljh-16的相似性最高,其覆盖度为 99%,一致性为 98%,可以认为该菌株属于假单胞菌属。随后将序列递交EzTaxon 数据库,检索得到同源性最高的菌株是Pseudomonas sabulinigriJ64,同源性为 98.29%。按照 16S rDNA 判定标准,与模式菌株同源性小于98% 应判定为新种,但 IMBGY10-46 培养后提取基因组测定 DNA 的 G+C 含量与Pseudomonas sabulinigriJ64 有显著差异;这株菌与假单胞菌属菌株同源性明显大于与其他属菌株同源性,因此初步断定这株菌为假单胞菌属新菌种。
选择 51 个同源性较高的代表性菌株序列,用Clustal W 进行多序列比对后,利用 MEGA7.0 绘制的系统进化树见图7。
3 讨论
海洋微生物的种类丰富,其中也存在分枝杆菌,例如海分枝杆菌等[11]。微生物在共生的过程中会有拮抗作用,由此推断,从海洋微生物中极有可能获得抗分枝杆菌的新物质。
本研究从海底沉积物中共分离到了 34 株菌。对菌株进行发酵后,开展药敏试验,分离到一株具有抗耻垢分枝杆菌 MC2155 的菌株 IMBGY10-46。
为了阐明菌株 IMBGY10-46 的生物学特性和分类地位,对该菌株开展鉴定。经 16S rDNA 序列比对发现,该菌株同Pseudomonas sabulinigriJ64的相似性最高,达 98.29%,认定该菌株属于假单胞菌属。但由于其形态和基因组 DNA 的碱基组成差异较大,理化特性鉴定证实不能发酵葡萄糖,这与铜绿假单胞菌不同。与Pseudomonas sabulinigri不同的是,菌株 IMBGY10-46 过氧化氢酶阴性,说明 IMBGY10-46 很有可能属于一个新菌株[10]。根据系统发育进化树分析,该菌株与北极海水细菌R7078 这一分支内的假单胞菌之间具有最近亲缘关系(图7)。次级代谢产物和功能基因分析为将来从海洋来源的假单胞菌中获得抗分枝杆菌的天然活性物质提供了新方向。菌株 IMBGY10-46 的发酵产物中具有抗分枝杆菌的活性成分,后续需要对该活性物质进行分离、纯化和鉴定,为发现新型抗结核药物先导化合物提供了菌株基础。在假单胞菌属中,Pseudomonas aeruginosa研究最多,由于该菌易形成极端耐药并且可导致感染[12]。Pseudomonas sabulinigri菌曾被从海洋沉积物中分离出来过[10],但是该类菌的生物学应用研究至今未见报道。本文分离并鉴定了假单胞菌属同Pseudomonas sabulinigri亲缘关系更近的细菌,并揭示了该菌在抗分枝杆菌,尤其致病性结核分枝杆菌或非结核分枝杆菌复合群等致病菌的新药开发领域的应用潜力,也为基于该菌株和海洋微生物开发抗结核药物奠定了物质基础。
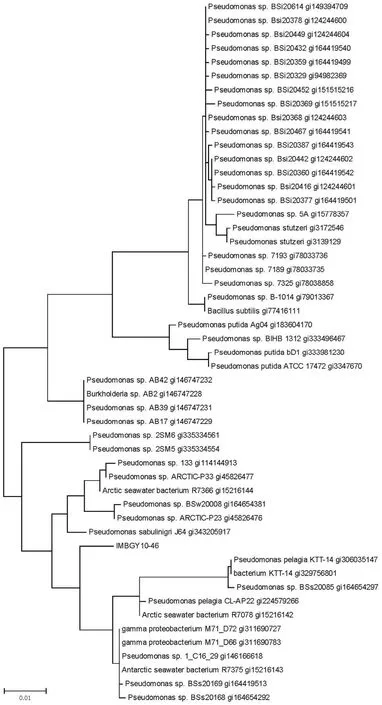
图7 菌株 IMBGY10-46 的 16S rDNA 系统发育进化树Figure 7 The 16S rDNA phylogenetic tree of the strain IMBGY10-46

