脑电图在急性缺血性卒中中的应用进展
李苏亚, 奚广军综述, 李在望审校
急性缺血性卒中(acute ischaemic stroke,AIS)是最常见的脑血管病,具有较高的致残率及病死率,多达70%的AIS患者患有中度或重度功能障碍[1]。目前已有成熟的影像学技术(CT、MRI等)用于AIS的早期诊断,但有时仍受到病情、环境、设备等条件的限制,此时通过其他技术了解和判断颅内病变严重程度和动态演变过程显得尤为重要。脑电图(Electroencephalogram,EEG)是检测、描述和监测健康人群和临床人群大脑功能的有力工具,具有极高的时间分辨率,对缺血、缺氧引起的神经功能变化非常敏感,能够简便、无创、快速、动态地评估瞬时脑功能。在过去的数十年里,EEG在AIS中的临床应用已经被广泛报道。有学者对这类研究进行了归纳分析,得出结论:EEG在AIS的早期诊断、预后判断、治疗方案指导和癫痫发作检测等方面都有着重要的参考价值[2]。本文总结了近年来EEG在AIS中的最新研究进展,并强调了定量脑电图(quantitative electroencephalographic,QEEG)的临床意义。
QEEG是采用快速傅立叶转换等方法将原始EEG的基本参数,如频率、节律、波幅等,转化为各种量化参数,有着更高的客观性、定量性及形象化特点[3]。其将原始EEG脑电波幅随时间的变化转化为脑电功率随频率的变化,得到δ、θ、α、β各个频带脑波在一定时间范围内的绝对功率值,并通过图谱的方式,将数小时甚至数天的数据压缩在一个画面内显示,进而直接观察到各频段脑电波的分布与变化情况。目前,常用的QEEG参数,例如总功率(θ和α功率等)、功率比{例如δ/ α比[DAR]和(δ+θ)/(α+β)比[DTABR]},以及脑对称性指数(brain symmetry index,BSI)均与AIS密切相关,一些新开发的EEG分析软件系统可以即时计算和显示QEEG测量结果和趋势,很多已经得到了有效的临床应用[4]。本文将结合EEG在AIS中的最新研究进展,对EEG在AIS的诊断、病情监测和预后判断等方面的作用展开综述,以期能使更多的临床医生了解和掌握EEG在AIS中的应用,进而使更多的患者获益。
1 脑电活动与脑组织缺血的相关性
大脑是人体最重要的器官,正常人全脑葡萄糖和氧耗量约占全身供给量的20%~25%。脑组织中几乎无葡萄糖和氧的储备,当脑血供中断导致脑缺氧时,神经功能在20~60 s内就会受到抑制,主要原因在于突触传递受到影响[5]。当血供中断持续超过5 min时,将会导致不可逆转的神经元损伤。因此,足够的脑血液供应对保持正常的脑部功能极为重要。脑血流量(cerebral blood flow,CBF)是指单位时间内通过单位脑组织的血液量,平均在55 ml/(100 g·min)左右,CBF的下降常常导致脑细胞代谢紊乱和神经元电活动异常[6,7]。EEG是检查脑生物电活动的技术手段,通过测定自发的有节律的生物电活动以了解脑功能状态。EEG中的脑电波是由大量神经元同步发生的突触后电位经叠加后形成的[8],它对脑缺血非常敏感,可作为AIS的监测手段。
早在20世纪70年代,已有研究发现,颈动脉闭塞时EEG改变可动态反应CBF的变化(见图1)[9]。当CBF下降到25~35 ml/(100 g·min)时,兴奋性神经递质(例如谷氨酸)异常释放[10],较快频率波缺失(特别是α波);随着CBF逐渐下降,细胞出现乳酸酸中毒,组织ATP水平降低,EEG背景频率变慢,背景节律主要表现为θ波;当CBF降至大约17~18 ml/(100 g·min)时,背景节律以δ波占优势,此时的CBF水平代表了一个关键的缺血阈值,在该阈值时神经元开始失去其跨膜电位梯度,随着CBF进一步下降,神经元进行性死亡。在颈动脉闭塞的模型中,瞬间降至缺血阈值的CBF可导致EEG发生迅速且可逆的变化(20s内)[9]。在这种程度的低流量状态下,细胞可能数小时内都不会发生梗死,EEG中仍可看到一些低频电活动(主要是δ波)。但是随着CBF继续降低到梗死阈值[10~12 ml/(100 g·min)及以下],EEG表现为电静息,细胞损伤不可逆[11]。从缺血到梗死,EEG的动态演变过程为临床干预AIS清晰地指明了治疗时间窗。
动物实验发现,CTP、CTA等影像学技术最快能够在10 min内检测到CBF下降时脑组织的缺血性变化[12]。相比之下,EEG在几秒钟内即可完成,并能够随着时间的推移连续监测。EEG的这些技术优势可用于早期准确诊断CT结果阴性的脑梗死或DWI MRI与临床检查特征不匹配时的脑梗死,而且可有效评估溶栓治疗后脑组织的血流恢复情况[13]。
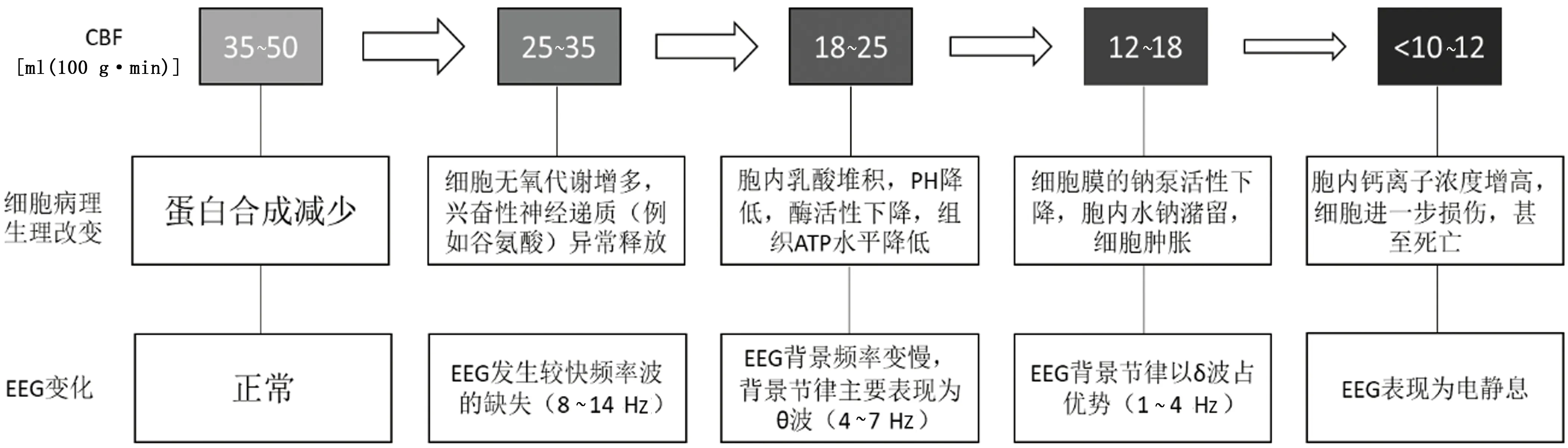
图1 CBF与细胞病理生理学和脑电图(EEG)之间的关系[9~11]
2 脑电图在急性缺血性卒中中的应用
2.1 有助于早期诊断 研究人员将急诊室中疑似AIS患者,采用高密度阵列(256导联)系统记录3 min静息EEG(AIS起病至EEG的中位时间为6.6 h),发现:AIS者δ频段功率和δ/α频段功率比值(DAR)与所有其他疑似卒中患者相比,差异具有统计学意义,并且梗死体积越大,患侧和健侧DAR值越高[14]。Wu等则采用偏最小二乘法建模分析的密集阵列EEG对24例AIS患者进行脑功能检测,发现全脑较高的δ功率或较低的β功率与较高NIHSS评分有很强的相关性,健侧额顶区的δ功率随着梗死体积的增加而显著增加,可作为AIS神经生物标记物[15]。以上结果表明:(1)在AIS发病后数小时内,EEG检测可识别大面积AIS患者,QEEG指数(δ功率、DAR)与梗死体积相关;(2)AIS发生后健侧和患侧大脑均可观察到电生理变化。更进一步地,有研究对AIS、短暂性脑缺血发作(transient ischemic attack,TIA)患者以及与之相匹配的健康对照组进行了EEG监测对比(TIA以卒中样的神经体征和症状为特征,没有明显的结构性神经病理改变),发现:(1)AIS患者存在显著的δ功率增强,而TIA患者的α和β功率升高;(2)与健康对照组相比,两组患者都表现出θ活动减弱[8]。在TIA和AIS后观察到的急性θ衰减模式,以及仅在AIS后δ增强的模式,可认为是判定神经组织可逆性损伤和不可逆性损伤的特征性EEG模式。既往已有研究发现两个临界灌注阈值,一个是与缺血半暗带内的可逆性神经功能缺损相关的“缺血阈值”,另一个是与缺血核心内的不可逆性功能衰竭和结构损伤相关的“梗死阈值”[11]。该研究中观察到的θ衰减可能反映了在缺血阈值以下经历低灌注的大脑中发生的急性变化,这种变化可以导致暂时性的功能改变,但不会造成结构损伤。相反,当达到不可逆性损伤的关键灌注阈值时,神经细胞死亡,梗死形成。综上我们推测,θ功率的降低可作为短暂性神经功能恶化潜在的敏感但非特异性的生物标志物,而较高频率的α和β活动增多可能是恢复过程的生物标志物。
2.2 动态监测病情 梗死组织周边存在缺血半暗带是AIS现代治疗的基础,及时恢复血流和改善组织代谢就可以抢救梗死周围仅有功能改变的半暗带组织,避免形成坏死。溶栓治疗是目前最重要的恢复血流的方法,而溶栓前后的病情监测是保障治疗成功的必要措施。目前CT灌注扫描(CTP)因可以方便快速并准确地识别可挽救组织和缺血核心的范围,而被越来越多地采用[16]。然而,神经影像学在监测AIS危重时期脑缺血的演变情况具有一定的局限性,因此,EEG可能是一种可行的功能监测工具。有研究对15例AIS患者,在4.5 h内进行CTP和EEG记录,将EGG与CTP结果进行比较发现:所有患者EEG表现均以慢δ频率为主,且EEG上的异常δ波与CTP所确定的脑低灌注区相对应。这项初步研究的结果表明,EEG可提供有关大脑缺血受累区域的信息,有助于临床动态评估病情和指导临床治疗[13]。此外,有临床试验发现,EEG可及时反应溶栓治疗后缺血组织再灌注的变化。例如,在静脉滴注重组组织型纤溶酶原激活剂 (rt-PA) 25 min后可观察到δ功率显著降低,比临床症状改善早2 h[17]。更进一步地,Sheikh等[18]报道了两例接受再灌注治疗的AIS患者的EEG监测结果:1例(入院时NIHSS评分为15分)静脉滴注rt-PA前DAR>12,用药后暂时下降,但仍保持异常状态(8.58),随后回升并维持在12以上,随访时明确再灌注治疗失败(出院时NIHSS:11,3 m时为中度残疾);另1例溶栓治疗失败后(DAR>7.5,NIHSS:19)行动脉内取栓术,术后DAR降至3.7以下,随访提示再灌注成功(出院时NIHSS:2)。以上结果表明,在一些潜在的临床症状出现之前,持续EEG监测可以及时为溶栓治疗的疗效提供有效而可靠的临床信息,为进一步治疗(例如是否动脉取栓)的临床决策提供客观依据。由此,Simon等[19]对比分析AIS患者组与对照组间多项QEEG指标(EEG在治疗前后以及全程记录)发现:相对频带功率(δ、θ、α、β)、DAR、(δ+θ)/(α+β)比值(DTABR)等各项指标差异均有统计学意义(P<0.001),其中DAR特异性及敏感性最高,最佳阈值为3.7。当DAR正常化并保持在临界阈值以下时,再灌注治疗可能更容易成功,若一直高于阈值则提示治疗失败。同样,有一项来自澳大利亚的病例报告指出,动脉取栓术后DAR较术前明显降低(术前10.8,术后3.3),随访提示再灌注治疗成功,再一次证明了DAR的可靠性[20]。
除了溶栓和取栓,研究人员利用EEG来确定各种治疗方法在AIS中的潜在治疗效果。例如Liao和他的同事利用EEG评估了大鼠大脑皮质在缺血性损伤后对周围感觉刺激的神经和血管反应,发现在卒中后2.5 h内进行刺激可促进神经恢复和神经血管功能的保存,提示了AIS的最佳治疗时间窗[21]。此外,临床上一部分AIS患者也可采用适当升压的方法促进低灌注区域的血流恢复。然而,过度升压疗法也可能导致AIS的进一步加重或是脑水肿。而应用EEG对AIS患者进行有效监测,并对AIS患者进行个体化升压干预后发现:所有AIS患者在升压处理前均有EEG背景活动减慢,而在个体化升压干预后,这一现象有所改善,并与患者的神经学检查的改善相一致[22]。
EEG与已知的成像技术(包括CTP、MRI等)相比,几乎无禁忌证,更方便并能实时反应病情动态。然而目前临床上AIS患者的EEG检查并不常规,部分原因在于传统EEG记录很耗时,需要专门的工作人员,并且需使用电解质溶液来降低电极电阻,如果在卒中急性期进行,可能会让患者感到不适。干电极脑电技术可直接应用于皮肤,不需要借助任何凝胶或糊状物,很容易贴在头部,且有研究证实无线干式脑电系统的信号质量与传统的湿式脑电系统相当[23],可有效应用于临床。而最新的干电极脑电帽(dry cap electrode EEG,DEEG)系统更加简便快捷,它能够更高效的进行数据采集,即使在高阻抗的情况下也可以进行准确的脑电记录,并允许在移动的患者中进行便携式EEG记录[24],为EEG在AIS的广泛临床应用铺平了道路。
2.3 有效预测AIS预后 EEG技术不仅能用于AIS的诊断和监测,而且能协助判断AIS的预后。目前应用于临床的AIS预后评定技术有特定频率功率谱测量和BSI检测。同时,EEG技术还可有效预判AIS患者出现继发性癫痫的可能性。
2.3.1 功率谱测量 最初,Sainio等[25]报道:在AIS患者发病48 h内记录的EEG中,高δ和或低α功率测量是评估不良预后的最可靠的QEEG指标。后续研究结果提示:δ功率经常随着时间的推移而显著改变,这取决于AIS的严重程度和演变,且这种变化与NIHSS评分相关[26]。DAR实质上量化了δ波功率的总体增量(相对于α波功率的变化),在预测长期功能结果方面优于传统的EEG指标[19]。DTABR则在DAR的基础上增加了对θ、β波功率变化的敏感性,是卒中后短期和长期残疾的有效预测因子。最近一项研究对151例前循环AIS患者分别在发病72 h内、出院时或卒中后7 d进行了EEG监测,并前瞻性队列随访了12 m,分析比较他们的QEEG指数后发现:较高的DTABR和较低的α相对功率(α-RP)往往提示较严重的神经功能缺损(残疾或死亡)[3],其中α-RP与认知功能的恢复以及卒中后失语症的改善呈正相关,也可预测蛛网膜下腔出血患者迟发性脑缺血的发展[27]。综上所述,DTABR、α-RP可作为预测AIS预后的最佳QEEG指标。
此外,卒中后认知障碍的评定(如蒙特利尔认知评估MoCA和简易精神状态检查MMSE)常常因患者虚弱、视力障碍、失语等各种症状而难以进行。已知较慢的背景节律频率和或θ功率较高的患者发生卒中后认知障碍的概率较大,一项对35例大脑中动脉AIS患者进行EEG监测和MoCA评估的对比研究发现:患侧枕部θ频率范围(4.2~7.6 Hz)内的相对功率增加是有无认知障碍的重要独立预测因子,可为卒中后认知损害的早期预测提供信息[28]。Aminov等[29]则利用单通道无线EEG快速测定 AIS后的QEEG指标,发现有4项指标与90 d后的MoCA评分呈中度至高度相关:θ-RP、δ-RP、DAR、DTR(δ/θ),其中DTR是预测AIS后较长期的认知功能的最佳指标。以上研究提示:QEEG可用来进行认知障碍的筛查和预测,该方法不用考虑症状的严重程度,结果也更显客观。
2.3.2 脑对称指数检测 BSI是大脑半球梗死的定量指标,定义为在1~25 Hz的频率范围内左右半球平均频谱功率的相对差值的绝对值,取值在0到1之间。它可以反映AIS患者的两个大脑半球的不对称性,与NIHSS评分、功能性神经损伤程度呈显著正相关。r-BSI由BSI修订而来,该指数比原来的BSI更灵敏、更准确,可作为评估卒中康复效果的预后指标[30]。近期,有研究采用Logistic回归分析结合AIS患者的连续脑电图 (CEEG)监测,进一步优化了r-BSI,并探讨其与患者短期预后的关系。发现:r-BSI能有效地表达脑缺血时双侧大脑半球的不对称性,与NIHSS评分呈正相关,可有效提示AIS患者的短期预后[31]。Sheorajpanday等[32]提出了同源配对脑对称指数 (pdBSI),用于比较同源通道对的功率谱的不对称性,而不是半球间的差异,在NIHSS评分为0或1的前循环AIS患者中,pdBSI是神经功能恶化的独立预测因子。最近的一项研究则强调了BSI的方向性,以说明脑半球间不对称的方向,并分别计算了不同频段的BSI、方向性BSI、DAR,发现:患侧相对于健侧的低频功率增加(即向患侧不对称)与卒中患者运动功能下降高度相关,方向性BSI(δ段)值的降低与卒中后早期神经功能的恢复有关[33]。
2.3.3 预判继发性癫痫 卒中后癫痫发作(poststroke seizure,PSS)是AIS常见且非常重要的并发症,根据卒中后发作时间的不同,可分为早期发作和晚期发作,晚期发作发生在卒中后至少2 w。研究表明,早期发作的PSS可能是由于急性神经元损伤、谷氨酸等兴奋性神经递质异常释放、离子通道功能障碍和血屏障破坏所致;而晚期发作的PSS可能是由于继发性胶质瘢痕形成,同时细胞膜特性改变、慢性炎症反应、神经变性、突触可塑性改变,最终导致过度兴奋,以及神经元活动的同步性增加[34,35]。EEG可以敏感地捕捉到这些病理改变,进而预测PSS的发生。
已有研究发现,在AIS急性期,常规EEG检测到癫痫样放电活动的患者一般表明发生癫痫的可能性增加,通常预后较差[36],如棘波、尖波、单侧周期性放电(LPDs)、双侧独立周期性放电(BIPD)、广泛性周期性痫样放电,以及颞叶间歇性δ活动等。Mecarelli等[37]对232例AIS患者进行了EEG检查(入院24 h内),发现84%的患者表现为局灶性或弥漫性电活动减慢,6%的患者出现LPDs,10%的患者有其他癫痫样异常。对这批患者临床随访1 w后发现:局灶性或弥漫性电活动减慢的患者无一例发生癫痫发作,出现LPDs的患者中85.7%有癫痫发作,有其他癫痫样异常的患者中13%出现局灶性癫痫发作;而在EEG表现为LPDs且有癫痫发作的患者中,71%的发作发展为癫痫持续状态(status epilepticus,SE),其中90%发展为惊厥性SE。以上研究表明:卒中早期LPDs类痫样放电活动可作为PSS的独立预测因子。
3 结语和展望
EEG可以在复杂的医疗环境中安全且快速地研究大脑功能,并有效提示是否存在大面积急性脑梗死。此外,与已成熟应用临床的影像学检查相比,尤其是在重症监护环境中,EEG数据更容易获得且有利于实时监测,可及时反映治疗效果并能客观提示患者预后。然而,目前临床上EEG系统仍需专人操作,记录耗时,有时甚至需借助电解质溶液来降低电极电阻,难以用作疑似卒中患者的常规检查。因此,未来需要进一步研发出更精准、更方便的干电极脑电技术(例如DEEG),并确定具有高特异性和敏感性的EEG指标(临床标志物),可以模拟心电图对急性胸闷、胸痛患者的评估,从而引导医护人员对病情做出迅速判断,更快地进行临床干预,以改善患者的预后。

