过表达乙酰肝素酶对胆囊癌细胞增殖及PI3K/AKT信号通路的影响
闻 波, 刘子祥, 张子艳, 陈佳伟, 王郑林, 周少波
(蚌埠医学院第二附属医院 普外科, 安徽 蚌埠, 233000)
胆囊癌是一种侵袭性强、致死率高的恶性肿瘤,其早期缺乏典型的体征和症状,多数患者确诊时已处于晚期[1-2]。目前,手术是有效的治疗手段,对于不能通过手术切除的胆囊癌患者, 5年生存率仅为10%左右[3], 而化疗或放疗对晚期患者并未产生明显的作用。胆囊癌的发生是在不同的进化阶段由连续的基因改变引起的,探索胆囊癌发病的分子机制对于建立胆囊癌新的治疗途径至关重要。乙酰肝素酶(HPSE)是一种内糖苷酶,可特异性地降解细胞外基质(ECM)成分硫酸乙酰肝素(HS),其与肿瘤的发生、生长、转移和化疗耐药等有关[4]。临床研究[5-7]发现, HPSE在乳腺恶性肿瘤、多发性骨髓瘤、肉瘤等多种肿瘤中表达升高。研究[8]表明, HPSE过表达促进了人胆囊癌细胞GBC-SD的增殖和迁移,但其具体作用机制尚不完全清楚。研究结果[9]显示,磷脂酰肌醇3-激酶/蛋白质丝氨酸苏氨酸激酶(PI3K/AKT)信号通路在大部分肿瘤细胞中呈激活状态,从而促进细胞的增殖。为了解HPSE过表达在胆囊癌发生发展中的作用及PI3K/AKT 通路对GBC-SD细胞生物学特性的影响,本研究利用脂质体法构建HPSE过表达的胆囊癌细胞系GBD-SD, 应用PI3K/AKT信号通路抑制剂LY294002作用于GBC-SD细胞,探究其对胆囊癌细胞增殖的影响及其可能的分子机制,现将结果报告如下。
1 材料与方法
1.1 材料
人GBC-SD细胞株购自中国科学院细胞库(中国上海)。胎牛血清(FBS)、培养基RPMI-1640购自Gibco公司, 质粒pcDNA3.1购自北诺生物科技有限公司(中国上海), PCR引物、Prime Script one step RT-PCR试剂盒购自Fermentas公司, 胰酶、RIPA细胞裂解液购自Hyclone公司, BCA蛋白定量试剂盒、MTT试剂盒、SDS-PAGE凝胶以及ECL试剂盒均购自上海碧云天公司, Trizol 试剂、Lipo-fectamin 2000购自美国Invitrogen公司, 兔抗人HPSE、PI3K、AKT、p-PI3K、p-AKT多抗、内参β-actin抗体以及对应二抗购自美国Affinity公司, LY294002购自MCE公司。
1.2 方法
1.2.1 GBD-SD稳定转染细胞株的构建与鉴定: 在美国生物技术信息中心(NCBI)中检索到HPSE基因序列ID为ENSG00000225609.1, 经过变性、退火处理将合成的单链DNA变为双链DNA, 将含有特定序列的pGPU6/GFP/Neo载体导入大肠埃希菌,在37 ℃的常温下培养12 h, 提取大肠埃希菌中的质粒,并确定该质粒的DNA序列。成功构建人HPSE基因过表达载体后,检测验证,最后将pcDNA3.1-HPSE载体转染到GBD-SD细胞中,并用抗生素筛选得到含有重组载体的稳定转染细胞株。
1.2.2 细胞培养、分组和转染: 将GBC-SD细胞在添加10%胎牛血清的培养基RPMI-1640中培养,培养箱CO2浓度为5%, 温度为37 ℃。当单层贴壁的细胞铺满瓶底约80%时,加入胰酶于培养瓶中进行消化与传代。将细胞分为GBC-SD组(HPSE正常表达)和GBD-SD组(HPSE过表达)。GBC-SD组不给予任何处理, GBD-SD组按照Lipofectamine 2000转染试剂说明书将载体转染到GBC-SD中获得。
1.2.3 实时荧光定量聚合酶链反应(qRT-PCR)测定细胞中HPSE的表达: 细胞中总RNA用Trizol试剂提取,接下来将总 RNA反向转录成cDNA。根据制造商说明书,采用SYBRGreen方法通过qRT-PCR扩增目标基因。HPSE引物: 正向引物为5′-CCT-CAT-CCT-CCT-GGG-TTC-TC-3′, 反向引物为5′-AGG-AGG-CAT-TGC-TGA-TGA-TC-3′, β-actin引物: 正向引物为5′-AGC-GAG-CAT-CCC-CCA-AAG-TT-3′, 反向引物为5′-GGG-CAC-GAA-GGC-TCA-TCA-TT-3′。PCR热循环的条件: 95 ℃下5 min, 接下来经历以下40个循环(95 ℃下45 s, 60 ℃下45 s, 72 ℃下60 s)。采用2-△△Ct法测定HPSE基因表达,所有PCR实验重复3次。
1.2.4 Western blot测定蛋白水平: 使用RIPA裂解液分离细胞总蛋白后通过BCA法定量。按步骤进行电泳、转膜和封闭(5%的脱脂牛奶),然后将膜与兔抗人的HPSE(1∶1000)、PI3K(1∶1 000)、AKT(1∶1 000)、p-PI3K(1∶1 000)和p-AKT(1∶1 000)一抗在4 ℃下过夜。使用TBST清洗膜3次(每次清洗10 min), 而后在25 ℃下孵育二抗(山羊抗兔IgG, 稀释度1∶5 000)60 min。最后对膜进行化学发光检测,并使用Image J软件定量条带强度,每个实验分别进行3次。
1.2.5 细胞增殖实验: ① MTT法。将细胞以2×103个/孔的密度接种在96孔板上,每组设5个复孔。在37 ℃、5%CO2的培养箱中分别培养24、48、72 h, 并向每孔中添加MTT溶液5 mg/mL, 再孵育4 h。接下来倒出培养基,向每孔中添加150 μL的二甲基亚砜(DMSO), 10 min后晶体全部溶解,最后测量每孔的光密度(OD)值,每个实验进行3次。② 集落形成实验。将细胞以1×103个/孔的密度接种在6孔板上,每组设5个复孔,在RPMI-1640培养基(含10%FBS)中培养,以允许菌落形成。培养14 d后,采用PBS冲洗细胞集落3次,在室温下用4%多聚甲醛固定25 min后用结晶紫染色15 min。最后,对染色的菌落进行成像和计数以反映每组细胞的增殖能力。
1.3 统计学处理
采用SPSS 20.0软件和GraphPad Prism 8.0软件分析数据,结果以均数±标准差表示,采用t检验、单因素方差分析比较2组和多组间的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 HPSE在胆囊癌细胞系GBC-SD和GBD-SD中的表达
qRT-PCR和Western blot结果显示,经转基因过表达后的GBD-SD中HPSEmRNA和蛋白相对表达量较GBC-SD升高,差异有统计学意义(P<0.01), 见图1。
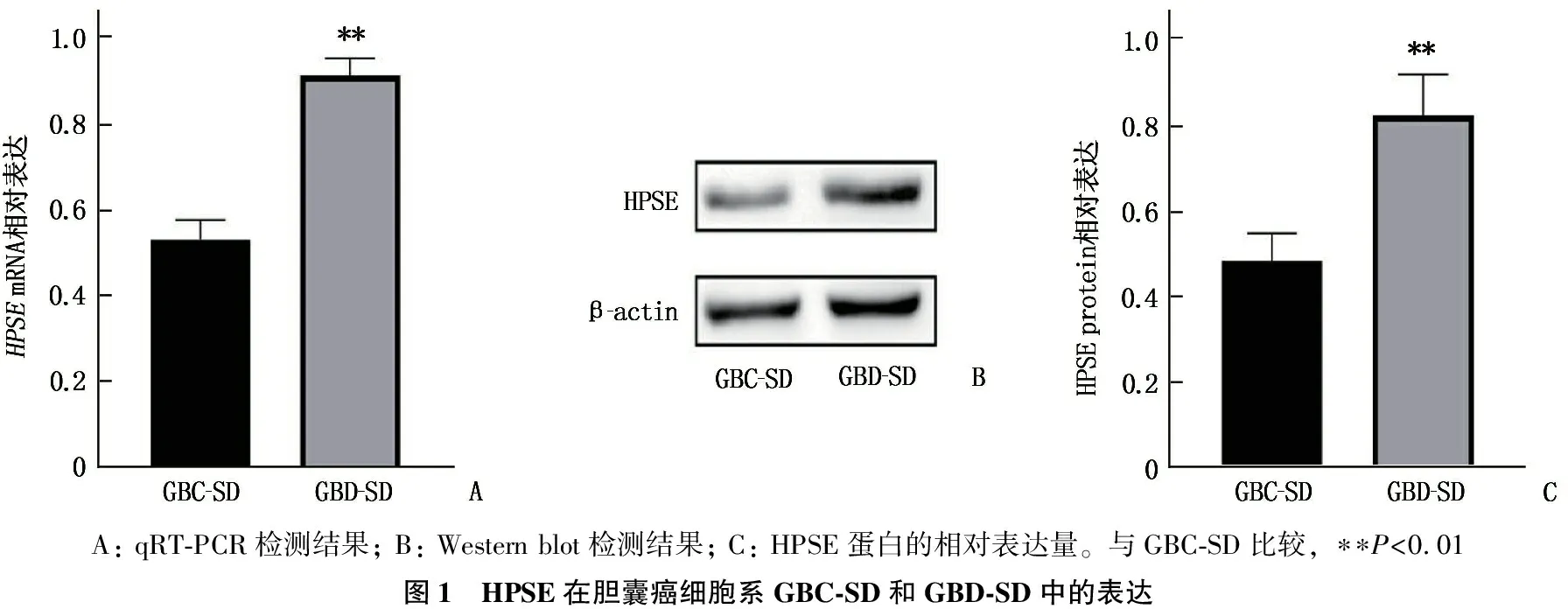
A: qRT-PCR检测结果; B: Western blot检测结果; C: HPSE蛋白的相对表达量。与GBC-SD比较, ∗∗P<0.01图1 HPSE在胆囊癌细胞系GBC-SD和GBD-SD中的表达
2.2 HPSE过表达对胆囊癌细胞系GBC-SD细胞增殖的影响
MTT结果表明, GBC-SD组细胞在24、48、72 h的OD值依次为(0.32±0.03)、(0.45±0.03)、(0.63±0.02), 而GBD-SD组细胞在24、48、72 h的OD值依次为(0.49±0.04)、(0.64±0.03)、(0.87±0.04)。GBD-SD组细胞的OD值高于GBC-SD组,差异有统计学意义(P<0.05)。集落形成实验显示, GBC-SD组、GBD-SD组细胞经培养14 d后集落形成数分别为(69.33±2.52)、(152.33±5.13), 差异有统计学意义(P<0.01), 提示HPSE过表达后显著促进了胆囊癌细胞的增殖。见图2。
2.3 HPSE过表达对PI3K/AKT信号通路的影响
通过Western blot检测发现,与GBC-SD组细胞相比,GBD-SD组细胞p-AKT、p-PI3K蛋白表达水平、p-AKT/AKT值和p-PI3K/PI3K值增加,差异有统计学意义(P<0.01), 而总AKT和总PI3K蛋白表达水平无明显变化。上述结果提示上调GBC-SD细胞中HPSE基因的表达可以促进PI3K/AKT信号通路的活化。见图3。
2.4 PI3K/AKT信号通路抑制剂LY294002对胆囊癌细胞系GBC-SD细胞增殖的影响
为进一步探索HPSE是否通过PI3K/AKT信号通路促进胆囊癌细胞系GBC-SD细胞的增殖,本研究将PI3K特异性抑制剂LY294002(10 μmol/L)处理GBC-SD细胞2 d后,通过MTT法和集落形成实验分析GBC-SD组和LY294002组细胞的增殖情况。结果显示, GBC-SD组和LY294002组中细胞的OD值分别为(0.53±0.05)、(0.32±0.01),差异有统计学意义(P<0.05)。集落形成实验结果表明, GBC-SD组和LY294002组中细胞在培养14 d后集落形成率分别为(64.67±3.51)、(24.33±1.53)%, 差异有统计学意义(P<0.01)。Western blot检测2组细胞p-AKT和AKT 蛋白表达情况,结果显示GBC-SD组和LY294002组中细胞p-AKT/AKT分别为(0.96±0.02)、(0.57±0.06), 差异有统计学意义(P<0.05)。上述结果表明,抑制剂LY294002能够抑制GBC-SD细胞的增殖,HPSE促进GBC-SD细胞的增殖可能与PI3K/AKT通路有关。见图4。

A: MTT检测结果; B: 细胞集落形成实验结果; C: 菌落计数结果。与GBC-SD比较, ∗P<0.05, ∗∗P<0.01。图2 HPSE过表达对GBC-SD细胞增殖的影响
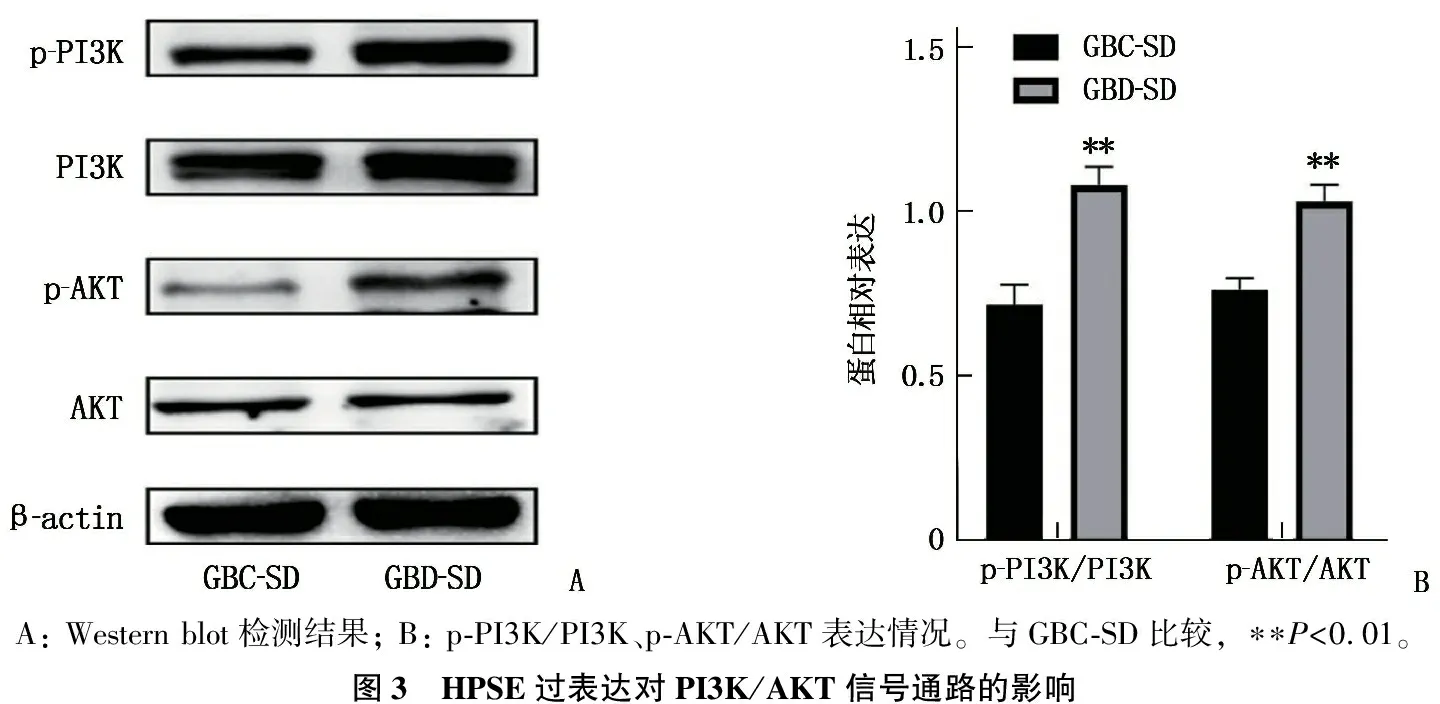
A: Western blot检测结果; B: p-PI3K/PI3K、p-AKT/AKT表达情况。与GBC-SD比较, ∗∗P<0.01。图3 HPSE过表达对PI3K/AKT信号通路的影响
3 讨 论
目前,胆囊癌在胆道恶性肿瘤中所占比率约为90%, 其整体发病率约为1%[10]。积极寻找胆囊癌发生发展及侵袭转移的分子机制,对于胆囊癌早期诊断、干预及治疗意义重大。HPSE基因在正常人的组织内主要分布在胎盘、淋巴器官等免疫组织,而在肿瘤尤其是恶性肿瘤组织中却有着广泛的分布。HPSE是唯一的一种能够水解蛋白多糖的HS链的酶,其特定的糖苷键是细胞外基质和细胞表面的关键组成部分[11]。肿瘤细胞突破由基底膜(BM)和ECM组成的天然屏障是其进展和转移的关键过程。
在肿瘤发生发展过程中, HPSE对HS的降解与细胞表面和细胞外基质重塑以及HS结合信号分子的释放有关,可促使癌细胞生长、迁移、侵袭和血管生成[12]。研究[13]表明, HPSE基因表达与胃癌、乳腺癌、多发性骨髓瘤等恶性肿瘤的生长有关,例如HPSE在人膀胱的尿道上皮癌中过表达,并且HPSE的表达水平与膀胱癌的复发相关[14]。BARASH U等[15]研究发现HPSE的过度表达促进了胶质瘤细胞的侵袭和生长,表明HPSE不仅具有促进胶质瘤细胞局部侵袭的酶活性,而且还促进了胶质瘤病灶的生长。研究[16-17]报道抑制HPSE的表达可抑制乳腺癌、肝癌、膀胱癌等肿瘤细胞的侵袭、迁移和黏附能力。PI-88[18]、SST0001[19]、M402[20]等HPSE抑制剂为肿瘤的治疗提供了多种选择。研究[8, 21]显示, HPSE在胆囊癌组织中表达异常,与胆囊癌的进展有关,作者前期研究中发现上调HPSE基因可以显著促进胆囊癌细胞的增殖。但目前关于HPSE在胆囊癌增殖方面的调控机制并不明确,揭示其潜在的分子机制对胆囊癌的诊断及针对基因方面的治疗具有重要意义。
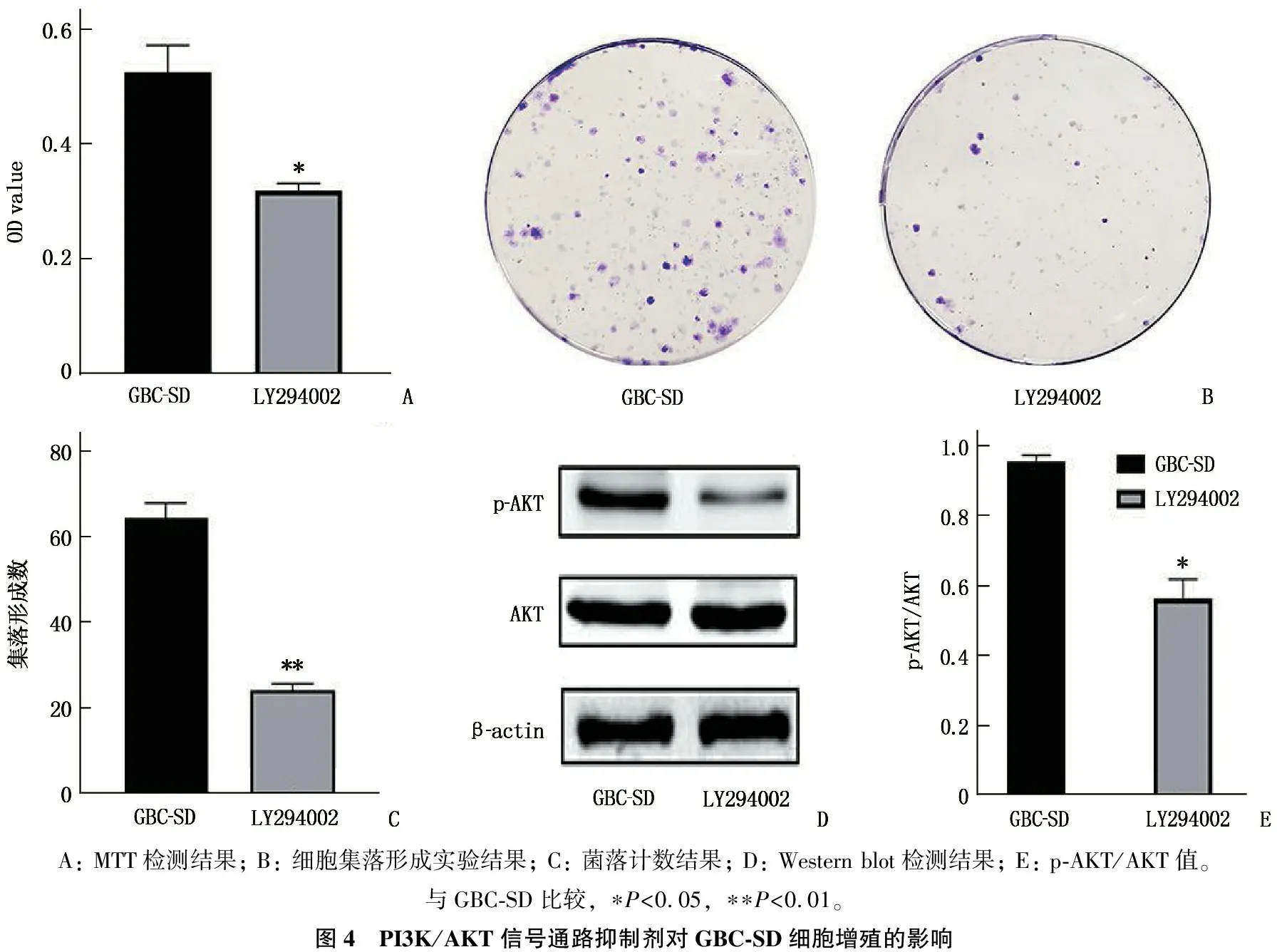
A: MTT检测结果; B: 细胞集落形成实验结果; C: 菌落计数结果; D: Western blot检测结果; E: p-AKT/AKT值。与GBC-SD比较, ∗P<0.05, ∗∗P<0.01。图4 PI3K/AKT信号通路抑制剂对GBC-SD细胞增殖的影响
近年来,研究[22-24]显示PI3K/AKT通路是一种参与人体细胞周期调控的关键信号通路,细胞静止、增殖和癌细胞活力之间存在直接关系,该信号通路的过度激活已被证明有助于各种人类恶性肿瘤的增殖和进展。当PI3K/AKT信号通路被各种细胞因子和生长因子激活后作用于PI3K促进二磷酸腺苷转化为三磷酸肌醇,进而导致PI3K/AKT信号通路的下游作用因子AKT的激活,使得p-AKT比率升高,调控其下游分子,从而参与胰腺癌、乳腺癌、胃肠道肿瘤和黑色素瘤等多种肿瘤细胞的增殖和凋亡过程[25-28]。成纤维细胞生长因子2(FGF2)是上皮间质转换(EMT)的关键触发因子。作者前期研究[8]已经证实HPSE通过其酶活性切割硫酸乙酰肝素蛋白多糖的HS侧链,刺激FGF2等生长因子和细胞因子的释放,进而诱导胆囊癌细胞发生EMT, 增强其增殖及迁移能力。有研究[29-30]分析表明HPSE的上调可显著促进FGF2的表达, 相反,观察到HPSE沉默介导FGF2的减少, HPSE能够通过上调FGF2的表达而激活PI3K/AKT信号通路,诱导肿瘤细胞增殖、侵袭和迁移。由此可见, FGF2是联系HPSE和PI3K/AKT信号通路最重要的细胞生长因子,过表达HPSE可能通过PI3K/AKT信号通路促进肿瘤细胞的增殖。
鉴于PI3K/AKT信号通路对癌细胞的生长、侵袭和转移至关重要,作者分析了过表达HPSE对PI3K/AKT信号通路的作用。本研究结果表明,与正常表达HPSE的GBC-SD细胞相比,过表达HPSE可显著提高p-PI3K、p-AKT的蛋白水平并促进了胆囊癌细胞的增殖,但PI3K、AKT总量无显著变化,提示HPSE可以激活GBC-SD细胞的PI3K/AKT通路。为了证实上述结果,作者使用LY294002处理GBC-SD细胞,观察到LY294002处理后对p-PI3K、p-AKT蛋白水平有明显的抑制作用。但与未经抑制剂处理的GBC-SD细胞相比,总PI3K、AKT的蛋白水平仍无显著变化。由此可见,HPSE能够促进胆囊癌细胞的增殖,而LY294002可抑制HPSE的促增殖作用。
综上所述,本研究证实了PI3K/AKT信号通路在过表达HPSE促进人胆囊癌细胞系GBC-SD细胞增殖过程中起着关键的调控作用,为HPSE在人胆囊癌的治疗提供了新的分子靶点和用药新思路。

