干扰素刺激基因对羊口疮病毒在OFTu细胞中增殖的抑制效应
陈永杰,刘健新,李慧子,钟文霞,李保建,皮墨霖,宁章勇,2*
(1.华南农业大学兽医学院,广州 510642; 2.岭南现代农业科学与技术广东省实验室茂名分中心,茂名 525000)
干扰素刺激基因(stimulator of interferon genes,STING)是胞质DNA感受器,在机体的天然免疫中发挥着重要作用[1-2]。当DNA病毒、细菌等侵入细胞时,细胞质中的环腺苷酸鸟苷酸合成酶(cyclic GMP-AMP synthase,c GAS)与dsDNA结合,产生内源性的环化二核苷酸cGAMP并介导STING构象发生改变且被激活,进而诱导Ⅰ型干扰素的产生,启动炎症因子和趋化因子的转录表达[3-4]。此外,STING自身也可以直接结合DNA并通过二聚化和易位激活STING-TBK-1-IRF3信号转导途径,从而触发一系列信号级联[5-6]。研究表明,腺病毒、牛痘病毒、乳头瘤病毒和Ⅰ型疱疹病毒等均可以激活STING信号通路,诱导Ⅰ型IFN的表达拮抗病毒的增殖[7-11]。在敲除小鼠STING基因后,小鼠机体内感染HBV的滴度明显升高[12],这提示STING具有限制DNA病毒增殖的作用。探索STING在不同病毒感染和增殖中的作用,为开发基于STING蛋白的新型抗病毒药物提供了可能。
羊口疮(orf)是由羊口疮病毒(orf virus,ORFV)引起的一种急性、接触性人畜共患传染病,不仅严重影响养羊业的健康发展,而且威胁人类健康[13-16]。ORFV是痘病毒科副痘病毒属dsDNA病毒[17],该病毒及其编码蛋白可以通过拮抗宿主的天然免疫,在同一动物发生重复感染[18]。ORFV为什么可以反复突破机体的免疫系统?机体的天然免疫分子对ORFV的具有什么样的作用?这些问题是今后探索ORFV致病机制的重要研究方向。作为重要的天然免疫核心分子,STING在ORFV感染中的作用如何,该蛋白对ORFV的复制有何影响仍然未知,这也是人们希望探索的问题。
本研究通过构建ORFV感染OFTu细胞的模型,获得了STING及其相关基因的动态表达数据,分析了OFTu细胞过表达和抑制表达STING对ORFV增殖的影响。研究结果可为深入理解STING在ORFV复制中的作用提供理论依据,也可为深入探索ORFV感染和致病的分子机制提供基础数据。
1 材料与方法
1.1 主要试剂及耗材
RNAiso Plus Total RNA提取试剂盒、LATaqDNA聚合酶、E.coliJM109感受态细胞、pMDTM18-T Vector、DL500 marker、DL2000 marker、DL5000 marker、限制性内切酶BglⅡ、EcoRI和HindⅢ,荧光定量SYBR Premix ExTaqⅡ等均购自宝生物工程(大连)有限公司。胎牛血清和MEM细胞培养基购自Gibco公司。L-谷氨酰胺、0.25%胰酶-EDTA、青霉素/链霉素双抗、RIPA裂解液等均购自北京鼎国昌盛生物技术有限公司。兔抗β-actin IgG单克隆抗体购自博士德生物有限公司。兔抗GFP IgG多克隆抗体购自SANTA CRUZ生物有限公司。pEGFP载体、pSuper.Retro.Neo+GFP载体、OFTu细胞、GDZC株ORFV和兔抗羊STING多克隆抗体[19]由华南农业大学兽医学院病理教研室保存。
1.2 STING过表达质粒的构建
根据本实验室提交至NCBI的山羊STING基因(KR060015)的mRNA序列[20]设计STING引物,上游:5′-ATATATAGATCTCGCCACCATGCCTCACTCCAGCC-3′(下划线为BglⅡ酶切位点),下游:5′-GATCACGAATTCGGAAGACATCTGAGCGG-3′(下划线为EcoR I酶切位点)。采用50 μL 体系进行PCR扩增:10×LATaqBuffer Ⅱ 5 μL,dNTP Mixture 8 μL(2.5 μmol·L-1),pMD-18T-STING质粒1 μL(50 ng·μL-1),上下引物各2 μL(10 μmol·L-1),LATaqDNA聚合酶0.5 μL, 加ddH2O补至50 μL。PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,35个 循环;72 ℃ 10 min。用BglⅡ和EcoRⅠ对回收PCR产物进行酶切,并连接到具有相同酶切位点的pEGFP-N1载体中,构建pEGFP-N1-STING重组质粒。
1.3 STING抑制表达质粒的构建
参考shRNA设计原则[21],使用Oligoengine Workstation 2.0设计2条特异性靶向STING基因的shRNA,分别命名为shRNA-ST-1和shRNA-ST-2,同时设计1条阴性对照序列即shRNA-ST-0,并用BLAST验证其特异性。寡核苷酸序列见表1。

表1 shRNA-STING寡核苷酸序列
合成的2对shRNA和1对阴性对照shRNA单链模板用超纯水稀释为2 mg·L-1,shRNA上下游引物各取1 μL与48 μL的退火缓冲液(100 mmol·L-1乙酸钠,30 mmol·L-1HEPES-KOH pH7.4,2 mmol·L-1乙酸镁)混合,退火条件为90 ℃ 4 min,70 ℃ 10 min,冷却至10 ℃,用BglⅡ和Hind Ⅲ酶切pSuper.Retro.Neo+GFP质粒并胶回收,然后将退火产物与胶回收产物连接,取连接产物转化至JM109感受态细胞中,提取质粒用BglⅡ和Hind Ⅲ酶切鉴定,然后将阳性质粒送公司测序验证。
1.4 实时荧光定量PCR
将提取的细胞总RNA反转录为cDNA,通过实时荧光定量PCR方法检测STING、cGAS、TBK1、IRF3、IRF7、IL-6、IL-1β、IFN-β、IFN-α、RIG-1、DDX41、IFI16和TNF-α的转录情况,引物序列见表2。mRNA的相对转录量采用2-ΔΔct方法计算,同时以β-actin作为内参对照基因。
1.5 细胞转染
OFTu细胞的培养和质粒转染根据本实验室建立的方法[22]进行。将OFTu以2×105~3×105个·孔-1接种于6孔板,细胞融合率达到80%~90%时使用LipofectamineTM2000进行转染。过表达组,使用2.5 μg pEGFP-N1-STING质粒进行转染,并转染空载质粒作为阴性对照;干扰表达组,使用2.5 μg shRNA-ST-1、shRNA-ST-2和shRNA-ST-0进行转染;转染后6 h更换培养基,24 h时观察荧光强度。
1.6 Western blot蛋白检测
将细胞样本经处理后进行SDS-PAGE电泳,转移至硝酸纤维膜。用含5%脱脂奶粉的TBST室温孵育1.5 h,TBST洗涤硝酸纤维膜3次后,加入STING一抗(1∶500),β-actin一抗(1∶2 000),4 ℃过夜,二抗(1∶3 000)室温孵育2 h,洗涤后置于Tanon-5200化学发光分析仪进行曝光。以β-actin蛋白为内参,使用Image J软件分析蛋白质条带的灰度值。

表2 用于实时定量荧光PCR引物
1.7 不同STING表达状态的OFTu细胞病毒滴度的测定
将OFTu接种于含10%胎牛血清MEM的6孔板中,细胞融合度达到80%~90%时,分别转染过表达质粒和干扰质粒(2.5 μg·孔-1)。为了评估ORFV在具有STING过量表达或干扰表达的细胞模型中的复制情况,将pEGFP-N1-STING和pEGFP-N1或shRNA-ST-1、shRNA-ST-2和shRNA-ST-0转染的OFTu细胞用ORFV感染(MOI=1)。分别在感染后6、12、24、36、48、72 h收集病毒上清液和细胞样品,使用Reed-Muench方法检测每个时间点病毒上清液的TCID50。
1.8 数据分析
2 结 果
2.1 ORFV感染OFTu细胞对STING、cGAS、TBK1、IRF3、IRF7、IL-6、IFN-β、IL-1β和TNF-α基因转录的影响
ORFV(MOI=1)感染OFTu细胞后,real-time PCR检测不同时间点STING、cGAS、TBK1、IRF3、IRF7、IL-6、IFN-β、IL-1β和TNF-α基因转录情况。结果显示:这些基因的转录呈现出不同程度的升高。STING、cGAS、TBK1、IL-6的转录在细胞被感染后24、36和48 h显著上升(P<0.01或P<0.05),而IRF3、IRF7、IFN-β、IL-1β和TNF-α在病毒感染细胞后36和48 h显著上升(P<0.01或P<0.05,图1)。
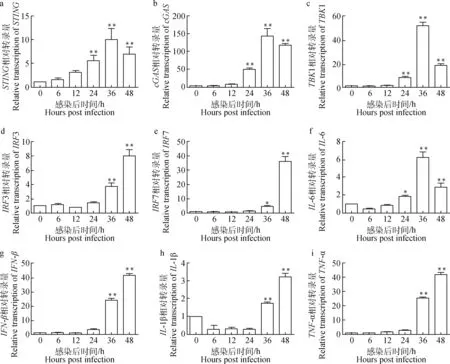
a. STING; b. cGAS; c. TBK1; d. IRF3; e. IRF7; f. IL-6; g. IFN-β; h. IL-1β; i. TNF-α图1 ORFV感染OFTu细胞后相关基因的转录Fig.1 Gene transcription of related genes in OFTu cells infected with ORFV
2.2 OFTu细胞过表达STING对RIG-1、DDX41、IFI16、IRF3、IRF7、IL-6、TNF-α、IFN-α和IFN-β基因转录的影响
将pEGFP-N1-STING质粒和pEGFP-N1质粒分别转染至OFTu细胞48 h后,提取细胞总蛋白,Western blot检测其蛋白表达情况,结果显示,pEGFP-N1-STING组的STING蛋白水平显著高于pEGFP-N1对照组(图2a),过表达率为225%(图2b)。STING的过表达使RIG-1、DDX41、IFI16、IRF3、IRF7、IL-6、TNF-α、IFN-α和IFN-β的转录显著升高(P<0.01)(图2c)。与转染空载体组相比,TNF-α的转录水平升高了54.6倍(P<0.01),IFN-β升高43.5倍(P<0.01),IFN-α升高41.7倍(P<0.01),IL-6升高33倍(P<0.01),IRF7升高29.2倍(P<0.01),IRF3增加23.5倍(P<0.01),RIG-1增加6.7倍(P<0.01),IFI16增加4.9倍(P<0.01),而DDX41增加4.3倍(P<0.01)。
2.3 ORFV感染过表达STING的OFTu细胞对TBK1、IRF3、IFN-β和TNF-α基因转录以及ORFV增殖的影响
ORFV感染过表达STING的细胞后,TBK1、IRF3、IFN-β和TNF-α转录水平与对照组相比变化明显。TBK1在6 h时显著下降(P<0.01),但在48 h时显著增加(P<0.01);IRF3在12、24和48 h时显著增加;IFN-β在6 h时显著增加(P<0.01),而在12 h后显著降低(P<0.05);TNF-α在6 h时显著升高(P<0.01), 而在12 h时显著降低(P<0.01),并在12 h后显示出增加的趋势,在48 h时显著增加(P<0.01) (图2 d~g)。ORFV感染过表达STING细胞后,对不同时间点的病毒滴度进行测定,结果显示,在所有检测时间点上,过表达STING组的ORFV 滴度均低于阴性对照组的滴度,尤其是在48 h (P<0.05)和72 h(P<0.01)(图2h)。
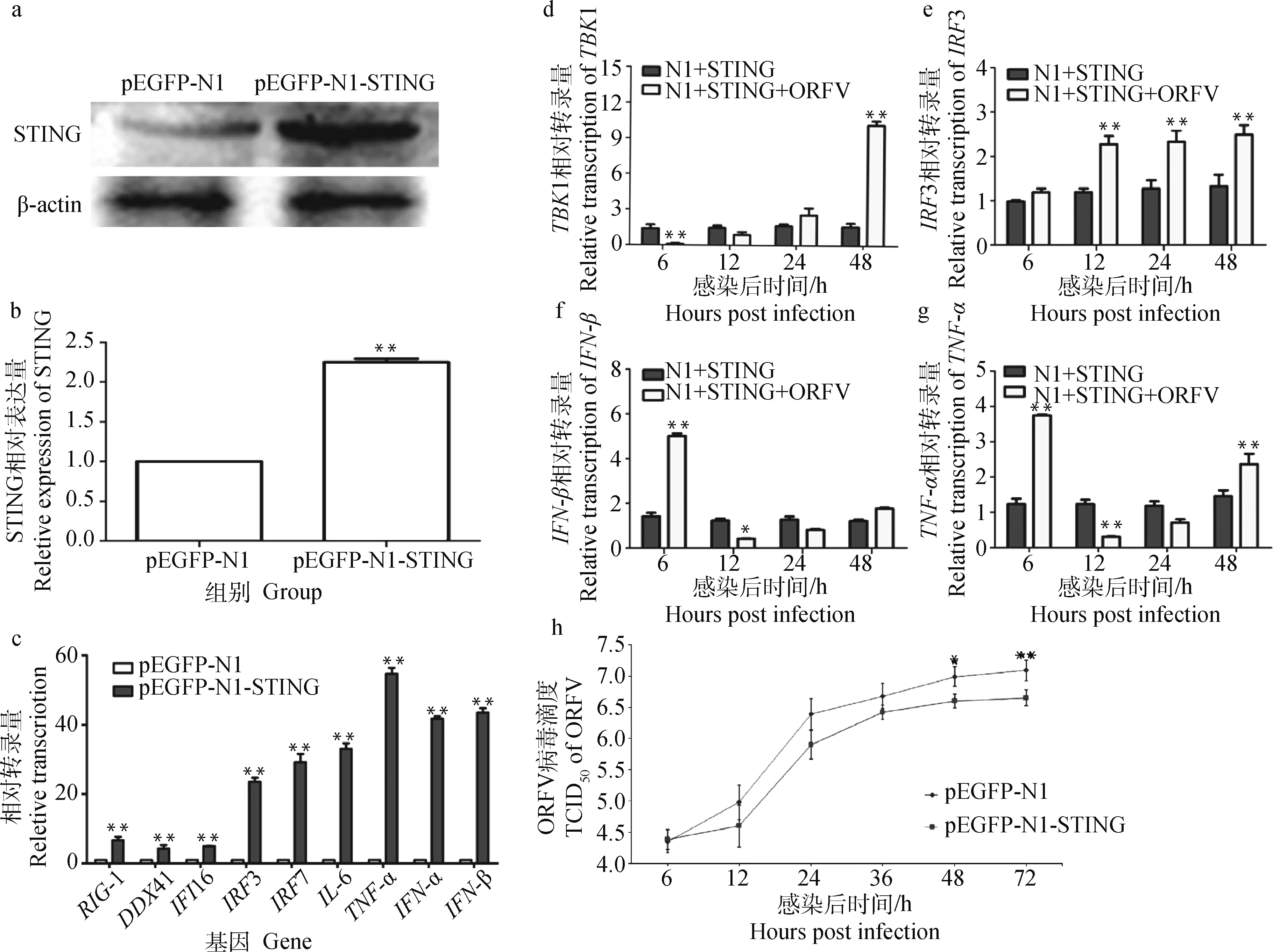
a. Western blot检测OFTu细胞转染过表达质粒后STING蛋白表达水平;b. Image J分析STING蛋白过表达效率; c.OFTu细胞过表达STING后RIG-1、DDX41、IFI16、IRF3、IRF7、IL-6、TNF-α、IFN-α和IFN-β的mRNA表达水平;d~g. ORFV感染过表达STING的OFTu细胞对TBK1、IRF3、IFN-β和TNF-α的mRNA表达的影响;h. ORFV感染过表达STING的OFTu细胞后病毒的生长曲线a. The expression of STING protein was detected by Western blot in OFTu cells transfected with overexpressed plasmid; b. The overexpression efficiency of STING protein was analyzed by Image J; c. The mRNA expression levels of RIG-1, DDX41, IFI16, IRF3, IRF7, IL-6, TNF-α, IFN-α and IFN-β in OFTu cells after overexpression of STING; d-g. Effect of ORFV infection of overexpressing STING OFTu cells on mRNA expression of TBK1, IRF3, IFN-β and TNF-α; h. The growth curve of ORFV virus after infection with STING overexpressing OFTu cells图2 ORFV感染过表达STING的OFTu细胞后增强了TBK-1、IRF3、IFN-β、TNF-α的表达并抑制ORFV的复制Fig.2 ORFV infection of the OFTu cell overexpressing STING enhanced the expression of TBK-1, IRF3, IFN-β and TNF-α and inhibited the replication of ORFV
2.4 ORFV感染干扰表达STING的OFTu细胞对TBK-1、IRF3、IFN-β和TNF-α基因转录以及ORFV增殖的影响
核苷酸测序证实重组质粒sh-RNA-ST-0、sh-RNA-ST-1和sh-RNA-ST-2已成功构建(图3a)。将重组质粒shRNA-ST-0、shRNA-ST-1和shRNA-ST-2转染到OFTu细胞48 h后提取细胞总蛋白,Western blot检测STING蛋白,结果显示转染shRNA-ST-1和shRNA-ST-2组的STING蛋白水平均低于shRNA-ST-0对照组,说明构建的质粒可以有效对STING蛋白表达进行干扰(图3b)。经分析发现shRNA-ST-1干扰了70%的蛋白表达,shRNA-ST-2则为40%(图3c),基于此,后续选择shRNA-ST-1进行试验。
在STING干扰表达的感染细胞中,TBK-1、IRF3、IFN-β和TNF-α的表达显著降低(图3 d~g)。TBK1、IFN-β和TNF-α的转录在6~48 h显著降低(P<0.05或P<0.01),而IRF3在24~48 h时显著降低(P<0.01)。ORFV感染干扰表达STING的OFTu细胞后,在所有检测时间点,STING干扰组的ORFV的滴度均高于阴性对照组的滴度(图3h),但差异不显著(P>0.05)。

a.重组干扰STING表达质粒的双酶切鉴定,1、2、3、4泳道分别为pSUPER.retro.neo+GFP载体、shRNA-ST-0、shRNA-ST-1、shRNA-ST-2;b. Western blot检测干扰STING表达后STING蛋白的表达水平;c. Image J分析STING蛋白干扰效率;d~g. ORFV感染干扰表达STING后的OFTu细胞对TBK1、IRF3、IFN-β和TNF-α的mRNA表达的影响;h. ORFV感染干扰STING的OFTu细胞后病毒的生长曲线a. Identification of recombination interference STING expression plasmid with double enzyme digestion, Lanes 1, 2, 3 and 4 were pSUPER.retro.neo+GFP vector, shRNA-ST-0, shRNA-ST-1, shRNA-ST-2 respectively;b. STING protein expression level was detected by Western blot after interference with STING expression; c. The interference efficiency of STING protein was analyzed by Image J; d-g. Effects of interfering expression of STING OFTu cells infected with ORFV on mRNA expression of TBK1, IRF3, IFN-β and TNF-α; h. The growth curve of ORFV virus after infection with OFTu cells interfering with STING图3 ORFV感染干扰表达STING的OFTu细胞后下调了TBK-1、IRF3、IFN-β、TNF-α的表达并促进ORFV的复制Fig.3 ORFV infection with the OFTu cells with interference expression of STING downregulated the expression of TBK-1, IRF3, IFN-β and TNF-α and promoted the replication of ORFV
3 讨 论
宿主的天然免疫系统可以有效地识别侵入的病原体并启动宿主免疫反应,进而在病原清除和免疫中发挥重要作用。宿主细胞通过模式识别受体(pathogen-recognition receptors, PRRs)激活宿主的天然免疫反应,诱导干扰素、抗病毒因子和促炎细胞因子的产生,从而限制病原的扩散[2,23-28]。STING作为机体天然免疫信号通路中重要的核心蛋白,在防御病原体入侵、介导Ⅰ型干扰素产生过程中发挥着极其重要的作用,但STING在ORFV感染中的作用仍然不清楚。
本研究通过构建细胞感染模型,分析了ORFV感染细胞后对STING及其相关基因表达的影响,探索了STING基因在干扰表达和过表达状态下对ORFV在细胞上增殖的影响。结果显示,ORFV感染OFTu细胞后显著增加了STING、cGAS、TBK1、IRF3、IRF7、IL-6、IFN-β、IL-1β和TNF-α的转录,这与HBV感染Li23细胞、HSV-1感染小胶质细胞介导STING及相关基因表达显著上升相一致[5, 7-8 ]。TBK1、IRF3、IFN-β和TNF-α是cGSA-STING信号通路中的重要表达因子,ORFV感染过表达STING的OFTu细胞后可以显著增加TBK1、IRF3、IFN-β和TNF-α的转录,ORFV感染干扰表达STING的OFTu细胞可以显著减少TBK1、IRF3、IFN-β和TNF-α的转录,这与之前研究HIV感染干扰表达STING蛋白的THP-1细胞可以抑制TBK-1-IRF3通路的结果相一致[11]。OFTu细胞在STING过表达状态下感染ORFV,可以显著抑制ORFV的复制,这与以前研究STING的过表达可以有效抑制巨噬细胞和肝细胞中乙型肝炎病毒复制的报道相一致[29]。同时,在STING干扰表达状态下感染ORFV,则有助于病毒的复制,这也与敲除STING后则有助于人类巨细胞病毒[30]、单纯疱疹病毒1[31]和乳头瘤病毒[32]的增殖报道相一致。
4 结 论
STING通过上调OFTu细胞抗病毒因子的表达抑制了羊口疮病毒的增殖,这进一步丰富了STING蛋白的抗病毒谱,也为深入探究STING蛋白在ORFV感染和复制中的作用提供了基础数据。

