鸡传染性贫血病毒VP2蛋白单克隆抗体的研制及其识别抗原表位的鉴定
汪铭锐,吴俊花,王 飞,邵红霞,3,钱 琨,3,叶建强,3,4,秦爱建,3,4*
(1. 扬州大学兽医学院 教育部禽类预防医学重点实验室,扬州 225009;2.扬州大学兽医学院 江苏省动物预防医学重点实验室,扬州 225009;3.扬州大学兽医学院 江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;4.扬州大学 教育部农业与农产品安全国际合作联合实验室,扬州 225009)
鸡传染性贫血病毒(chicken infectious anemia virus, CIAV)属圆环病毒科,是全世界范围内公认的重要禽类病原体[1-3]。CIAV在鸡群中主要以垂直传播的方式进行传播,感染后会引起鸡贫血及免疫器官发育不良,易导致疫苗免疫失败,并常与其他免疫抑制病毒同时感染鸡群[4-9]。CIAV基因组共包含3个开放阅读框[10],分别编码结构蛋白VP1和非结构蛋白VP2、VP3,VP2作为非结构蛋白被认为在VP1蛋白的组装以及VP3蛋白的磷酸化中起重要作用[11-13]。在鸡群感染CIAV后,仅需要2周就可检测到针对VP2抗体的存在,因此可以作为检测CIAV感染的重要靶标抗原[14]。
已有相关文献报道表达的重组VP2蛋白可以作为间接ELISA的检测抗原[14-15],检测感染鸡群中的VP2蛋白抗体,但特异性和灵敏性有待验证。目前,国内针对该病的检测试剂盒较少,且特异性尚有限,而国外的试剂盒价格十分昂贵,不利于大批量的检测,因此建立一种特异性好,灵敏性高的检测方法对我国CIAV的防控有重大意义。
mAb以及抗原表位的研究在疾病防控方面取得诸多成果,基于mAb建立的阻断ELISA具有高度特异性,在诸多疾病的监测中得以应用[16-18],因此制备针对CIAV VP2蛋白的mAb以及抗原表位的研究有助于CIAV防控。本研究通过原核表达VP2蛋白并免疫小鼠制备mAb,对研制mAb识别的抗原表位进行鉴定,为研究VP2蛋白在CIAV感染中的作用以及病毒检测方法的建立提供了基础材料。
1 材料与方法
1.1 材料
CIAV海安分离株(HA9805)、低致病性禽流感病毒(LPAIV)及其mAb 2A8、J亚群禽白血病病毒(ALV-J)及其mAb 5D3、马立克病病毒(MDV)及其mAb BA4、pET-32a载体、MDCC-MSB1细胞、DF1细胞、CEF细胞、MDCK细胞、Sf9细胞、SP2/0细胞、重组杆状病毒rBac-CIAV-VP2、pCAGSS-VP2-Flag质粒、大肠杆菌BL21 (DE3)由本实验室保存;6~8周龄BALB/c母鼠由扬州大学比较医学中心提供。Axy Prep基因组DNA小量试剂盒购自Axygen公司;胶回收试剂盒购自QIAGEN公司;转染试剂TransIT-LT1购自Mirus公司;FITC标记山羊抗鼠IgG、HRP标记山羊抗鼠IgG均购自Sigma公司;聚乙二醇(PEG1500)购自Roche公司;蛋白Marker、高保真酶购于诺唯赞公司,ECL发光显色液购自NCM Biotech公司;mAb亚类鉴定试剂盒购自SouthernBiotech公司;RIPA裂解液(强)购自康为世纪公司。
1.2 原核表达载体构建及VP2重组蛋白的诱导表达
根据CIAV的VP2(NCBI序列号:M55918.1)的序列,设计合成了1对引物(EcoRⅠ-F:5′-CCGGAATTCATGCACGGGAACGGCG-3′,XhoⅠ-R:5′-CCGCTCGAGCACTATACGTACCGGGG-CG- 3′),按照文献[19]的方法培养CIAV,CIAV感染MSB1细胞48~72 h后收集细胞悬液提取基因组,以基因组为模板,PCR扩增CIAV的VP2基因并克隆至原核表达载体pET-32a,转化到BL21(DE3)感受态细胞中构建表达菌株,同时设置转化pET-32a空载体组为对照。参考文献[20]进行诱导表达:将重组菌加入含有氨苄青霉素的LB液体中过夜培养,以1∶100的比例接种于含有氨苄青霉素的2×YT培养基中,约3 h后(OD600 nm=0.6~0.8)加入IPTG使其终浓度为0.1 mmol·L-1诱导4 h,所得菌液离心后,使用PBS洗涤并以1∶5的比例重悬,冰浴裂解5 min,分别取上清和沉淀15 μL进行SDS-PAGE分析。
1.3 蛋白样品的制备及小鼠免疫
按参考文献[20]方法制备蛋白样品并免疫小鼠。主要过程:将表达的重组蛋白进行SDS-PAGE后考马斯亮蓝染色并充分脱色,切下目的蛋白条带,将目的条带置于冻干机中过夜冻干后,加入适量PBS研磨,直至样品能顺畅地通过1 mL注射器。取6周龄的雌性BALB/c小鼠进行免疫,免疫方式均为腹腔注射,第4次免疫后72 h按照常规方法,用聚乙二醇(PEG1500)融合。
1.4 IFA筛选阳性杂交瘤细胞
用杆状病毒rBac-CIAV-VP2感染Sf9细胞,72 h 后以预冷的丙酮乙醇(3∶2)固定,作为IFA筛选抗原进行筛选:以杂交瘤上清为一抗,37 ℃孵育45 min,PBS洗4遍;再以FITC标记山羊抗鼠IgG(1∶200稀释)为二抗,37 ℃孵育45 min,PBS洗5遍, 最后滴加甘油于荧光显微镜下观察。将pCAGGS-VP2-Flag转染至DF1细胞,48 h后使用丙酮乙醇固定,用于阳性克隆的进一步验证。3次筛选后,对阳性克隆进行3次亚克隆,获得稳定分泌抗CIAV VP2蛋白的杂交瘤细胞株。取杂交瘤培养上清,按照SouthernBiotech公司的mAb亚类鉴定试剂盒对制备的mAb进行亚类鉴定。将阳性杂交瘤细胞株连续传代15代;各代次冻存6个月后复苏,并采用上述IFA检测杂交瘤细胞中的mAb。
1.5 单抗腹水制备以及效价测定
取8周龄的BALB/c小鼠,腹腔注射石蜡油500 μL·只-1,2周后腹腔注射杂交瘤细胞,每天观察腹部变化,待腹部明显膨大后,采集腹水。以rBac-CIAV-VP2感染的Sf9细胞为检测抗原,将腹水倍比稀释作为一抗,进行IFA效价检测。
1.6 Western blot鉴定
参考文献[21]中的方法进行Western blot的鉴定,将感染rBac-CIAV-VP2的Sf9细胞裂解产物、转染pCAGGS-VP2-Flag的DF1细胞裂解产物以及原核表达的His-VP2蛋白分别与5×SDS Loading Buffer以4∶1混匀并煮沸5 min作为蛋白样品,进行SDS-PAGE并转印至硝酸纤维素膜上。转印结束后,将硝酸纤维素膜置于5%脱脂乳中,37 ℃封闭1.5 h;以杂交瘤上清(1∶5稀释)为一抗,37℃孵育1 h,PBST洗4遍;再以HRP标记山羊抗鼠IgG(1∶30 000稀释)为二抗,37 ℃孵育45 min,PBST洗5遍后,经ECL发光显色液显色观察。
1.7 mAb特异性鉴定
将感染ALV-J的DF1细胞、感染LPAIV的MDCK细胞、感染MDV的CEF细胞固定作为检测原,IFA鉴定mAb的特异性,同时设置针对相应病毒的抗体5D3(ALV-J)、2A8(LPAIV)、BA4(MDV)为阳性对照。
1.8 mAb识别抗原表位的鉴定
参考文献[20]进行表位鉴定:以PCR扩增CIAVVP2基因的截短片段并连接入pET-32a表达载体,转入BL21(DE3)后经IPTG诱导表达截短蛋白,裂解菌体用于抗原表位的鉴定。参照“1.6”方法进行Western blot分析,鉴定截短蛋白与mAb的反应性,同时以鼠抗His标签抗体检测蛋白是否成功表达。所用到的截短蛋白引物见表1。
1.9 mAb识别表位的保守性分析
参照GenBank中23株国内外CIAV毒株VP2的氨基酸序列,登录号分别为AAA91822.1、AAB06180.1、AAC58476.1、AAD09422.1、BAA77832.1、AAG34179.1、AAM20897.1、AAL79913.1、AAL99895.1、AAK83006.1、ABJ90437.1、AAZ73182.1、ADJ18276.1、AEN71111.1、AFZ94856.1、AGW323371、AID81956.1、AIZ75615.1、AIV09094.1、ANA51883.1、APQ44720.1、ASL68907.1、ATG84571.1,利用DNAStar分析以上序列,对抗体识别氨基酸序列进行保守性分析。
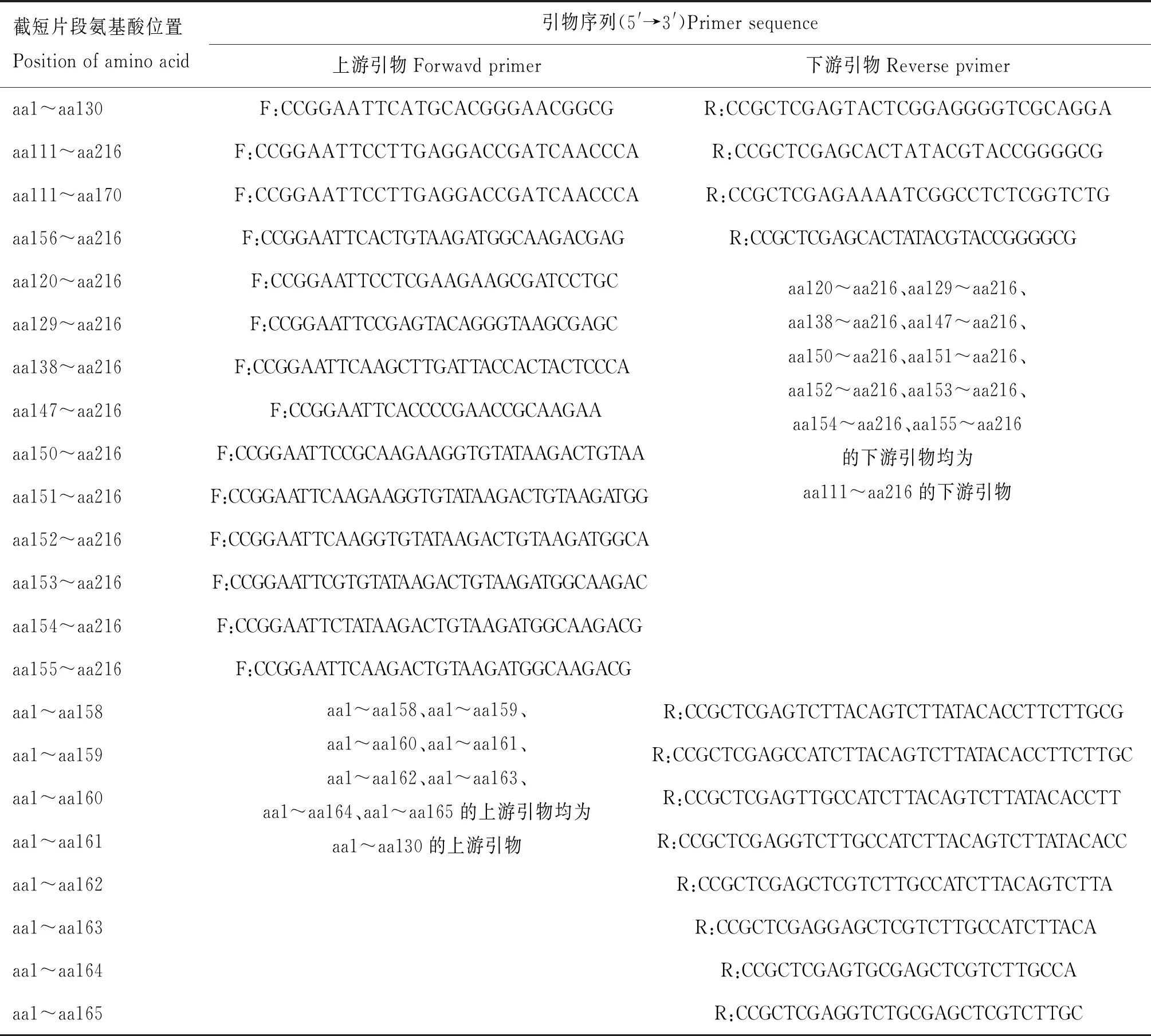
表1 截短表达CIAV VP2蛋白引物设计
2 结 果
2.1 His-VP2融合蛋白的表达
按照“1.2”中引物PCR扩增CIAV的VP2基因,经过1%琼脂糖凝胶电泳验证,结果成功扩增出目的基因,大小约为648 bp(图1A)。与pET-32a连接并转化BL21细菌,经SDS-PAGE结果显示,成功获得His-VP2融合蛋白,相对分子质量约50 ku(图1B)。
2.2 mAb的制备
取免疫后的小鼠脾细胞与SP2/0细胞融合,经过多次IFA筛选,结果成功筛选到1株稳定分泌针对CIAV VP2蛋白mAb的杂交瘤细胞株,命名为CIAV-VP2-4A12。该细胞株分泌的mAb可以与转染pCAGGS-VP2-Flag的DF1细胞以及感染杆状病毒rBac-CIAV-VP2后表达VP2蛋白的Sf9细胞反应(图2)。经过亚类鉴定试剂盒鉴定mAb CIAV-VP2-4A12重链为IgG1型,轻链为kappa链。经测定,腹水的IFA效价为1∶12 800。
2.3 Western blot鉴定
Western blot结果显示,mAb CIAV-VP2-4A12能与原核表达、杆状病毒系统表达以及转染DF1细胞表达的VP2蛋白反应,产生特异性条带(图3),杆状病毒表达的VP2蛋白经过加工修饰大小约为38 ku,转染pCAGGS-VP2-Flag(Flag标签大小为0.9 ku)的DF1细胞所表达的VP2大小约为35 ku。

A. CIAV VP2基因的PCR扩增结果(M. DL10000 DNA相对分子质量标准;1. VP2基因;2. 阴性对照);B. 原核表达VP2蛋白的SDS-PAGE分析(M. 蛋白质相对分子质量标准;1. pET-32a诱导后的上清;2. pET-32a诱导后的沉淀;3. pET-32a-VP2诱导后的上清;4. pET-32a-VP2诱导后的沉淀)A. PCR amplification result of CIAV VP2 gene (M. DL10000 DNA marker; 1. VP2 gene; 2. Negative control); B. SDS-PAGE analysis of prokaryotic expression of VP2 protein (M. Protein marker; 1. Supernatant of induced pET-32a lysate; 2. Precipitation of induced pET-32a lysate; 3. Supernatant of induced pET-32a-VP2 lysate; 4. Precipitation of induced pET-32a-VP2 lysate)图1 CIAV VP2基因的PCR扩增及原核表达VP2蛋白的SDS-PAGE分析Fig.1 Amplification of CIAV VP2 and SDS-PAGE analysis of recombinant protein His-VP2 expressed in E. coli
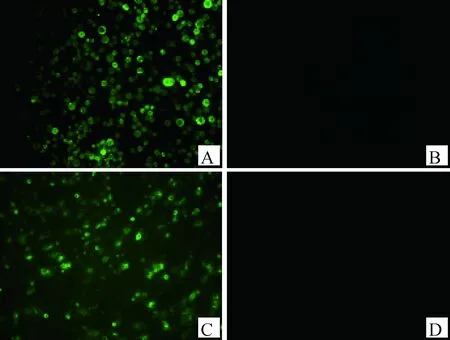
A. 感染rBac-CIAV-VP2的Sf9细胞;B. 感染野生型杆状病毒的Sf9细胞;C. 转染pCAGGS-VP2-Flag的DF1细胞;D. 转染pCAGGS的DF1细胞A. Sf9 cells infected with rBac-CIAV-VP2; B. Sf9 cells infected with wild baclovirus; C. DF1 cells transfected with pCAGGS-VP2-Flag; D. DF1 cells transfected with pCAGGS图2 mAb CIAV-VP2-4A12的IFA鉴定(400×)Fig.2 IFA Identification of mAb CIAV-VP2-4A12(400×)
2.4 特异性鉴定
将LPAIV、ALV-J、MDV感染的细胞经过固定后以mAb CIAV-VP2-4A12以及针对各自病毒的mAb为一抗,进行IFA鉴定,结果显示,阳性对照组均出现了特异性荧光,而mAb CIAV-VP2-4A12不与3种病毒反应(图4),说明mAb的特异性较好。
2.5 抗原表位的鉴定
将截短表达CIAV VP2蛋白作为抗原,以mAb CIAV-VP2-4A12和His标签抗体为一抗进行Western blot鉴定。结果显示,当VP2蛋白分为两段(aa1~aa130和aa111~aa216)表达时,mAb可以识别aa111~aa216(图5);将该区域分成两段,发现mAb识别的区域为aa111~aa170,而不与aa156~aa216反应(图5),说明mAb识别表位的N端位于aa111~aa156;再将VP2蛋白N端从aa111逐步截短表达,进一步确定mAb识别表位的N端位于aa147~aa156片段(图5)。为精确定位mAb识别序列的N端位置,将VP2蛋白N端从aa148开始逐个缺失表达,结果发现,mAb与片段aa155~aa216仍可以反应(图5),由上述结果可知,mAb不与aa156~aa216反应,故mAb CIAV-VP2-4A12识别表位的N端为aa155;之后将VP2蛋白C端从aa165逐个截短表达,发现mAb可以识别截短片段aa1~aa159而不识别aa1~aa158,说明mAb CIAV-VP2-4A12识别的最短序列aa155~aa159,该区域的氨基酸序列为155KTVRW159(图5)。
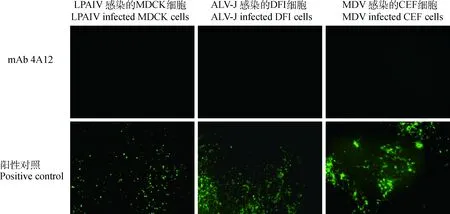
阳性对照所用抗体为2A8(LPAIV)、5D3(ALV-J)和BA4(MDV)The antibodies used in positive control were 2A8 (LPAIV),5D3(ALV-J) and BA4(MDV)图4 mAb CIAV-VP2-4A12 特异性鉴定(200×)Fig.4 Specific identification of mAb CIAV-VP2-4A12(200×)
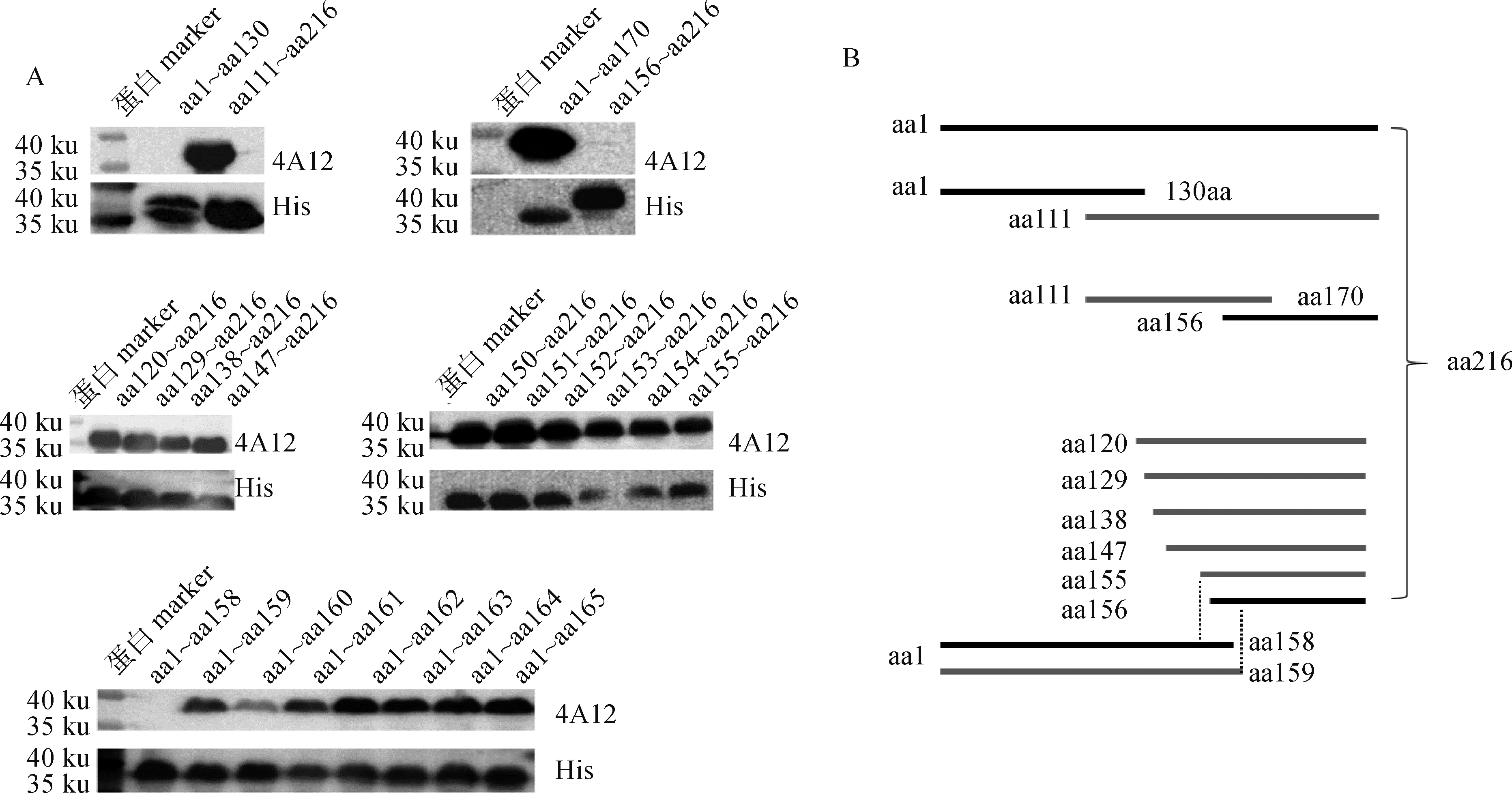
A. Western blot分析;B. 截短片段示意图A. Western blot analysis; B. Schematic diagram of the truncated fragments图5 mAb CIAV-VP2-4A12识别表位的定位Fig.5 Identification of antigen epitope recognized by mAb CIAV-VP2-4A12
2.6 抗原表位的保守性分析
在GenBank下载国内外的23株CIAV VP2氨基酸序列,并使用DNAStar软件分析mAb识别区域在不同毒株中的保守性,结果显示,CIAV的VP2蛋白在aa155~aa159处没有发生氨基酸突变(图6),表明mAb CIAV-VP2-4A12识别的氨基酸序列在各毒株间高度保守。

图6 mAb CIAV-VP2-4A12识别表位的保守性分析Fig.6 Conservative analysis of antigen epitope recognized by mAb CIAV-VP2-4A12
3 讨 论
CIAV是一种重要的禽类免疫抑制病,自1979年被发现以来,包括我国在内的多个国家陆续分离到该病原体[22-25],目前商品化疫苗防止该病的效果有限,且没有特效药可用于CIAV的治疗,对于该病及时准确的监测是防控中的重要环节[26-27]。
近年来,mAb以及抗原表位的研究成为疾病的防控的热门研究领域。通过病毒抗原及其mAb建立的阻断ELISA,相比于常规的ELISA,不会受到血清中的细胞因子等杂质的影响,极大提高了检测的特异性[16-18]。因此制备针对病毒蛋白的mAb并对其进行表位研究具有应用前景。CIAV目前只有1个血清型,在病毒的3个蛋白中,VP2蛋白在不同毒株中具有较高的保守性[28],是建立检测方法的理想抗原。鉴于CIAV生长速度缓慢,难以获得滴度较高的病毒,利用外源表达的病毒蛋白免疫小鼠制备mAb是制备CIAV mAb的主要途径[29-31]。本研究在制备VP2蛋白mAb时选择原核表达的VP2重组蛋白为免疫原,并尝试使用切胶纯化直接免疫小鼠,省去了变性纯化等步骤,节约了时间与成本。在筛选mAb时,为了避免非特异性抗体的产生,不同于陆桂丽等[30]和陈延飞[31]使用原核表达的抗原进行间接ELISA筛选,本研究采用真核系统表达的VP2蛋白进行IFA筛选,提高了筛选方法的特异性,最终获得了高效价的特异性mAb。
目前,与VP2蛋白抗原表位的相关研究较少,陈延飞等[31]和王晓燕等[32]制备了VP2蛋白的mAbs并初步定位识别表位,发现所制备mAbs的识别区域分别位于VP2蛋白的aa21~aa36、aa111~aa126、aa121~aa136以及aa20~aa40,但均未精确定位具体识别的氨基酸。为了研究已制备的mAb针对的抗原表位与先前报道是否存在差异,本研究通过逐步截短表达VP2蛋白,采用Western blot方法检测与不同截短蛋白的反应性,对表位进行精确定位,确定该mAb识别抗原表位为aa155~aa159,发现了不同于前人鉴定的新的抗原表位并定位至5个氨基酸,经过同源性比较分析,发现国内外不同毒株在该识别区域十分保守,具有潜在应用前景。
4 结 论
成功制备针对CIAV VP2蛋白的mAb,确定其识别表位为155KTVRW159,为VP2蛋白结构与功能的研究以及CIAV检测方法的建立奠定了基础。

