FliC蛋白R91S突变对肠炎沙门菌鞭毛形态和小鼠体内定植的影响
王 俊,李 军,崔国林
(1. 嘉兴职业技术学院,嘉兴 314036;2. 河北工程大学 生命科学与食品工程学院,邯郸 056038)
鞭毛是沙门菌重要的运动器官,帮助其在液体环境中改变运动状态和运动方向[1]。正常情况下,当细菌所处周围环境的pH、温度、盐离子浓度等条件发生变化时,细菌细胞膜受体蛋白感应刺激,信号蛋白磷酸化结合至C环结构蛋白FliM、FliN等,引起C环构象改变,质子流向鞭毛马达,向其施加扭转力导致细菌鞭毛形态改变从而切换运动状态,这一过程是由鞭毛形态控制细菌的运动状态[2-4]。
沙门菌鞭毛蛋白FliC由末端的保守区域D0、D1和中间的高变区域D2、D3构成[5]。D0和D1区域参与TLR5识别和鞭毛丝结构组成,D2和D3区域参与体液免疫应答[6]。FliC蛋白的氨基酸序列与鞭毛形态和细菌运动性之间存在相关关系。Kanto等[7]发现部分鼠伤寒沙门菌菌株FliC蛋白的单个或两个氨基酸突变导致鞭毛产生多种形态,氨基酸序列分析表明,突变位点均位于N端和C端的α螺旋结构。Smith等[8]通过比对鼠伤寒沙门菌与大肠杆菌、铜绿假单胞杆菌、枯草芽胞杆菌、单核细胞增生李斯特菌等fliC基因的TLR5识别区域,将其中高度保守的氨基酸依次置换成丙氨酸后发现部分位点替换后仅能降低TLR5识别,而部分位点替换能够导致细菌运动性的完全丧失。由此可见,鞭毛蛋白氨基酸序列与鞭毛运动性密切相关。Hayashi等[9]分离4株突变株,鞭毛形态由钝直转变为超螺旋,涉及7个新鉴定的氨基酸突变位点均位于D1区域。Wang等[10]鉴定鼠伤寒沙门菌FliC蛋白D108A、N133A和D152A突变导致鞭毛蛋白亚基之间的氢键作用力破坏从而改变鞭毛形态和细菌运动性。目前关于肠炎沙门菌的FliC蛋白氨基酸位点与鞭毛形态及细菌运动性之间相关性尚不明确。
本研究通过比对分析D群的肠炎沙门菌、鸡伤寒沙门菌和鸡白痢沙门菌的FliC蛋白氨基酸序列发现存在第91位、第339位、第431位3个氨基酸位点差异,进一步序列比对结果揭示,仅鸡白痢沙门菌第91位点为丝氨酸,肠炎沙门菌、鸡伤寒沙门菌、鼠伤寒沙门菌等23个血清型均为精氨酸。运动性试验、鞭毛形态结构观察、细胞感染试验和动物感染试验揭示了肠炎沙门菌第91位精氨酸是维持鞭毛形态结构和运动性的关键氨基酸,第91位精氨酸突变为丝氨酸能够减弱肠炎沙门菌黏附入侵细胞和小鼠体内定植能力。
1 材料与方法
1.1 菌株、质粒和细胞
肠炎沙门菌CICC10467购自中国工业微生物菌种保藏中心,鸡白痢沙门菌ATCC13036购自美国菌株保藏中心(ATCC)。pKD3质粒、pKD46质粒和pCP20质粒由中国农业大学动物医学院吴文学研究员惠赠;pBR322质粒由中国农业大学动物医学院吴清民教授惠赠。RAW264.7和HCT116细胞购自国家实验细胞资源共享服务平台。
1.2 实验动物
7日龄SPF雏鸡购自勃林格殷格翰维通生物技术(北京)有限公司,6~8周雌性BALB/c小鼠购自斯贝福(北京)有限公司。
1.3 fliC基因序列比对
从GenBank数据库下载肠炎沙门菌部分菌株基因组序列、鸡白痢和鸡伤寒沙门菌全部菌株基因组序列,截取fliC基因序列进行氨基酸序列比对。
1.4 肠炎沙门菌fliC基因突变株及回补株构建
参考Yang等[11]构建沙门菌基因缺失株和回补株方法,运用λ-Red同源重组方法删除肠炎沙门菌CICC10467fliC基因,以pBR322质粒为骨架构建反式回补株,分别命名为肠炎沙门菌fliC基因回补株(ΔfliC::S. EnteritidisfliC)和7个以肠炎沙门菌FliC蛋白为骨架仅置换鸡白痢沙门菌FliC蛋白差异位点的回补株,包括第91位突变回补株(ΔfliC::R91S)、第339位突变回补株(ΔfliC::Q339K)、第431位突变回补株(ΔfliC::A431T)、第91和第339位双突变回补株(ΔfliC::R91S/Q339K)、第91和第431位双突变回补株(ΔfliC::R91S/A431T)、第339和第431位双突变回补株(ΔfliC::Q339K/A431T)和第91位、第339位及第431位突变回补株(ΔfliC::R91S/Q339K/A431T)。
1.5 肠炎沙门菌野生株、缺失株和回补株的生长特性分析
分别将野生株和回补株的过夜培养物浓度调整至OD600 nm约为1.0,以1∶100接种至25 mL新鲜TSB培养基中,37 ℃、200 r·min-1振荡培养,每2 h测定培养物OD600 nm值。
1.6 运动性试验
将过夜培养菌液浓度调整至OD600 nm=1.0,移液器吸取2 μL滴加至LB肉汤(0.3%琼脂),37 ℃培养6 h,测量细菌运动圈直径并拍照。
1.7 透射电镜观察
向过夜培养的平板中加入3 mL无菌水放置5 min,将铜网置于无菌水液面上静置5 min,取出铜网置于干净滤纸上吸取多余水分,放置于100 μL 2%磷钨酸中负染5 min,迅速用滤纸吸去磷钨酸,透射显微镜观察。
1.8 细胞黏附和入侵试验
1.8.1 细胞准备 将RAW 264.7细胞以4×105个·孔-1接种至24孔板,37 ℃、5% CO2培养过夜使细胞密度达到80%。PBS洗涤过夜培养的细菌培养物1次,预热的RMPI-1640基础培养液稀释菌液浓度至3×107CFU·mL-1,然后进行黏附和入侵试验。
1.8.2 细胞黏附试验 1 μg·mL-1Cytochalasin D 37 ℃预处理细胞1 h,无菌PBS彻底洗去Cytochalasin D。以MOI=10感染细胞,37 ℃继续孵育60 min。冰水裂解细胞10 min,收取裂解液进行梯度稀释,取100 μL涂布于TSA平板,37 ℃培养18 h后计数。将HCT116细胞以5×105个·孔-1接种至24孔板,37 ℃、5% CO2条件培养过夜使细胞密度达到90%。将细胞置于4 ℃预处理30 min。PBS洗涤过夜培养的细菌培养物1次,预热的RMPI-1640基础培养液稀释菌液浓度至4.5×107CFU·mL-1。以MOI=10感染细胞,4 ℃条件孵育30 min。PBS洗涤细胞3次。冰水裂解细胞10 min,将细胞裂解液梯度稀释,取100 μL涂布于TSB平板,37 ℃培养16 h后计数。
1.8.3 细胞入侵试验 以MOI=10感染细胞,37 ℃、5% CO2条件孵育50 min。PBS洗涤细胞3次。加入含100 μg·mL-1庆大霉素的RMPI-1640培养液继续培养2 h,冰水裂解细胞,对裂解细胞液进行梯度稀释,取100 μL涂布于TSB平板,37 ℃培养16 h后计数。HCT116细胞感染过程同RAW264.7细胞[12]。
1.9 间接免疫荧光试验
将RAW264.7细胞以4×105个·孔-1接种至24孔板,37 ℃、5% CO2条件培养过夜使细胞密度达到90%。将细胞置于4 ℃预处理30 min。PBS洗涤过夜培养的细菌培养物1次,预热的RMPI-1640基础培养液稀释菌液浓度至4.5×107CFU·mL-1。以MOI=10感染细胞,4 ℃孵育30 min。PBS洗涤细胞3次。固定液室温固定细胞20 min;PBS温和洗涤3次;将鸭源抗肠炎沙门菌阳性血清1∶200稀释,室温孵育1 h后,PBS温和洗涤3次;将FITC标记山羊抗鸭二抗1∶100稀释,室温孵育1 h;PBS温和洗涤3次;DAPI孵育10 min后PBS温和洗涤3次;荧光显微镜观察。
1.10 动物感染试验
菌株准备步骤同“1.8”。75只6~8周龄雌性BALB/c小鼠随机分成5组,A组(WT)、B组(ΔfliC)、C组(ΔfliC::S. EnteritidisfliC)、D组(ΔfliC::R91S)为试验组,E组为空白对照组,每组15只。试验组小鼠每只腹腔注射1×105CFU沙门菌,对照组注射无菌PBS,分别在感染后的6、24、48 h每组处死5只,取肝和脾,制成20%组织悬液,梯度稀释后涂布至XLD琼脂平板,37 ℃培养18 ~24 h后计数。
1.11 数据统计与分析
氨基酸序列比对分析使用DNASTAR Lasergene 软件包Megalign 7.0软件,同源建模使用在线软件SWISS-model,遗传进化分析使用MEGA 7.0软件,其他数据分析使用GraphPad Prism 7.0软件。差异显著性检验采用One-way ANOVA和Two-way ANOVA,ns.P≥0.05; *.P<0.05; **.P<0.01; ***.P<0.001; ****.P<0.000 1。
2 结 果
2.1 FliC第91位氨基酸差异在肠炎和鸡白痢沙门菌血清型间高度保守
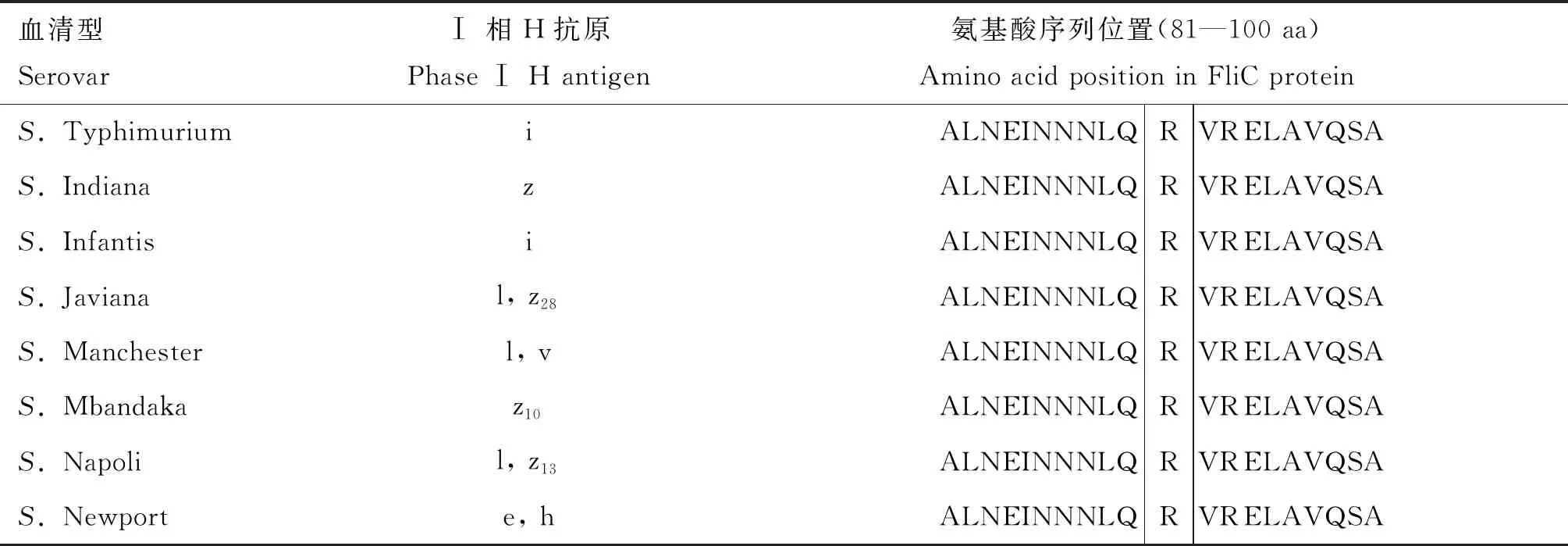
比对分析GenBank数据库中存在的肠炎、鸡白痢和鸡伤寒沙门菌FliC蛋白氨基酸序列,结果表明肠炎和鸡伤寒沙门菌的序列完全一致,肠炎和鸡白痢沙门菌存在两种差异位点类型,分别命名为鸡白痢沙门菌Type Ⅰ型和Type Ⅱ型,氨基酸位点差异分别是位于ND1区域的第91位、D3区域的第339位和CD2区域的第431位(表1)。进一步比对部分鞭毛型不同的沙门菌血清型FliC蛋白的氨基酸序列发现第91位精氨酸在肠炎沙门菌、鸡伤寒沙门菌、鼠伤寒沙门菌等23个血清型间高度保守,仅鸡白痢沙门菌为丝氨酸(表2)。

表1 D群3个沙门菌血清型FliC蛋白氨基酸序列比对
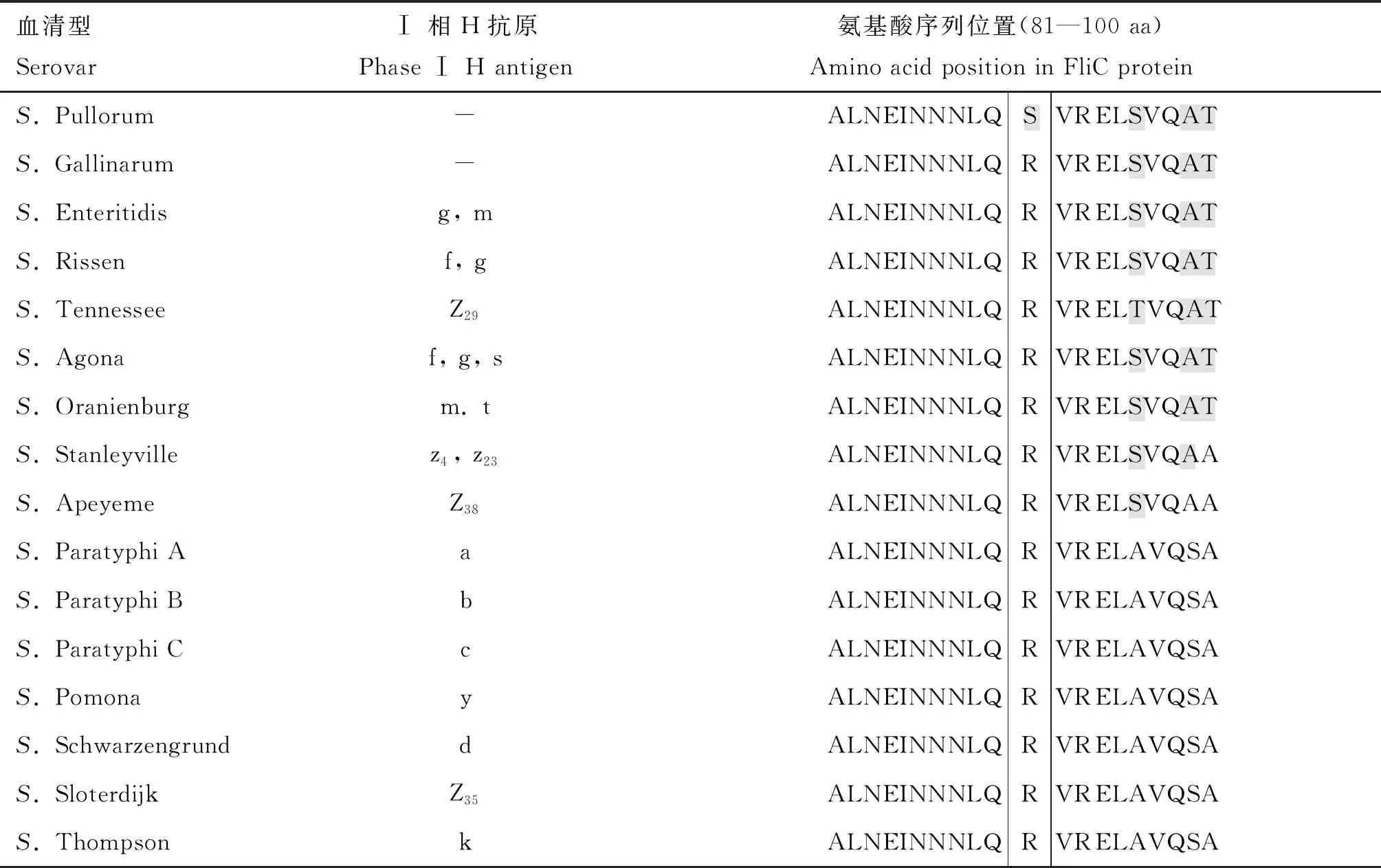
表2 部分沙门菌血清型FliC蛋白氨基酸序列比对
(转下页 Carried forward)
2.2 肠炎沙门菌fliC基因缺失株和突变回补株构建
PCR扩增结果表明,运用同源重组技术成功删除肠炎沙门菌CICC10467fliC基因,通过pBR322质粒成功构建8个反式回补株,Western blot分析表明,各回补株的FliC蛋白表达量与野生株基本一致,fliC基因缺失株不表达FliC蛋白(图1A)。体外生长试验结果显示,野生株、fliC基因缺失株和各突变回补株在TSB培养基中生长速度无显著差异(P≥0.05)(图1B)。
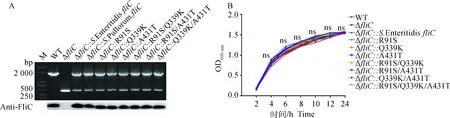
A. 野生株、缺失株和反式回补株的PCR和Western blot鉴定;B. 野生株、缺失株和反式回补突变株生长特性分析,菌株之间生长差异显著性检验采用 One-way ANOVA, ns. 差异不显著(P≥0.05)。WT.肠炎沙门菌CICC10467野生株;ΔfliC. 肠炎沙门菌CICC10467 fliC基因突变株;ΔfliC::S. Enteritidis fliC. 肠炎沙门菌CICC10467 fliC基因回补株;ΔfliC::R91S/Q339K/A431T. R91S、Q339K和A431T反式回补突变株;ΔfliC::R91S. R91S反式回补突变株;ΔfliC::Q339K. Q339K反式回补突变株;ΔfliC::A431T. A431T反式回补突变株;ΔfliC::R91S/Q339K. R91S和Q339K反式回补突变株;ΔfliC::R91S/A431K. R91S和A431K反式回补突变株;ΔfliC::Q339K/A431K. Q339K和A431K反式回补突变株,下图同A. PCR and Western blot identification for wild type, mutant and complements; B. Growth analysis of wild type, mutant and trans-complemented strains. Growth characteristic of wild type, fliC mutant and trans-complemented strains was analyzed by One-way ANOVA, ns. No significant (P≥0.05). WT, ΔfliC, ΔfliC::S. Enteritidis fliC, ΔfliC::R91S/Q339K/A431T, ΔfliC::R91S, ΔfliC::Q339K, ΔfliC::A431T, ΔfliC::R91S/Q339K, ΔfliC::R91S/A431K, ΔfliC::Q339K/A431K denoted S. Enteritidis CICC10467 wild type, fliC mutant, S. Enteritidis fliC trans-complemented strain, R91S/Q339K/A431T trans-complemented strain, R91S trans-complemented strain, Q339K trans-complemented strain, A431T trans-complemented strain, R91S/Q339K trans-complemented strain, R91S/A431K trans-complemented strain, Q339K/A431K trans-complemented strain, respectively, the same as below图1 沙门菌野生株、fliC缺失株和反式回补突变株鉴定Fig.1 Identification of wild type, fliC mutant and trans-complemented strains
2.3 FliC第91位精氨酸突变减弱肠炎沙门菌鞭毛运动性
运动性试验结果显示,S. EnteritidisfliC回补株和R91S/Q339K/A431T回补株的运动性恢复至野生株的80%,fliC基因缺失株运动能力丧失,R91S、R91S/Q339K、R91S/A431T回补株与缺失株的运动能力基本一致,并且显著低于野生株(P<0.000 1)(图2)。结果表明,FliC第91位精氨酸置换为丝氨酸后导致肠炎沙门菌运动性丧失。
2.4 FliC第91位精氨酸突变改变肠炎沙门菌鞭毛形态
研究表明,细菌鞭毛形态与运动性密切相关,为进一步探究FliC第91位精氨酸突变为丝氨酸是否通过改变肠炎沙门菌的鞭毛形态从而改变其运动性,通过透射电镜观察发现,S. EnteritidisfliC和R91S/Q339K/A431T(Type Ⅱ)回补株的鞭毛形态与野生株基本一致,Q339K、A431T和Q339K/A431T回补株鞭毛形态基本一致,弯曲程度大,柔韧性较强,R91S、R91S/Q339K和R91S/A431T回补株均存在第91位精氨酸突变,鞭毛形态与野毒株明显不同,形态钝直柔韧性较低,表明FliC蛋白R91S突变导致鞭毛的形态发生改变从而影响其运动性(图3)。同时揭示了肠炎沙门菌运动性、鞭毛形态和氨基酸位点三者之间密切相关性,第91位、第339位和第431位3个氨基酸位点存在结构互作使得沙门菌鞭毛形态得到一定程度恢复。
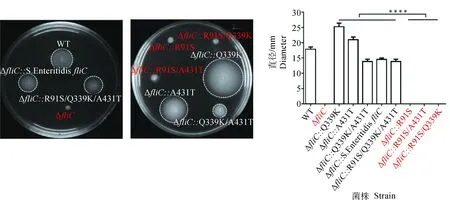
菌株之间运动性的差异显著性检验采用 One-way ANOVA, ****.P<0.000 1Comparisons of colony diameter was analyzed by One-way ANOVA, ****.P<0.000 1图2 野生株、fliC基因突变株和反式回补突变株的运动性分析Fig.2 Motility analysis of wild type, fliC mutant and trans-complemented strains
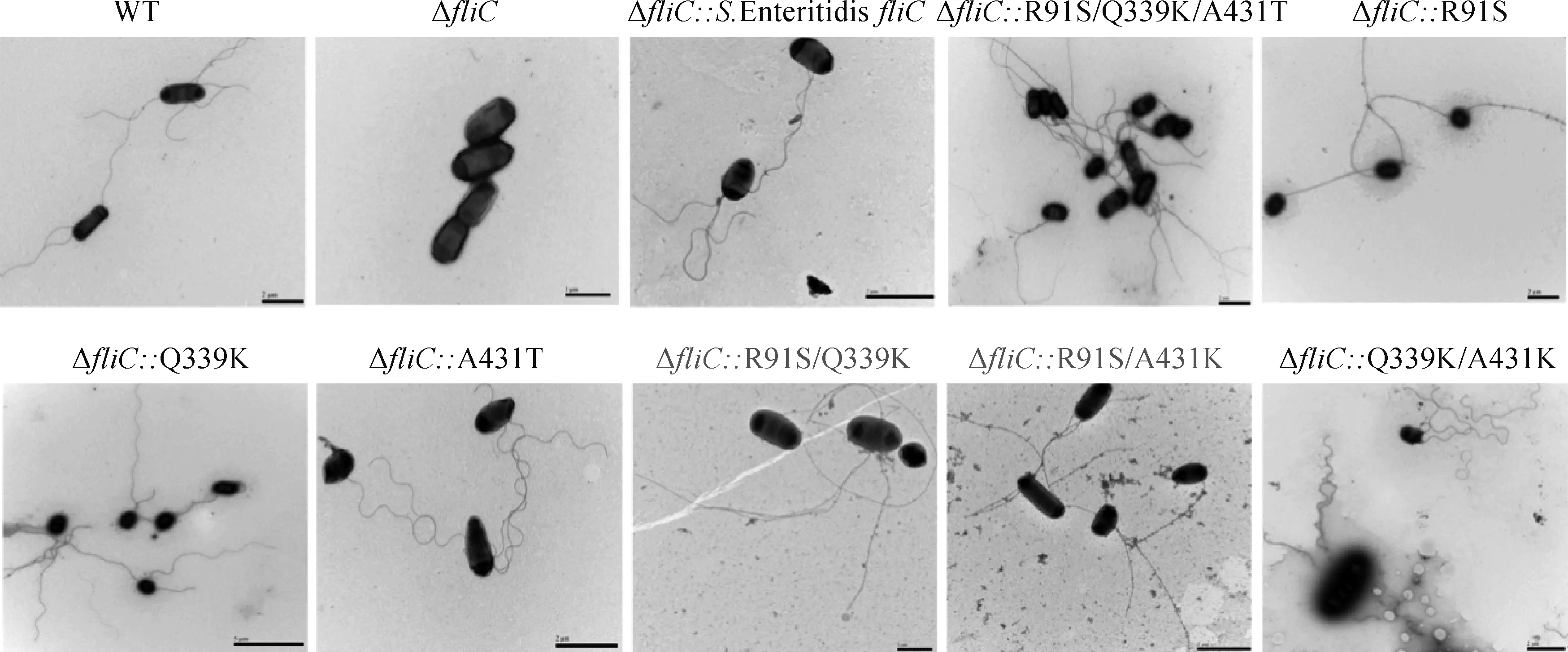
图3 野生株、fliC基因突变株和反式回补突变株鞭毛的透射电镜图(Bar=2 μm)Fig.3 Transmission electron micrograph of flagellum on wild type, fliC mutant and trans-complemented strains (Bar=2 μm)
2.5 FliC第91位氨基酸突变降低肠炎沙门菌黏附和入侵细胞能力
为探究FliC第91位精氨酸突变为丝氨酸对细菌的细胞黏附和入侵能力的影响,通过结肠癌细胞HCT116和小鼠腹腔巨噬细胞RAW264.7的感染试验证实S. EnteritidisfliC回补株和R91S/Q339K/A431T回补株的细胞黏附和入侵能力显著强于fliC缺失株(P<0.01),R91S、R91S/Q339K、R91S/A431T回补株与fliC基因缺失株的黏附和入侵细胞能力无显著差异(P≥0.05)并且均显著低于亲本毒株(P<0.001)(图4)。间接免疫荧光试验获得相似的结果(图5)。以上结果揭示R91S突变能够显著减弱肠炎沙门菌对HCT116和RAW264.7细胞的黏附和入侵能力。
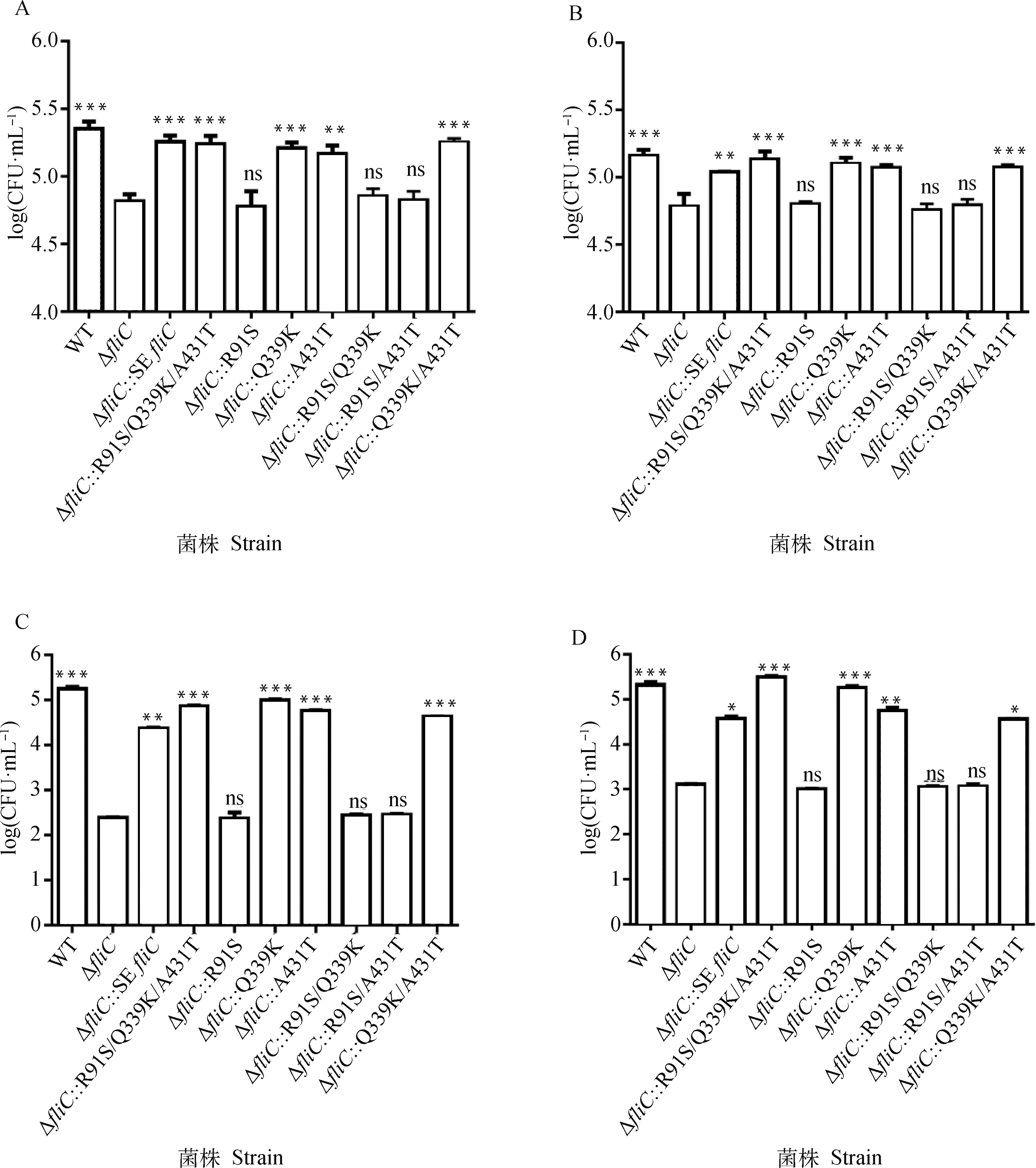
黏附试验:分别将HCT116(A)和RAW264.7 细胞(B)4 ℃预冷 30 min,以MOI=10感染细胞后 4 ℃继续孵育30 min,裂解细胞收集裂解液,稀释后进行平板计数;入侵试验:以MOI=10菌量分别感染 HCT116(C)和RAW264.7细胞(D),37 ℃孵育2 h 后,裂解细胞收集裂解液,稀释后进行平板计数;采用One-way ANOVA进行显著性检验(ns.P≥0.05; *.P<0.05; **.P<0.01; ***.P<0.001)For adhesion assay, HCT116 (A) and RAW 264.7 (B) cells were precooled at 4 ℃ for 30 min, cells were lysed after infecting with strains (MOI=10) at 4 ℃ for 30 min, then inoculated TSA plate for bacteria mount; For invasion assay, HCT116 (C) and Raw2647 (D) cells were lysed after infecting with strains (MOI=10) at 37 ℃ for 2 h, followly inoculated TSA plate for bacteria amount, comparison of bacterial load were analyzed by One-way ANOVA (ns. P≥0.05; *.P<0.05; **.P<0.01; ***.P<0.001)图4 野生株、fliC基因突变株和反式回补突变株对HCT116细胞和RAW264.7细胞的黏附和入侵Fig.4 Adhesion and invasion assay of wild type, fliC mutant and trans-complemented strains in HCT116 cells and RAW264.7 cells
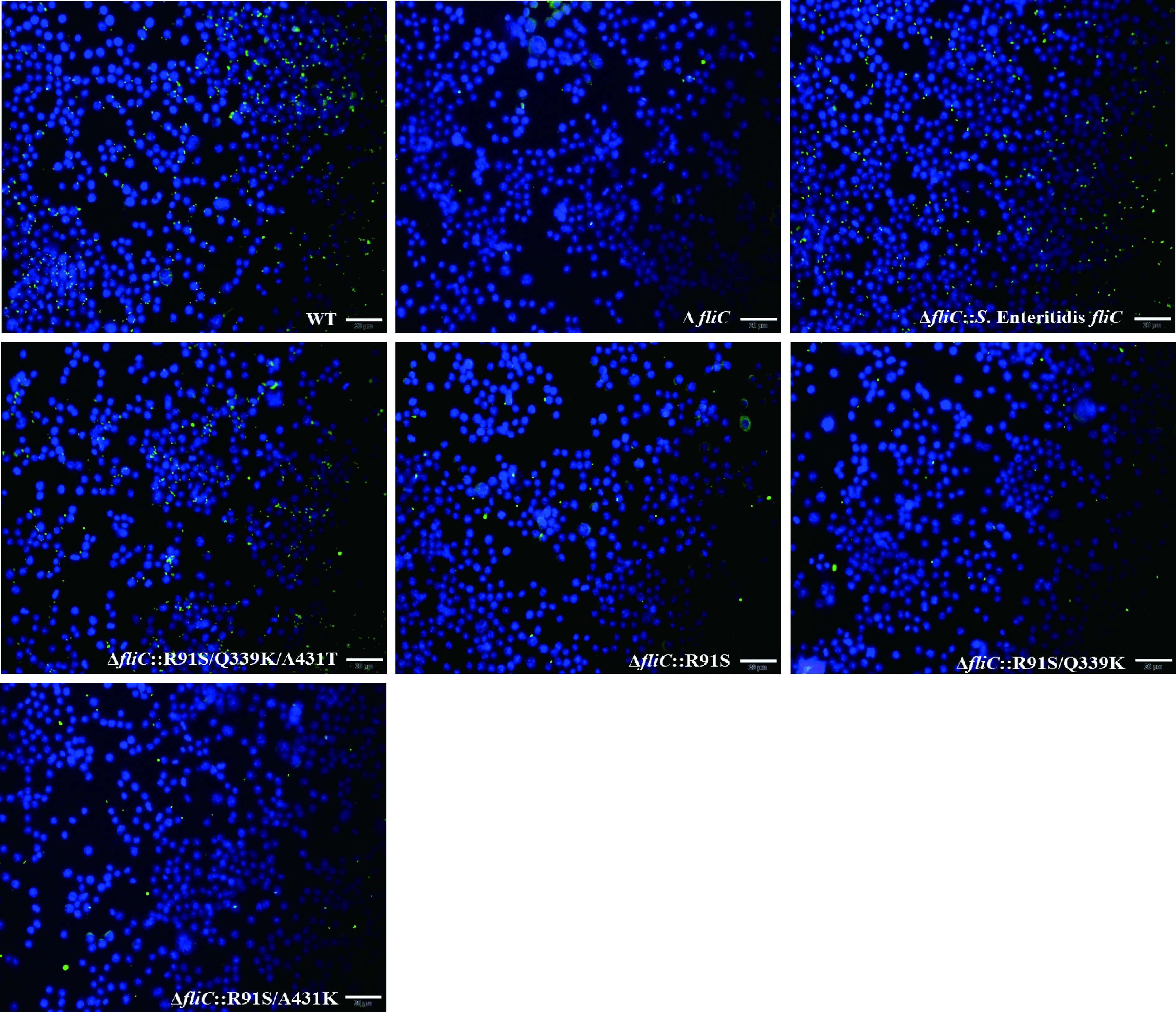
蓝色荧光表示RAW264.7细胞核,绿色荧光表示肠炎沙门菌Blue fluorescence and green fluorescence represented nucleus of RAW264.7 cells and Salmonella Enteritidis, respectively图5 间接免疫荧光试验鉴定各菌株对RAW264.7细胞的黏附能力(400×)Fig.5 Adhesion ability of each Salmonella strain to RAW264.7 cells identified by indirect immunofluorescence assay (400×)
2.6 FliC第91位氨基酸突变减弱肠炎沙门菌在动物体内定植能力
BALB/c小鼠腹腔注射感染各菌株后,评估各组肝和脾中细菌载量,细菌计数结果显示,感染后6、24、48 h,fliC缺失株和R91S回补株感染的小鼠器官载量无显著差异,野生株和S. EnteritidisfliC回补株感染的小鼠器官载量无显著差异,野生株和S. EnteritidisfliC回补株入侵小鼠肝和脾能力显著高于fliC缺失株和R91S回补株(P<0.001或P<0.000 1)(图6),以上结果提示fliC基因缺失影响肠炎沙门菌在BALB/c小鼠肝和脾的定植能力,R91S突变能够减弱肠炎沙门菌的体内定植能力。
细菌感染后24 h肝和脾载菌量整体均呈现下降趋势,48 h时组织中的细菌载量高于24 h,并且fliC缺失株和R91S回补株的器官载量显著低于野生株和S. EnteritidisfliC回补株(P<0.000 1),表明感染后48 h细菌出现增殖,fliC基因缺失株和R91S突变株的黏附和入侵能力减弱直接影响其胞内增殖(图6)。
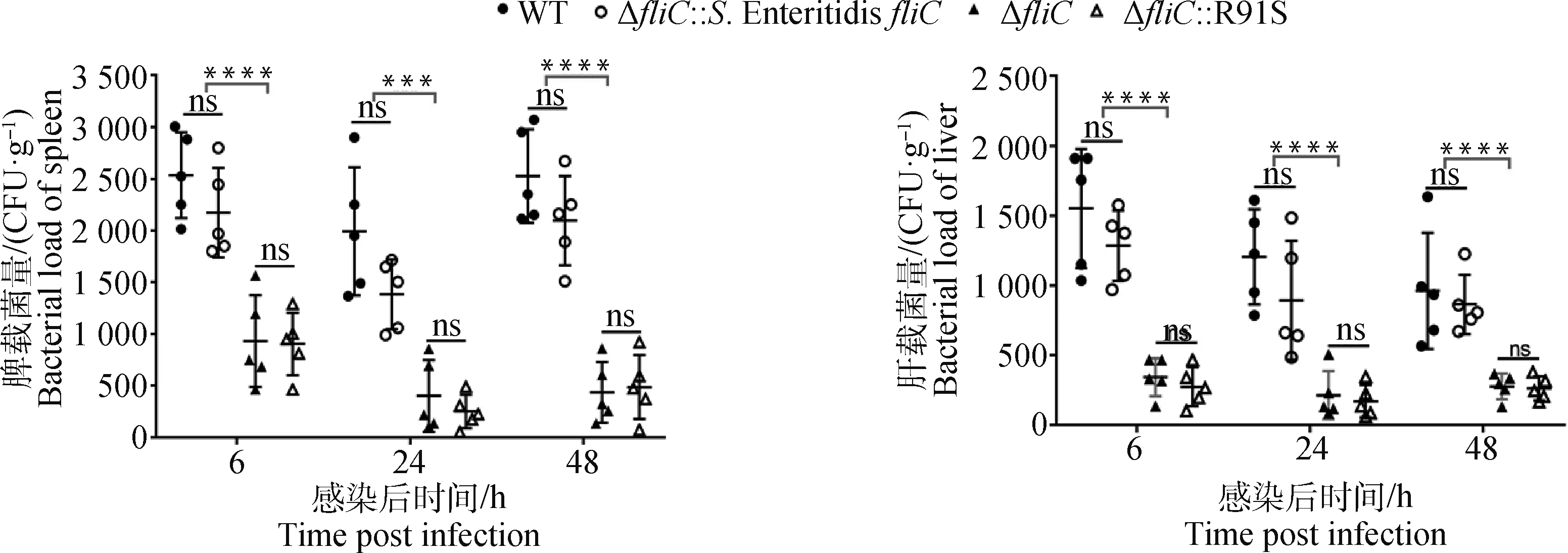
105CFU肠炎沙门菌野生株或突变株腹腔感染BALB/c小鼠,感染后6、24、48 h测定肝和脾的载菌量;显著性检验采用Two-way ANOVA,ns. P≥0.05; *.P<0.05; **.P<0.01; ***.P<0.001; ****.P<0.000 1BALB/c mice were intraperitoneally infected with 1×105CFU Salmonella Enteritidis wild type and mutations. At 6, 24, 48 h post infection, the bacterial load were assessed on liver and spleen; Comparison of bacterial load was analyzed by Two-way ANOVA with: ns. P≥0.05; *.P<0.05; **.P<0.01; ***.P<0.001; ****.P<0.000 1图6 FliC第91位精氨酸突变对肠炎沙门菌体内定植能力的影响Fig.6 The effect of 91 arginine mutation in FliC protein on colonization of Salmonella Enteritidis in vivo
3 讨 论
细菌的鞭毛是复杂的运动器官,形成过程需要多个结构基因和调控基因参与[13]。鸡白痢沙门菌不表达鞭毛,从而能够有效避免引发宿主的促炎反应[14]。本研究前期通过功能基因序列分析揭示flgK基因在373 bp处碱基突变形成终止子,导致FliC蛋白翻译过程提前终止[15],flhB基因存在197 bp的片段缺失,推测这两个基因的突变可能导致鸡白痢血清型不能形成鞭毛。进一步的氨基酸序列比对发现鸡白痢FliC蛋白与肠炎沙门菌也存在2~3个不同的氨基酸位点。以鼠伤寒沙门菌FliC蛋白同源建模发现3个氨基酸位点分别位于D1和D2区域。Vonderviszt等[16]研究揭示鼠伤寒沙门菌D1区域是影响鞭毛丝稳定性和多态性构象的主要位置。结构预测显示相邻两个鞭毛单体的D1区域和D2小部分区域形成的凸面和凹面围绕中心轴相互作用形成鞭毛原丝结构[17]。Smith等[8]将D1区域的第84位谷氨酸、第91位精氨酸和第95位亮氨酸突变为丙氨酸后,鼠伤寒沙门菌的运动性基本丧失,而第90位谷氨酰胺、第101位天冬酰胺等突变后并不影响细菌运动性,可见D1区域中存在参与鞭毛空间结构形成的关键氨基酸位点。本研究经氨基酸序列比对发现仅鸡白痢沙门菌FliC蛋白第91位为丝氨酸并且在血清型内高度保守,其他23个不同鞭毛抗原型沙门菌血清型均为精氨酸。将肠炎沙门菌第91位精氨酸置换为丝氨酸后,肠炎沙门菌运动性基本丧失,此结果与Smith等[8]将精氨酸置换位丙氨酸所获得的结果一致,表明第91位精氨酸是维持肠炎沙门菌运动性的关键氨基酸。进一步的透射电镜观察鞭毛形态明确表明R91S突变引起鞭毛形态发生显著变化,揭示鞭毛丝形态和细菌运动性之间存在相关性,鞭毛形态变得钝直,柔韧性下降可能是导致其运动性丢失的主要原因,这与Kanto等[7]的研究结果基本符合,FliC蛋白部分氨基酸位点改变能够直接影响鞭毛丝的形态。沙门菌鞭毛丝由11根鞭毛原丝(protofilament)构成,约3 000个鞭毛蛋白亚基参与组成,鞭毛原丝形态分为L型和R型两种,通过相互切换改变鞭毛形态从而改变运动状态[9]。Wang等[10]解析鼠伤寒沙门菌鞭毛蛋白结构揭示呈纵向排列的两个鞭毛蛋白亚基之间的接触面均位于FliC蛋白N端的α螺旋结构,通过氢键相互作用,参与氢键构成的氨基酸残基突变导致R型鞭毛原丝转变为L型,从而改变鞭毛形态。鼠伤寒沙门菌FliC第91位精氨酸残基参与氢键构成,同源建模揭示肠炎沙门菌FliC第91位精氨酸与鼠伤寒沙门菌具有相似的空间结构位置,R91S突变改变鞭毛形态和细菌运动性可能与鞭毛原丝构象发生变化有关。Zhang等[18]研究表明,鼠伤寒沙门菌FliC蛋白氨基酸序列89—96 aa区域缺失导致TLR5无法识别,至于肠炎沙门菌第91位精氨酸突变为丝氨酸是否影响TLR5受体识别和体液免疫应答反应还需要进一步研究。Hayashi等[9]鉴定了多个新的第2突变位点能够帮助沙门菌的鞭毛丝形态从钝直转变为超螺旋结构,并且第2突变位点均位于D1区域。本研究中发现的第2位点(339位)和第3位点(431位)也是首次鉴定的参与鞭毛形态从钝直转变为螺旋型过程的两个氨基酸位点,3个位点空间结构相互作用使得鞭毛转变为螺旋型。本研究中鉴定出鸡白痢沙门菌fliC基因存在两种形式,遗传进化分析表明,两个基因型鸡白痢菌株位于相关的两个进化分枝,Ⅱ型鸡白痢菌株较Ⅰ型菌株可能发生适应性进化,全基因组序列分析表明,鸡白痢沙门菌毒力和代谢基因可能从祖代菌株914CE产生多样性变异[19]。Ⅰ型和Ⅱ型鸡白痢菌株产生两种不同的运动表型,这与鞭毛形态差异密切相关[20]。沙门菌的鞭毛参与细菌的肠道定植和感染过程[21-22],这与本研究结果揭示的细菌运动性丢失导致肠炎沙门菌对HCT116细胞和RAW264.7细胞的黏附和入侵能力显著下降现象基本符合,BALB/c小鼠的感染试验结果也充分揭示这一现象。综上,本研究揭示了FliC第91位精氨酸是维持肠炎沙门菌鞭毛形态和细菌运动性的关键位点,精氨酸突变改变鞭毛形态,减弱肠炎沙门菌在小鼠体内的定植能力。鞭毛参与细菌的致病过程同时又作为抗原刺激机体产生免疫应答[23-24]。
4 结 论
肠炎沙门菌FliC蛋白第91位精氨酸在鸡伤寒沙门菌、鼠伤寒沙门菌、甲型副伤寒沙门菌等23个血清型内高度保守,R91S突变能够改变肠炎沙门菌的鞭毛形态,减弱肠炎沙门菌的运动性,细胞黏附入侵能力及小鼠体内定植能力,为肠炎沙门菌的疫苗研发提供理论基础。

