miR-193a-3p通过富亮氨酸α2糖蛋白1/鞘氨醇激酶1信号通路抑制口腔鳞状细胞癌增殖与侵袭
何思思 李国良 黄鹏程
(郴州市第一人民医院南院,1 健康管理中心,2 口腔科,郴州 423000)
口腔鳞状细胞癌占头颈部鳞状细胞癌的50%左右[1]。其中,舌癌在临床上最为常见,约占50%[2]。口腔鳞癌的转移能力较强,可通过淋巴等浸润周围组织,还可造成口腔功能异常,影响患者生活质量、危害患者生命安全[3-5]。有关研究表明,microRNAs和蛋白因子对癌细胞癌具有一定的治疗作用,microRNAs具有调控基因水平的能力,机体内有近半数的基因受microRNAs调控,且其还贯穿肿瘤产生及发展的全过程,并可影响癌细胞的生物学行为。miR-193a-3p是microRNAs的一种,为抑癌基因,且已有研究证实其在食管癌等多种肿瘤中为低表达[6-7]。富亮氨酸α2糖蛋白1(LRG-1)属于富亮氨酸重复蛋白(LRR)类,有关研究表明,LRG-1在舌癌等多种癌症中均呈高表达,且其对癌细胞的生物学行为具有一定调控作用[8]。鞘氨醇激酶1(SPHK1)具有维持鞘脂代谢平衡的作用,对肿瘤的生物学行为也具有一定的影响[9]。因此本研究拟转染miR-193a-3p模拟物通过LRG-1/SPHK1信号通路介导对口腔鳞状细胞癌的作用,并探讨机制。
1 材料和方法
1.1 一般资料
人口腔鳞癌细胞HN4来自上海泽叶生物公司,于实验室保存。选取本院2018年1月~2020年1月20例口腔鳞癌患者的癌组织(已确诊)与癌旁组织标本进行研究,分为口腔鳞癌组与癌旁组,每组10例,男女各半,年龄(49.37±5.22)岁,所有病例术前均未进行放疗、化疗以及其他辅助治疗。患者本人同意参加本次实验。
1.2 实验试剂
胰蛋白酶(河南瑞仁公司);链霉素(武汉罗森杰公司);CCK8溶液(青岛达斐公司);酶标仪(山东霍尔德公司);基质胶(杭州仟诺公司);酶联免疫试剂盒(上海劲马公司);青霉素(湖南泰仁公司)。
1.3 细胞的分离与培养
将HN4细胞用含1×105U/L青霉素、0.1 g/L链霉素、5 μmol/L PTX 培养液常规培养,细胞融合至80%~90%时胰蛋白酶消化,离心1 250 r/min,共5 min,重悬,传代,取第4代细胞进行实验。
在6孔板中接种即将要转染的细胞,待细胞长至65%融合时,采用LipofectamineTM2000转染50 nmol/L相应的microRNA mimics以及阴性对照miR-193a-3p-NC,继续培养3 d。实验分为3组,鳞癌组(口腔鳞癌细胞)、转染NC组、转染组(转染miR-193a-3p)。
1.4 PT-PCR检测miR-193a-3p水平
取各组细胞及组织,胰酶消化后提取细胞悬液,冲洗。提取总 RNA,Primer 5.0 合成引物。 PCR反应条件:95℃10 min,95℃ 15 s,60℃ 1 min,以U6为内参,共40个循环。引物序列见表1。
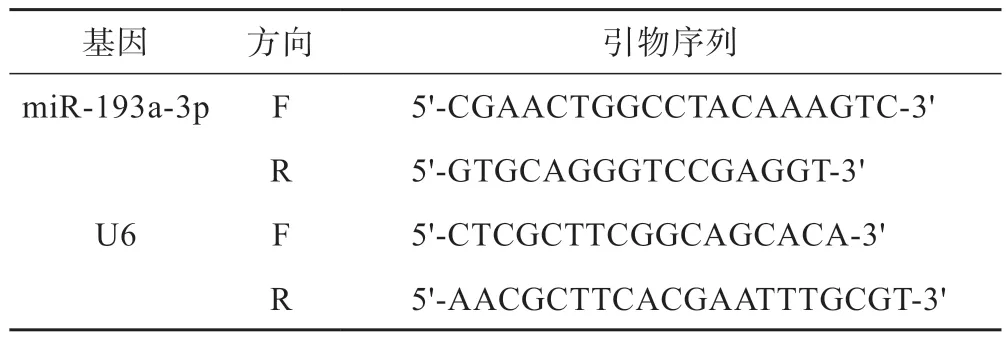
表1 引物序列
1.5 CCK8检测细胞增殖能力
于96孔板中接种各组细胞,常规孵育,待细胞生长至60 %时,加入10 μL CCK-8 溶液,后常规孵育2 h,在细胞孵育 0、24、48 h 和 72 h 时,酶标仪测量 450 nm处每个孔的 OD 值。
1.6 Transwell小室检测侵袭能力
将各组细胞接种于6孔板中,将50 mg/L的基质胶稀释后加入小室上层,37℃下呈凝胶状态,上室加细胞悬液,下室加胎牛血清培养基,37.5℃,培养2 d,取出培养基,拭去残留细胞,现配结晶紫,每孔500 μL,将小室放入,25℃染色30 min,PBS清洗,稍晾干。显微镜观察,每个样本连续选5个清晰视野进行数量统计,然后计算平均数。
1.7 ELISA检测各组p53、caspase-3、Bcl-2和survivin水平
取各组细胞,胰蛋白酶消化,离心5 min,1 250 r/min,重悬,取细胞悬液,采用ELISA法检测人体抑癌基因(p53)、半胱氨酸蛋白酶3(caspase-3)、B淋巴细胞瘤-2(Bcl-2)、生存素(survivin)水平。
1.8 免疫印迹检测SPHK1、LRG-1、caspase-3、p53、survivin和Bcl-2水平
取各组细胞,裂解液裂解并提取蛋白,并对蛋白的浓度进行测量,分装后,保存在-20℃的环境中。将提取出的蛋白溶液和缓冲溶液进行混匀,然后将其煮沸、变性、电泳,后移至PVDF膜上,加脱脂奶粉封闭1 h。加入(抗SPHK1、LRG-1)一抗,漂洗3次,每次隔10 min,加入二抗对溶液稀释,常温封闭1 h。取出PVDF膜,漂洗,DAB显色后照相。增加敲除LRG-1、转染SPHK1抑制剂、转染miR-193a-3p+敲除LRG-1、转染miR-193a-3p+SPHK1抑制剂进行对照,敲除及转染方法根据Takemoto[10]、杨永臻[11]实验方法进行,转染miR-193a-3p+敲除LRG-1、转染miR-193a-3p+转染SPHK1抑制剂方法为在转染miR-193a-3p的基础上进行敲除LRG-1、转染SPHK1抑制剂。敲除LRG-1分为未敲除LRG-1组、阴性对照组、敲除LRG-1组。转染SPHK1抑制剂分为未转染组、NC组、转染SPHK1组。
1.9 统计学处理
采用SPSS 23.0统计学软件进行分析,鳞癌组、转染NC组、转染组口腔鳞癌细胞增殖、侵袭及LRG-1、SPHK1水平等比较采用单因素方差分析,计量资料采用±s,以P<0.05表示差异有统计学意义。
2 结果
2.1 miR-193a-3p在组织及细胞中的水平
口腔鳞癌组中miR-193a-3p水平低于癌旁组织,组间比较差异显著(P<0.05)(图1A)。
鳞癌组miR-193a-3p水平与转染NC组较为接近,组间比较差异无统计学意义(P>0.05);转染组miR-193a-3p水平高于鳞癌组、转染NC组,组间比较差异有统计学意义(P<0.05),说明miR-193a-3p抑制剂转染成功(图1B)。
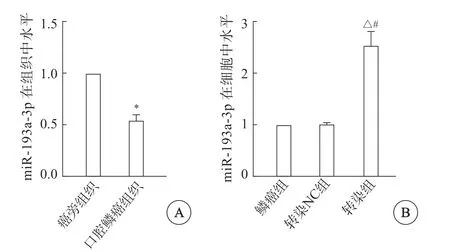
图1 miR-193a-3p在口腔癌组织(A)和口腔癌细胞(B)中的水平
2.2 细胞增殖能力
转染组在0 h时的OD值均较为接近(P>0.05);鳞癌组与转染NC组在不同时间点的OD值均较为接近(P>0.05);转染组在24、48、72 h时的OD值低于鳞癌组、转染NC组(P<0.05)(表2和图2)。
表2 各组在不同时间点的增殖情况(±s)

表2 各组在不同时间点的增殖情况(±s)
*P<0.05 vs鳞癌 组;#P<0.05 vs 转染NC组
组别0 h24 h48 h72 h鳞癌组0.26±0.040.71±0.060.92±0.071.12±0.11转染NC组0.24±0.030.68±0.040.89±0.081.03±0.09转染组0.23±0.020.39±0.03*#0.61±0.05*#0.73±0.06*#P 0.27<0.001<0.001<0.001
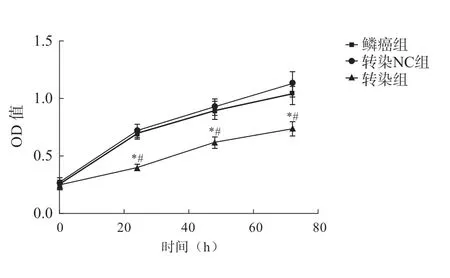
图2 各组癌细胞在不同时间的增殖比较
2.3 侵袭能力检测
鳞癌组癌细胞侵袭数量为(282.74±26.77)个,与转染NC组侵袭数量(276.59±27.33)个较为接近,组间比较差异无统计学意义(P>0.05);转染组癌细胞侵袭数量为(152.11±14.33)个,较鳞癌组与转染NC组明显降低,组间比较差异有统计学意义(P<0.05)(图3)。
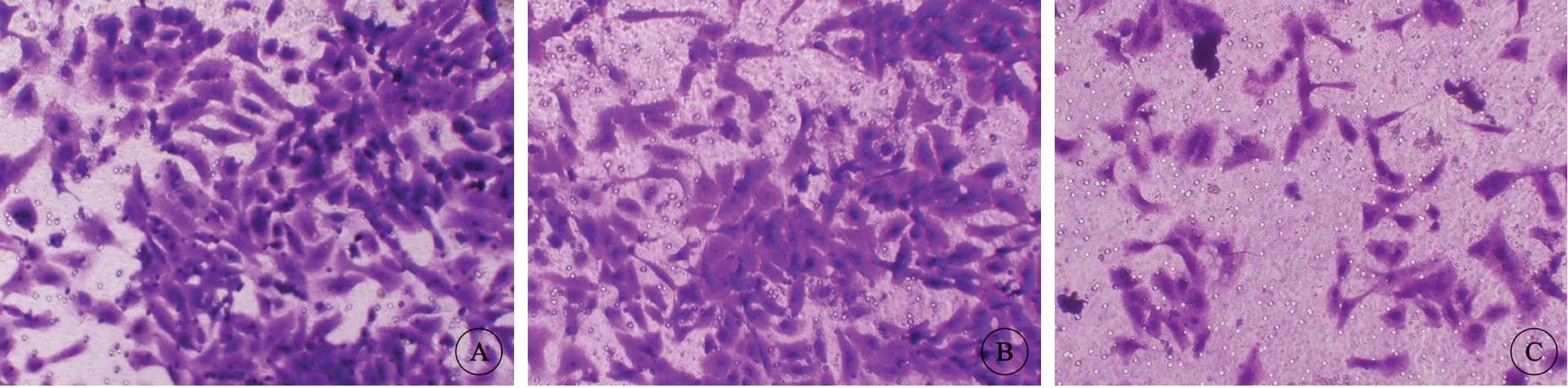
图3 各组细胞侵袭能力对比,×400
2.4 各组caspase-3、p53、survivin和Bcl-2水平
鳞癌组与转染NC组caspase-3、p53、survivin、Bcl-2水平均较为接近,组间比较差异无统计学意义(P>0.05),与鳞癌组、转染NC组相比,转染组caspase-3、p53水平有所升高,survivin、Bcl-2水平有所下降,组间比较差异有统计学意义(P<0.05)(表3)。
表3 各组蛋白水平对比(±s,ng/mL)

表3 各组蛋白水平对比(±s,ng/mL)
*P<0.05 vs 鳞癌组;#P<0.05 vs 转染NC组
组别Caspase-3p53SurvivinBcl-2鳞癌组19.23±1.24 8.21±1.2218.26±1.7425.68±2.34转染NC组20.11±1.04 9.13±0.8917.65±1.1324.11±2.55转染组35.26±3.17*#17.25±1.07*# 9.31±0.45*#10.32±1.04*#P<0.001<0.001<0.001<0.001
2.5 SPHK1、LRG-1、caspase-3、p53、survivin和Bcl-2水平
鳞癌组与转染NC组SPHK1、LRG-1、caspase-3、p53、survivin和Bcl-2水平相比无显著差异(P>0.05)。与鳞癌组相比,转染组、敲除LRG-1组、转染SPHK1组LRG-1、SPHK1、survivin、Bcl-2水平降低,caspase-3、p53水平升高(P<0.05),转染组、敲除LRG-1组和转染SPHK1组上述各指标水平对比无显著差异(P>0.05)(图4,表4)。

图4 SPHK1、LRG-1、caspase-3、p53、survivin和Bcl-2水平在各组中的对比
表4 SPHK1、LRG-1、caspase-3、p53、survivin和Bcl-2水平在各组中的对比(±s)
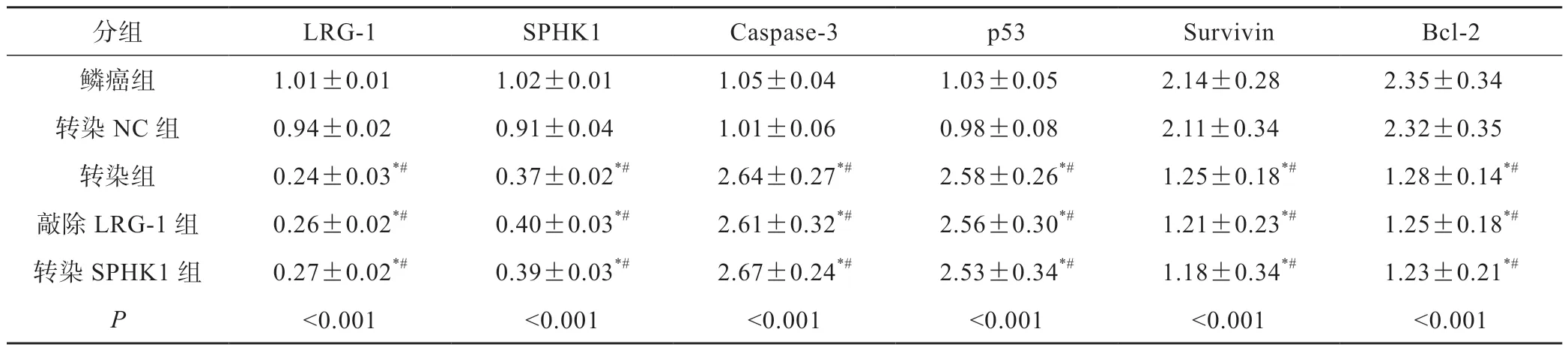
表4 SPHK1、LRG-1、caspase-3、p53、survivin和Bcl-2水平在各组中的对比(±s)
注:*P<0.05 vs鳞癌组;#P<0.05 vs转染NC组
分组LRG-1SPHK1Caspase-3p53SurvivinBcl-2鳞癌组1.01±0.011.02±0.011.05±0.041.03±0.052.14±0.282.35±0.34转染NC组0.94±0.020.91±0.041.01±0.060.98±0.082.11±0.342.32±0.35转染组0.24±0.03*#0.37±0.02*#2.64±0.27*#2.58±0.26*#1.25±0.18*#1.28±0.14*#敲除LRG-1组0.26±0.02*#0.40±0.03*#2.61±0.32*#2.56±0.30*#1.21±0.23*#1.25±0.18*#转染SPHK1组0.27±0.02*#0.39±0.03*#2.67±0.24*#2.53±0.34*#1.18±0.34*#1.23±0.21*#P<0.001<0.001<0.001<0.001<0.001<0.001
3 讨论
近年来口腔鳞癌的发病率逐年增长,每年新增病例近30万人[12]。口腔鳞癌对于患者的生命威胁不大,但其转移能力较强,会浸润肺部等组织,危及生命安全,因此,对于口腔鳞癌的治疗至关重要。有研究表明,miR-193a-3p具有一定的抑癌作用,因此本文研究miR-193a-3p通过LRG-1/SPHK1信号通路介导对口腔鳞状细胞癌的作用及相关机制。
癌细胞侵袭主要是指癌细胞通过不同方式破坏周围正常组织并分散至其中。肿瘤的侵袭是其发生各种部位远处转移的前提条件。miRNAs是重要的转录后调节因子,参与各种生理和病理过程,包括细胞分化、细胞增殖和肿瘤发生发展过程。miR-193a-3p是miRNA家族成员之一,是一种抑癌基因[13]。本研究根据PCR检测结果提示,口腔鳞癌中miR-193a-3p的水平较癌旁组织低,经过转染其模拟物后,癌细胞的增殖及侵袭受到抑制,这一结果可以表明其是抑癌基因的一种,对口腔鳞癌具有一定的抑制作用。有关研究表明,miR-193a-3p在食管鳞癌、卵巢癌中为低表达,且王培蓓等[14]对喉癌细胞的研究中,运用RT-PCR检测显示miR-193a-3p在癌细胞中为低表达,在经过转染其模拟物后,发现过表达的miR-193a-3p可抑制癌细胞的增殖及侵袭。本研究经过转染miR-193a-3p后,口腔鳞癌细胞的增殖及侵袭同样受到抑制。
肿瘤的产生及发展是多基因间复杂作用的过程。LRG-1是富亮氨酸重复序列中的一员,对肿瘤细胞的生物学活性具有一定的调控作用,有研究表明,LRG-1在卵巢癌、胰腺癌中为高表达[15]。刘欣[16]等运用免疫组织化学检测喉癌LRG-1阳性表达率高达86%,经过治疗后阳性表达下降。SPHK1是一种脂质激酶,是参与鞘脂代谢平衡的关键限速酶,并参与细胞的增殖、分化以及迁移,在乳腺癌、肝癌等癌症中均存在高表达[17-18]。舌癌是口腔鳞癌中常出现的一种癌,有关研究表明,SPHK1在舌癌中通过抑制表皮生长因子在肿瘤的浸润以及转移中发挥重要作用。高路[19]基于大鼠口腔鳞癌模型的研究表明,LRG-1、SPHK1呈正相关关系。本研究运用免疫印迹检测SPHK1、LRG-1水平,结果显示SPHK1、LRG-1水平在癌细胞中均呈现高表达,转染miR-193a-3p后SPHK1、LRG-1水平与敲除LRG-1及转染SPHK1抑制剂后水平较为接近,表明转染miR-193a-3p可降低SPHK1、LRG-1蛋白水平,在经过转染miR-193a-3p+敲除LRG-1、转染miR-193a-3p+转染SPHK1干预后效果更好。提示转染miR-193a-3p后可能通过抑制SPHK1、LRG-1,从而调控肿瘤细胞的侵袭及增殖。
Caspase 是细胞凋亡的标志蛋白[20];p53是一种促凋亡基因[21];Bcl-2、survivin是抗凋亡分子,Bcl-2能够拈抗线粒体途径凋亡,survivin则能够拮抗多种 caspase分子的促凋亡作用[22-23]。miRNAs在转录后具有调控细胞因子水平,异常的miRNAs表达可能会影响大量细胞因子的水平。miRNAs的表达在组织特异性中受到高度调控,可通过参与不同的途径,对细胞生存、生长和增殖产生不同的作用。Liu等[24]对肺癌的研究中提出,miR-193a-3p通过提高p53的水平促进肺癌细胞的凋亡。潘新平等[25]对胃癌的研究中表明,miR-193a-3p可通过提高caspase-3的水平促进胃癌细胞凋亡。本实验结果显示,在癌细胞中caspase-3、p53水平较低,survivin、Bcl-2水平较高,在经过转染miR-193a-3p后caspase-3、p53水平升高、survivin、Bcl-2水平降低。提示,转染miR-193a-3p后可能通过调控Bcl-2、survivin、caspase-3、p53水平,促进癌细胞凋亡,从而延缓口腔鳞癌的发展。
综上所述,本文运用过表达的miR-193a-3p,通过降低SPHK1、LRG-1的水平,抑制口腔鳞癌细胞的增殖及侵袭。

