磷酸化亚硝基猪血红蛋白代替亚硝酸盐部分作用及其对乳化肠品质的影响
马晓庆,刘 洋,孙杨赢,2,*,潘道东,2,曹锦轩,2
(1.宁波大学食品与药学学院,浙江 宁波 315800;2.浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315800)
亚硝酸盐是肉类制品中一种独特的添加剂,能够抑制微生物生长;具有很强的抗氧化性,能够抑制脂肪氧化;同时赋予肉制品特征性的腌制肉色和腌肉风味[1-2]。但是,亚硝酸盐会在特定条件下转变为N-亚硝胺[3],当人体摄入一定量时会有致癌致畸的危险。为了解决这一问题,替代亚硝酸盐的天然或合成色素的开发研究成为国内外学者们日益关注的话题。目前已经开发研究了许多天然或合成的亚硝酸盐替代品,例如:Li Peijun等[4]研究表明在香肠中加入不含亚硝酸盐的木糖酵母菌可以达到与NaNO2相似的a*值,Zhu Yinglian等[5]研究植物乳杆菌部分替代NaNO2能够降低亚硝酸盐含量,改善香肠的颜色,但上述研究均未考察菌株的添加是否具有抑制脂质氧化的功能;还有研究发现樱桃粉[6]或番茄渣-有机薄荷精油的超临界流体提取物[7]可以改善香肠的色泽、降低亚硝酸盐残留和抑制脂肪氧化,但并未涉及蛋白质降解和整体可接受度的研究;此外,国内外对红曲色素作为亚硝酸盐替代物的研究较多,但是红曲色素对光照、高温、酸碱、重金属敏感,在肉制品加工中易出现变色现象产生质量问题[8]。因此,由于现有的亚硝酸盐替代品制作成本和销售价格太高或无法达到亚硝酸盐的全部作用,所以没有进入大规模生产应用。到目前为止,尚未开发出能够发挥亚硝酸盐全部作用的单一物质,亚硝酸盐在肉制品中仍然是最常用的添加剂[9],但在一定条件下会转变为N-亚硝胺,具有潜在危害,故在肉品加工过程中需严格控制其添加量。
由亚硝酸盐和猪血红蛋白(hemoglobin,Hb)形成的亚硝基血红蛋白(nitrosohemoglobin,NHb)具有良好的着色能力[10],但NHb发色稳定性不理想[11],所以没有投入大量生产,为了解决NHb稳定性不理想的问题,由猪血、亚硝酸盐和糖通过美拉德反应合成的糖基化NHb,在肉类腌制过程中发挥着色、抗氧化和防腐的作用[10]。Li Meng等[12]发现蛋白质磷酸化可能通过影响肌红蛋白的氧化还原稳定性而促进肉色的形成。由于肌红蛋白与Hb的结构和功能具有很大的相似 性[13],所以本研究对Hb进行亚硝基磷酸化处理得到磷酸化亚硝基血红蛋白(phosphorylated nitrosohemoglobin,P-NHb)以达到提高稳定性的目的,通过前期实验研究已证明P-NHb具有较强稳定性。本研究所用的Hb来源于新鲜猪血,资源丰富且易得。
乳化肠深受消费者喜欢,但在乳化肠中添加亚硝酸盐存在潜在危害。本研究旨在探讨P-NHb对猪肉乳化肠理化指标和感官品质的影响,分析贮藏过程中乳化肠的pH值、水分含量、色泽、亚硝酸盐残留量、挥发性盐基氮(total volatile base nitrogen,TVB-N)值、脂质氧化硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值、菌落总数和感官品质,以进一步研究P-NHb作为一种新型天然色素及其代替亚硝酸盐的可能性。
1 材料与方法
1.1 材料与试剂
新鲜猪血 宁波市北仑食品有限责任公司;猪肉 市购;羊肠肠衣 河清肠衣有限公司;食盐、NaNO2、异抗坏血酸钠、复合磷酸盐、花椒粉、TG酶、谷氨酸钠、白酒、β-环糊精均为食品级;氮气、坏血酸、三氯乙酸、硫代巴比妥酸(均为分析纯) 国药集团化学试剂有限公司;丙酮(色谱纯) 杭州高晶精细化工有限 公司;亚硝酸盐试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
H2050R台式高速冷冻离心机、Infinte 200PRO型酶 标仪 瑞士Tecan公司;FE20 pH计 德国Mettler Toledo公司;CR-440色差仪 柯尼卡美能达办公系统(中国)有限公司;XHF-D高速分散器 宁波新芝生物科技有限公司;BJRJ-82型绞肉机、BZBJ-20型斩拌机 嘉兴艾博实业有限公司;DN-36W氮吹仪 上海比朗仪器有限公司。
1.3 方法
1.3.1 Hb提取纯化
于宁波市北仑食品有限责任公司收集加入0.5%抗凝剂(柠檬酸钠)的新鲜猪血,全程于4 ℃迅速运送回实验室。100 目筛过滤除纤,4 ℃、3 000 r/min离心15 min,收集下层血细胞[14]。根据Cho等[15]的方法对血红细胞进行处理得到粗Hb。将Hb粗提液通过0.5 μm和0.22 μm滤膜进行超滤[16],然后在Hb粗提液加入0.5 mg/100 mL抗氧化剂异抗坏血酸钠,60 ℃水浴加热30 min使杂蛋白沉淀,整个过程通入N2保持真空状态防止Hb氧化,3 000 r/min离心15 min,取上清液得到纯的Hb[17]。纯化后的Hb进行冷冻干燥,在-40 ℃条件下保存待用。
1.3.2 NHb和P-NHb的制备和鉴定
参照曹稳根等[18]的方法,按照NaNO2添加量为 0.03 g/mL、抗坏血酸添加量为0.02 g/mL制备NHb溶液。根据前期的研究结果,磷酸化改性最优条件如下,在NHb中添加10 mg/100 mL三聚磷酸钠,调节反应pH值到8,在55 ℃水浴锅中加热反应30 min,室温冷却,并将制得的P-NHb溶液透析过夜,整个过程操作均在黑暗避光条件下进行。真空冷冻干燥得到P-NHb粉末, 避光-40 ℃贮存待用。参照夏杨毅等[17]的方法对其进行鉴定,用体积分数80%丙酮溶液溶解,室温下避光静置1 h,过滤,在波长540 nm处测滤液吸光度,以80%丙酮溶液为空白对照。
1.3.3 香肠的制作
参照陈坤朋等[19]的工艺流程和Liu Pengxue等[14]的配方比例稍作修改制备乳化肠,本研究制作5 组不同的乳化肠,其中对照组(空白)为不添加任何发色剂;实验组分为4 组,分别为添加亚硝酸盐组(NaNO2)、Hb组、NHb组、P-NHb组,其中NaNO2组NaNO2的添加量为0.1 g/kg,其他3 组(不添加NaNO2)的添加量均为1 g/kg。
乳化肠制备工艺流程:瘦肉剔除结缔组织并切丁成3 cm,肥肉切丁,将肥肉与瘦肉混匀后加入盐、NaNO2/Hb/NHb/P-NHb、β-环糊精和多聚磷酸盐混匀腌制,然后在6 mm孔板绞肉机中绞碎,后使用斩拌机斩拌腌制好的原料肉,并按顺序依次加入白酒、花椒粉、TG酶,斩拌期间不断加入冰水控制肉糜温度在10 ℃以下。斩拌完成后将肉糜灌入羊肠肠衣(直径3 cm)中,75 ℃条件下煮制40 min。煮制结束放置冷却后抽真空包装,于4 ℃条件下保存备用。在不同贮存时间(0、5、10、15、20、25 d和30 d)测定L*值、a*值、b*值、pH值、菌落总数、NaNO2残留量、TVB-N值和TBARS值,并对产品进行感官评价。
1.3.4 色差测定
使用色差计对样品色差值进行分析,室温条件下使用D65光源和10°角观察。色差仪使用前在白板上进行校准。将乳化肠样品切成15 mm×25 mm的薄片,随机选择肠体4个不同区域切片测定4 次,其结果用L*(亮度值)、a*(红度值)和b*(黄度值)表示。
1.3.5 pH值测定
用pH计在室温下(20 ℃)测定乳化肠pH值。准确称取10 g样品切碎加入90 mL纯水中,在摇床中振荡20 min后测定pH值。
1.3.6 残留亚硝酸盐含量测定
按照亚硝酸盐测定试剂盒中说明测定。将样品分散在水(70 ℃)中静置15 min并过滤。根据滤液与磺基苯胺溶液和显色剂N-萘基-乙二胺二盐酸盐反应生成红色偶氮化合物。在波长550 nm处测定上清液吸光度。亚硝酸盐残留量按式(1)计算:

1.3.7 TBARS值测定
参照施春权等[20]和GB 5009.227—2016《食品中过氧化值的测定》[21]的方法稍作修改。TBARS值按式(2) 计算:
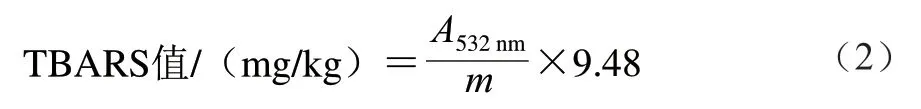
式中:A532nm为样品在波长532 nm处的吸光度;m为样品质量/g;9.48为常数。
1.3.8 TVB-N的测定
按照GB 5009.228—2016《食品中挥发性盐基氮的测定》[22]的方法测定。
1.3.9 菌落总数
按照GB 4789.2—2016《食品微生物学检验 菌落总数测定》[23]。称取10 g乳化肠,加入90 mL生理盐水(0.85%),进行无菌拍打。从该样液中制备连续10 倍的稀释液进行菌落计数。结果以菌落对数值(lg(CFU/g)) 表示。培养条件为(36±1)℃、(48±2)h。
1.3.10 感官评价
乳化肠的感官评定按照陈坤朋等[19]的方法并作修改。将蒸煮后的样品切成约2.5 cm长度的切片,分给10 位经过培训的人员(男女比例为1∶1)进行评分,在每次评价之前,小组成员需用纯净水漱口,最大程度降低品尝疲劳。评估色泽、气味、滋味、嫩度、质构和整体可接受度的基本感官特性。得分制用7 分制(1=非常不喜欢,7=非常喜欢)。
1.4 数据统计
本实验进行3 批实验,每批设置3 次重复,结果表示为±s。数据统计采用SPSS 18.0进行ANOVA分析,利用Tukey HSD进行显著性分析(P<0.05,差异显著),采用Origin 8.0进行数据整理和作图。
2 结果与分析
2.1 Hb、NHb、P-NHb和NaNO2的添加对乳化肠色泽的影响
乳化肠的L*值变化如图1A所示,随贮藏时间的延长,各组的L*值基本无变化(P>0.05),但是P-NHb组样品的L*值显著高于NaNO2组、Hb组和NHb组样品,由图2可以看出,相比NHb组,添加经过磷酸化改性后的颜色鲜亮。黄多[24]研究发现壳聚糖及其衍生物与NHb进行糖基化反应制作的新型色素的色泽L*值比对 照组高,经过改性后的Hb亮度值增加,这与本研究结果一致。肉类产品的粉红色是检验其质量的重要标准之一[25],由图1B和图2可以看出,各组的a*值随贮存时间的延长逐渐降低,但添加P-NHb(添加量为1 g/kg)组的a*值显著高于NaNO2组(添加量为0.1 g/kg)、Hb组(添加量为1 g/kg)和NHb组(添加量为1 g/kg)样品 (P<0.05),且随时间延长,P-NHb组的a*值降低均比其他组少,这表明P-NHb可以改善乳化肠的色泽,同时能够维持乳化肠色泽稳定,而且不需要与NaNO2复配使用便可以达到理想颜色。如图1C所示,所有组的b*值均显著增加(P<0.05),这可能是因为脂质氧化产物与磷脂末端基团或蛋白质中的胺发生非酶促褐变反应 导致[26]。由图2可知,添加P-NHb的乳化肠比其他组乳化肠的色泽理想,这表明本研究所制得的新型色素P-NHb可以代替NaNO2在肉类制品中发挥发色作用。
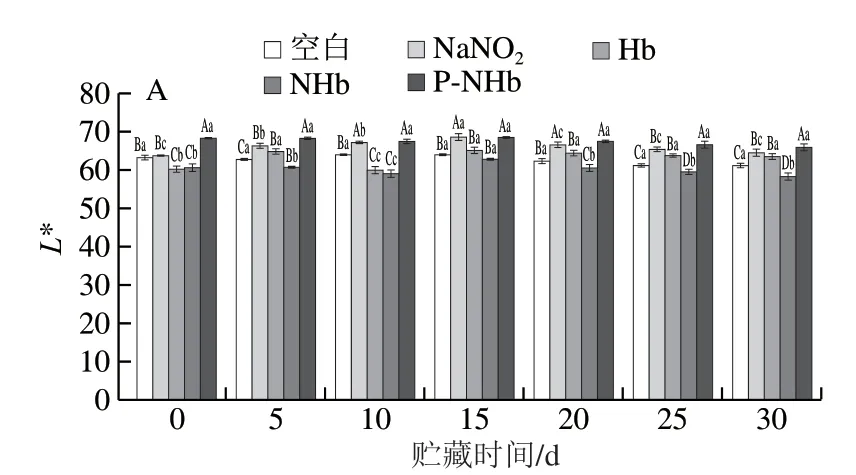
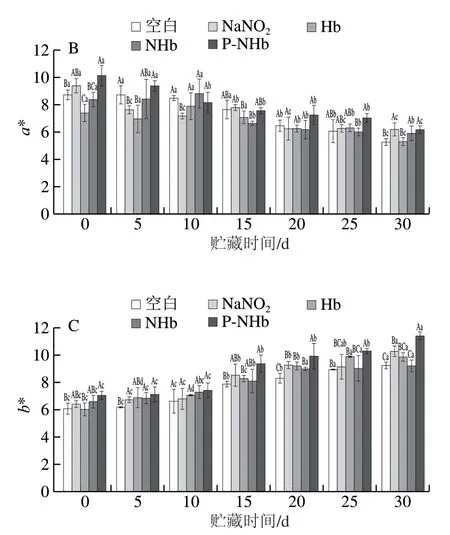
图1 贮藏过程中乳化肠的L*(A)、a*(B)、b*(C)值的变化Fig. 1 Changes in L* (A), a* (B) and b* (C) values of emulsified sausage during storage
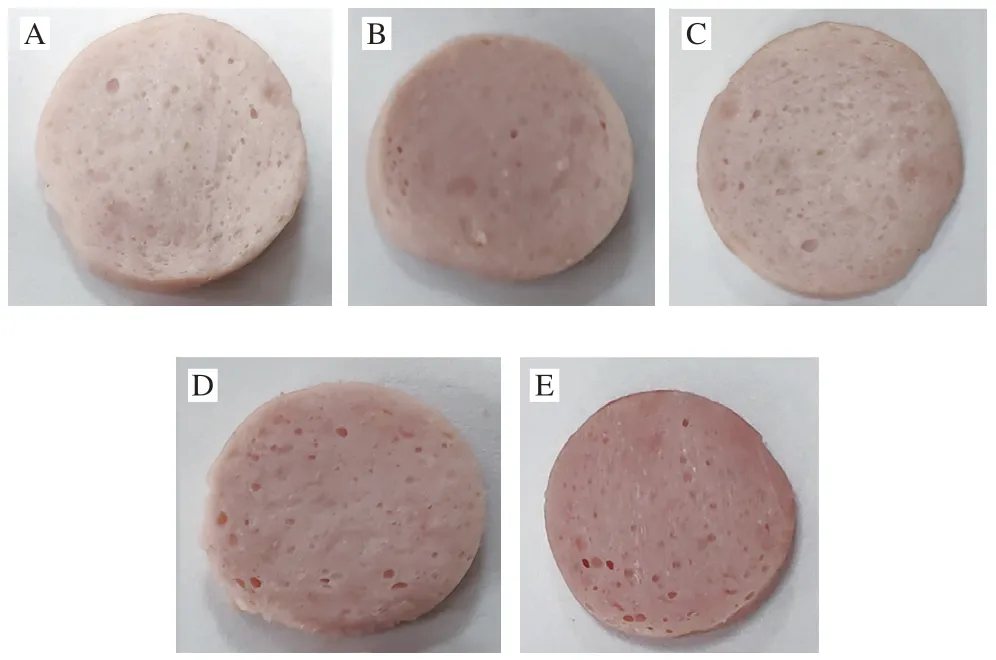
图2 不同处理组的乳化肠切片图Fig. 2 Appearance of emulsified sausage slices in different treatment groups
2.2 Hb、NHb、P-NHb和NaNO2的添加对乳化肠pH值的影响
由图3可知,各组pH值随贮存时间的延长均呈现降低趋势。P-NHb组的pH值下降速度比其他组均小 (P<0.05),Hb组在0~10 d的pH值逐渐增加,这可能与碱性化合物的积累有关,如乳化肠贮藏期间的微生物生长导致蛋白水解,从而导致氨和其他碱性物质的 产生[27],10 d之后开始逐渐下降,而且pH值的下降与水分含量的下降有关[28],与NaNO2相比,P-NHb增加了贮藏过程中乳化肠的pH值稳定性。
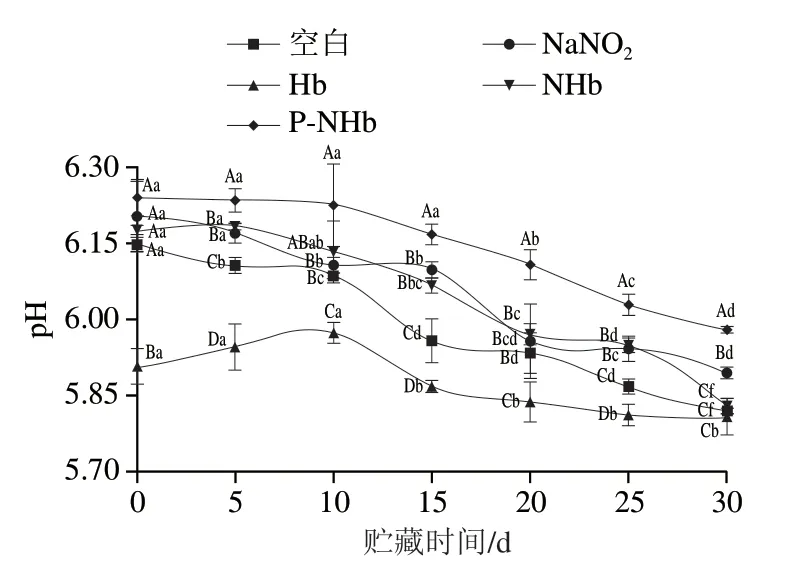
图3 贮藏过程中乳化肠pH值的变化Fig. 3 Changes in pH of emulsified sausage during storage
2.3 Hb、NHb、P-NHb和NaNO2的添加对乳化肠亚硝酸盐残留量的影响
如图4所示,在贮存期间NaNO2组显示出最高亚硝酸盐残留水平,但是随时间延长显著降低(P<0.05),下降的原因可能是NaNO2自身氧化以及NaNO2与蛋白质、脂质和肉中其他成分发生的氧化还原反应[29],Liu Pengxue等[14]研究表明亚硝酸盐残留的减少可能是由于还原反应,亚硝酸盐氧化以及亚硝酸盐与蛋白质,脂质和其他肉类成分的结合所致。其他组均没有添加NaNO2,亚硝酸盐含量基本在0.30~6.22 mg/kg(P>0.05)范围内,远低于GB 2760—2014(<30 mg/kg)。在整个贮存期间,NaNO2组的亚硝酸盐含量很高,在特定的高温或强酸条件下会导致N-亚硝胺的大量形成,造成不安全因素。P-NHb基本没有亚硝酸盐残留,在肉制品应用中相对安全。
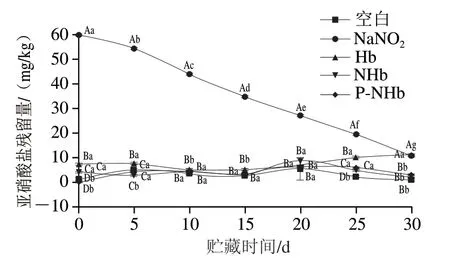
图4 贮藏过程中乳化肠亚硝酸盐残留量的变化Fig. 4 Changes in residual nitrite in emulsified sausage during storage
2.4 Hb、NHb、P-NHb和NaNO2的添加对乳化肠TBARS值的影响
图5显示实验组的TBARS值均比空白组低。在0~15 d期间P-NHb组比NaNO2组的TBARS值高 (P<0.05),此阶段NaNO2对脂肪氧化的抑制作用明显优于其他组(P<0.05),但从第10天开始NaNO2组的TBARS值直线上升,P-NHb组的上升趋势一直平稳,并无突增趋势;当贮存15~20 d后,P-NHb组比NaNO2组的TBARS值低(P<0.05),这可能是因为磷酸化通过改变Hb结构影响氧化还原反应抑制了脂质氧化[30],也可能是抗坏血酸钠减少了丙二醛的形成[31],Liu Pengxue等[14]研究表明抑制脂质氧化的另一可能性是因为Hb里的血红素铁与NO形成了稳定的络合物。脂质氧化对肉类风味的形成有一定影响,适量脂质氧化可以赋予肉类令人满意的风味,但是过度氧化会产生哈喇等不良气味。因此,脂质氧化在肉制品的风味形成和品质控制中起到十分重要的作用,从图5可知,P-NHb在乳化肠中对脂质氧化具有较强的抑制作用,P-NHb比NaNO2具有更强抗氧化性,对乳化肠长期贮存时的品质保证更具有优势。
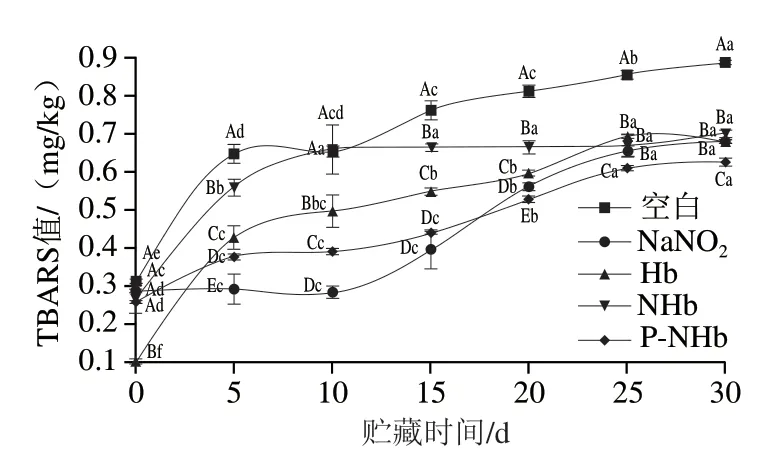
图5 贮藏过程中乳化肠TBARS值的变化Fig. 5 Changes in TBARS value of emulsified sausage during storage
2.5 Hb、NHb、P-NHb和NaNO2的添加对乳化肠TVB-N值的影响
Liu Dengcheng等[32]研究发现香肠样品在贮藏时间为14 d时,TVB-N值最高达到30.7 mg/kg,Jin等[27]发现随贮存时间的延长,TVB-N值逐渐增加,代表肉品腐败程度越严重。由于TVB-N值在肉与肉制品品质变化过程中能有规律地反映肉品的新鲜程度,因而可以作为肉品质量评定的客观指标。图6中,所有组分的TVB-N值均随时间延长而增加,但是实验组均未超GB 5009.228—2016(35 mg/kg)。Hb组和NHb组的TVB-N值均显著高于空白组(P<0.05),因为Hb为蛋白质,所以会自身分解增加TVB-N值。P-NHb可能是因为磷酸化改变了Hb结构[33],减少了在加入肉制品时蛋白质分解从而降低了TVB-N值。P-NHb组与NaNO2组的TVB-N值基本持平 (P>0.05),均显著低于空白组(P<0.05),表明2 组均可有效减少蛋白质分解。根据这一结果可以得出新型色素P-NHb具有在乳化肠中抑制蛋白质分解的作用。
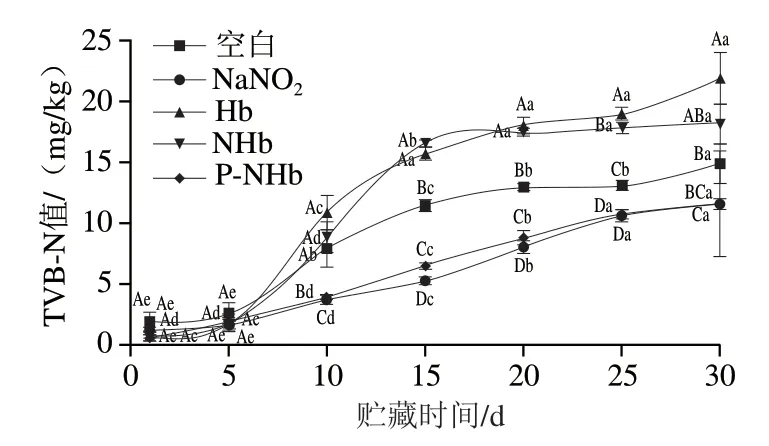
图6 贮藏过程中乳化肠TVB-N值的变化Fig. 6 Changes in TVB-N value of emulsified sausage during storage
结合TBARS值结果得知,P-NHb抑制脂肪氧化和抑制蛋白降解作用比NaNO2强,P-NHb具有较强的抗氧化性,在乳化肠贮存期间可以保证乳化肠品质,延长乳化肠的贮存时间,所以P-NHb可以替代NaNO2的抗氧化作用在肉制品中应用,且效果更具优势。
2.6 Hb、NHb、P-NHb和NaNO2的添加对乳化肠菌落总数的影响
由图7可知,菌落总数在0~20 d持续增加,在20~25 d达到最大,之后开始下降。实验组的菌落总数均比空白组小,而且NaNO2组和P-NHb组均显著低于空白组、Hb组和NHb组(P<0.05),在整个时间段P-NHb组的菌落总数与NaNO2组均无显著差异(P>0.05),可能是因为通过调节糖酵解和其他氧化还原反应[31,33]改变了乳化肠的环境,从而抑制了微生物的大量繁殖,还有部分抑菌作用归因于制备P-NHb时残留的NaNO2[14]。开始阶段菌落总数持续升高是因为前期乳化肠的营养物质丰富,微生物迅速生长繁殖。随时间延长,乳化肠内的营养物质含量逐渐降低,限制大部分微生物的生长繁殖。经过25 d的贮藏后,空白组的细菌总数已经超过GB 4789.2—2016规定的肉制品细菌总数(<4.7(lg(CFU/g)),而实验组P-NHb组、NaNO2组和Hb组均在国家标准范围内。因此,P-NHb具有良好的抑菌作用。
2.7 感官评价
如图8所示,NaNO2组与P-NHb组色泽无显著差异(P>0.05),且P-NHb可以赋予乳化肠理想色泽,得到较高评分。而空白组的色泽得分最低,这一结果与Liu Pengxue等[14]的研究结果一致。在气味和质构方面,各组均无显著差异(P>0.05);P-NHb组和NHb组的嫩度评价则显著高于其他各组(P<0.05),乳化肠的口感和嫩度与水分含量有关,P-NHb组可能因为磷酸化处理改变了Hb的结构从而增加了蛋白质的保水性,从而保持了乳化肠的口感和嫩度;而NaNO2组的滋味显著优于P-NHb组(P<0.05),且NaNO2组得分最高;整体可接受度方面,P-NHb组和NaNO2组效果比其他组好,且两者之间无显著差异(P>0.05)。
3 结 论
本实验研究P-NHb替代NaNO2对乳化肠理化特性及感官品质的影响,结果表明P-NHb作为一种新型色素,可以考虑其代替NaNO2在肉制品中的应用。P-NHb组的亚硝酸盐残留量水平较低;P-NHb对脂肪氧化有良好的抑制作用表明P-NHb具有较高抗氧化性;P-NHb可以赋予肉制品理想的色泽;P-NHb和NaNO2对乳化肠的TVB-N值无显著差别;P-NHb在抑制乳化肠的菌落总数生长和NaNO2相似;P-NHb可以维持pH值稳定;P-NHb组的整体可接受度和NaNO2组没有显著差异。综上所述,P-NHb可以达到与NaNO2相似的作用,可以作为一种亚硝酸盐的潜在替代品。

