绿原酸共价和非共价作用对黑豆蛋白纳米乳稳定性和抗氧化性的影响
金 花,江连洲,冯海莹,王菊兵,张晓松,许 晶,*
(1.东北农业大学文理学院,黑龙江 哈尔滨 150030;2.东北农业大学食品学院,黑龙江 哈尔滨 150030)
乳液运载体系具有较好的稳定性和运载能力,是脂溶性生物活性物质的重要载体,能够有效改善亲脂性物质的水溶性、稳定性和生物利用率,在食品、医药和化妆品领域都有很大的应用前景和潜力[1-3]。乳液的性能通常与乳化剂的使用密切相关。乳化剂不仅能够在油水界面处形成分隔层,稳定乳液,更重要的是高抗氧化性的乳化剂还会有效防止被载活性物质的氧化降解[4-5]。鉴于绿色、安全的特点,天然蛋白乳化剂近些年逐渐受到更多的关注。同时,探索可行方法来提高天然蛋白乳化能力和抗氧化性,进而改善乳液运载系统的稳定性和抗氧化性,一直是研究的热点方向[3-5]。
黑豆蛋白是一种兼具营养价值和乳化性能的食品级乳化剂。黑豆蛋白的氨基酸组成非常合理,必需氨基酸含量高,利于人体消化吸收。除此之外,蛋白质亲水、亲油的两亲结构,使黑豆蛋白能够吸附在水油界面上,形成一层有韧性的乳化薄膜,表现出良好的乳化性能[6]。但是,近年来国内外对黑豆蛋白的研究多集中在酶法改性和物理改性等方面[6-7],对黑豆蛋白纳米乳的研究相对较少。
虽然天然蛋白乳化剂能够有效稳定乳液,但是其抗氧化性通常较差,在提高乳液氧化稳定性,抑制被载活性物质的氧化降解等方面还有不足。绿原酸是一种天然的羟基肉桂酸类化合物,具有较强的抗氧化、抗炎、抗癌、抗高血压和抗血脂等生理功效[8]。并且,绿原酸可以通过共价和非共价的方式,与蛋白质相互作用形成具有抗氧化性的复合物,从而在提高乳化剂的乳化能力的基础上,进一步提高乳化剂的抗氧化性[8-9]。Karefyllakis等[10]以非共价作用交联向日葵蛋白和绿原酸,结果表明:向日葵蛋白-绿原酸复合物的界面张力较天然蛋白显著降低,蛋白乳化性明显提高。Jiang Jiang等[11]以绿原酸非共价修饰乳清蛋白和酪蛋白,发现在多酚的作用下,蛋白结构展开,表面疏水性和溶解性显著升高,起泡性也明显增强。Chen Yichun[12]和Liu Fuguo[9]等研究均发现蛋白质与绿原酸共价结合后,多酚可作为H+供体终止自由基链反应,从而改善蛋白-绿原酸共价复合物的抗氧化性。由此可见,以蛋白质-多酚复合物为乳化剂构建乳液运载体系,应该是提高乳液稳定性和抗氧化性的可行途径。
目前,有关多酚交联对蛋白质结构和性质影响的研究较为充分。如Sui Xiaonan等[13]研究了大豆蛋白与花青素之间的共价和非共价作用,发现花青素能够改变大豆蛋白结构,提高蛋白质的乳化性和起泡性,并且共价作用更加稳定,所制备的大豆蛋白-花青素共价复合物性质更好。但是,现阶段对比共价和非共价2种不同作用机制,进而探讨其乳液的基本特性和稳定性的研究鲜见报道。因此,本研究以共价和非共价2种作用机制,采用绿原酸交联黑豆蛋白制备黑豆蛋白-绿原酸共价和非共价复合物,研究不同作用机制下,多酚对蛋白结构和性质的影响,尤其是乳化性和抗氧化性;分别以黑豆蛋白-绿原酸共价和非共价复合物为乳化剂,制备纳米乳液,测定乳液的基本性质,并探讨绿原酸对乳液稳定性的影响,旨在为开发高抗氧化性的食品级乳液运载体系提供一定理论基础和参考。
1 材料与方法
1.1 材料与试剂
黑豆 黑龙江省和粮农业有限公司;绿原酸(98%) 北京索莱宝科技有限公司;其他试剂为分析纯。
1.2 仪器与设备
XJA-100A型微型高速粉碎机 南京环科分析仪器有限公司;Z36HK高速离心机 德国Hermle 公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;Chirascan圆二色谱仪 英国Applied Photophysis公司;LS55荧光分光光度计 英国PerkinElmer Llantrisant公司;Malvern Nano-S90纳米激光粒度仪、Zetasizer Nano Zeta电位分析仪 英国Malvern公司;FT200-SH数显高速均质分散机 上海标本模型厂;JY92-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 黑豆分离蛋白的提取
参考Jiang Lianzhou等[6]的方法。黑豆去皮后粉碎,过50 目筛得豆粉,正己烷混合脱脂。将脱脂黑豆粉与去离子水按质量比1∶10混合分散,加1 mol/L的NaOH溶液,调节体系pH 8.5,搅拌1.5 h后,4 000 r/min离心15 min,取上清液加1 mol/L的HCl溶液,调节体系pH 4.5,静置2 h,再次4 000 r/min离心20 min,取沉淀加去离子水溶解后,加1 mol/L的NaOH溶液,调节体系pH 7.0,得黑豆蛋白溶液,冻干后备用。以凯式定氮法测定黑豆蛋白质量分数为(84.15±3.46)%。
1.3.2 黑豆蛋白-绿原酸共价和非共价化合物的制备
参考Ferraro[14]和Yang Chen[15]等的实验方法,先将黑豆蛋白和绿原酸分别充分溶解,然后将黑豆蛋白溶液和多酚溶液混合,控制黑豆蛋白质量浓度为4 mg/mL,绿原酸含量分别为0、5、25、50、150、250 μmol/g(蛋白)。在pH 7.0(非共价作用)或pH 9.0(共价作用)条件下,持续搅拌2 h(非共价作用)或12 h(共价作用),期间滴加NaOH或HCl溶液保持体系pH值稳定。以3 500 kDa的透析袋,用磷酸盐缓冲液(0.01 mol/L,pH 7.0)对产物透析48 h,去除剩余绿原酸。透析后溶液经冻干后,得黑豆蛋白-绿原酸非共价复合物和黑豆蛋白-绿原酸共价复合物。
1.3.3 多酚结合率的测定
参考Gong Ying等[16]的实验方法,取0.5 mL一定浓度的样品溶液,加入2.5 mL福林-酚试剂(0.2 mol/L), 避光反应5 min后,加入2 mL Na2CO3溶液(7.5 g/100 mL),继续避光反应2 h后,于波长760 nm处测定吸光度,绘制绿原酸标准曲线,并按式(1)计算多酚结合率:

1.3.4 荧光光谱测定
以280 nm为激发波长,取质量浓度为0.2 mg/mL的样品溶液,进行荧光光谱扫描(300~525 nm)[17]。
1.3.5 圆二色光谱测定
蛋白样品溶于pH 7.0的磷酸盐缓冲溶液中,蛋白质量浓度为0.15 mg/mL。在波长190~260 nm范围内测定圆二色光谱,扫描速率75 nm/min,分辨率0.1 nm。用“CDNN”软件对数据进行处理,计算蛋白中各二级结构的含量[18]。
1.3.6 乳化活性和乳化稳定性测定
参考Pearce等[19]的方法,取1 mg/mL蛋白溶液以体积比3∶1与大豆油混合,10 000 r/min均质2 min。分别在均质后的第0分钟和第10分钟时,吸取40 μL底部液体,与5 mL十二烷基硫酸钠溶液(1 mg/mL)振荡混匀,于波长500 nm处测量吸光度,按式(2)、(3)计算乳化活性和乳化稳定性:

式中:A0、A10分别为均质后第0、10分钟时乳液的吸光度;N为稀释因子(125);φ为油相的体积占比(0.25);L为比色杯的厚度(1 cm);c为蛋白质量 浓度/(mg/mL)。
1.3.7 抗氧化性测定
1.3.7.1 ABTS阳离子自由基清除能力
根据Pellegrini等[20]的方法。配制2,2′-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2′-amino-di(3-ethylbenzothiazoline sulphonic acid-6)ammonium salt,ABTS)溶液(pH 7.0,ABTS 7 mmol/L,K2S2O82.45 mmol/L)。 稀释此溶液至所需质量浓度,取3 mL加入1 mg/mL的样品溶液30 μL,避光反应5 min后,测定波长734 nm处吸光度A,对照空白ABTS阳离子自由基溶液吸光度A0,按 式(4)计算ABTS阳离子自由基清除率:
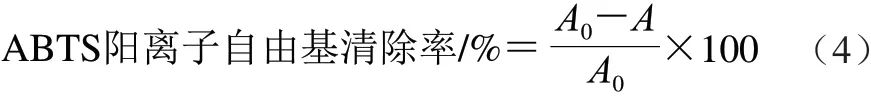
1.3.7.2 DPPH自由基清除能力
根据Gong Ying等[21]的方法。混合样品溶液(1 mL,1 mg/mL)与1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picryl-hydrazyl,DPPH)-乙醇溶液(4 mL 0.1 mmol/L), 避光反应30 min,测定波长517 nm处吸光度A,对比样品乙醇溶液吸光度Ai和DPPH-乙醇溶液吸光度Aj,按 式(5)计算DPPH自由基清除率:

1.3.7.3 铁离子还原能力
根据Yildirim等[22]的方法。充分混合样品溶液(1 mL,1 mg/mL),K3[Fe(CN)6]溶液(2.5 mL,10 mg/mL) 和pH 6.6的磷酸盐缓冲溶液(2.5 mL,0.2 mol/L),并于50 ℃水浴中反应20 min。然后,将体系冷却至室温,再加0.1 g/mL TCA溶液2.5 mL,混匀后5 000 r/min离心10 min。取2.5 mL上清液加同体积蒸馏水稀释,与FeCl3溶液(0.5 mL,10 mg/mL)充分混合,反应10 min后,测定波长700 nm处吸光度。
1.3.8 乳液的制备
按照体积比97∶3的比例混合水相(蛋白20 mg/mL)和油相(大豆油)。首先,利用高速均质分散机10 000 r/min 分散4 min,制备粗乳液。然后,将直径0.636 cm的钛探针置于粗乳液中,继续用超声波细胞粉碎机,超声功率400 W超声15 min,制得终乳液[23]。
1.3.9 乳液粒径及Zeta电位测定
利用纳米激光粒度仪和电位分析仪分别测定乳液的粒径和Zeta电位。测定前需用pH 7.0的磷酸盐缓冲液稀释样品至适当浓度,以避免多重光散射效应。
1.3.10 界面蛋白含量测定
根据Chen Maoshen等[24]的方法。10 000 r/min离心乳液60 min,使乳液分层。吸取下层水相清液,经0.45 μm水系过滤膜过滤后,用Lowry法测定蛋白浓度cf。然后,重复相同步骤测定起始蛋白乳化剂浓度c0,以及离心后上清液蛋白浓度cs,按式(6)计算界面蛋白(adsorbed protein at the interface,AP)含量:

1.3.11 乳液稳定性测定
1.3.11.1 贮存稳定性于4 ℃条件下冷藏贮存乳液30 d,每10 d测定乳液粒径一次,以乳液粒径为指标分析其贮存稳定性。
1.3.11.2 氧化稳定性
于4 ℃条件下冷藏贮存乳液30 d,每10 d测定乳液脂质过氧化值(peroxide value,POV)和硫代巴比妥酸与脂质氧化次级产物反应的硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值,以POV和TBARS值为指标分析其氧化稳定性。
根据Chaiyasit等[25]的方法,对样品POV进行测定。将0.2 ml乳液与1.5 mL异丙醇与异辛烷的混合溶液充分混合后,离心。再向0.2 mL上清液中加入2.8 mL甲醇和正丁醇混合溶液、15 μL 3.94 mol/L的NH4SCN溶液和15 μL Fe2+溶液,避光反应20 min后,测定波长510 nm处吸光度。通过过氧化氢异丙苯标准曲线计算样品POV。
根据Mei Longyuan等[26]方法,对样品TBARS值进行测定。混合2 mL乳液样品溶液与2 mL 三氯乙酸-硫代巴比妥酸-HCl和2,6-二叔丁基对甲酚的混合溶液,沸水浴反应15 min后,冷却至室温。4 000 r/min离心10 min后,测定波长532 nm处上清液吸光度。利用丙二醛标准曲线计算样品TBARS值。
1.4 数据处理
所有实验平行重复3 次,以SPSS 20.0软件对数据进行ANOVA差异显著性分析,P<0.05,差异显著。使用Origin V8.1、PeakFit V4.12等软件进行数据处理和图表绘制。
2 结果与分析
2.1 多酚结合率
利用福林-酚法[16]测定了黑豆蛋白与绿原酸的结合率,结果如图1所示。随着绿原酸含量的增加,黑豆蛋白与其结合率逐渐升高,当绿原酸含量为150 μmol/g时,多酚结合率最大,分别为(57.95±1.10)%(非共价复合物)和(87.54±2.04)%(共价复合物)。之后,继续提高绿原酸含量,复合物的多酚结合率不再升高,反而降低,这一现象主要与多酚结合率的计算方法有关。根据计算公式可知,多酚结合率等于复合物中结合的绿原酸与加入绿原酸总量的百分比。因此,当与蛋白质结合的绿原酸趋于饱和的时候,绿原酸与蛋白质的结合会放缓,此时继续添加绿原酸,就会使多酚结合率的数值降低。另外,由图1结果还可以发现,共价交联能够获得更高的多酚结合率。这主要是因为在碱性条件下(pH 9.0),绿原酸中的羟基易氧化成为醌,进而与氨基酸残基反应形成稳定的C—N和C—S共价键,最终形成稳定的共价复合物[10]。而在中性条件下(pH 7.0),绿原酸中的酚羟基和苯环会与蛋白质之间以疏水作用、氢键或范德华力等作用力结合,形成非共价复合物。但是非共价交联属于可逆作用力,其稳定性较共价作用弱,所以通常蛋白-多酚非共价复合物的多酚结合率低于其共价复合物[17]。

图1 黑豆蛋白-绿原酸非共价和共价复合物的多酚结合率Fig. 1 Polyphenol-binding capacity of BSPI-CA non-covalent and covalent conjugates
2.2 荧光光谱分析
由图2可知,添加绿原酸后,蛋白质的荧光峰强度降低,且绿原酸浓度越高,峰强降低越显著。这一现象的发生主要是因为氨基酸残基与多酚作用后,多酚量子产率低,导致蛋白质发生荧光猝灭[27]。同时,加入绿原酸后,蛋白质的荧光峰位还发生了红移。这主要归因于绿原酸交联导致蛋白质结构伸展,发生解折叠,所以包埋在蛋白质内部的疏水氨基酸残基暴露至极性环境中,蛋白质三级结构改变。本结果与Jiang Jiang等[11]研究结果一致。另外,对比图2a、b可知,共价作用所导致的峰强降低和红移现象较非共价作用更加明显。分析原因可能是共价结合中醌与氨基酸残基间的作用更强、更稳定,因此结合了更多的疏水氨基酸,实现了更高的多酚结合率,因而导致荧光光谱中更明显的变化。
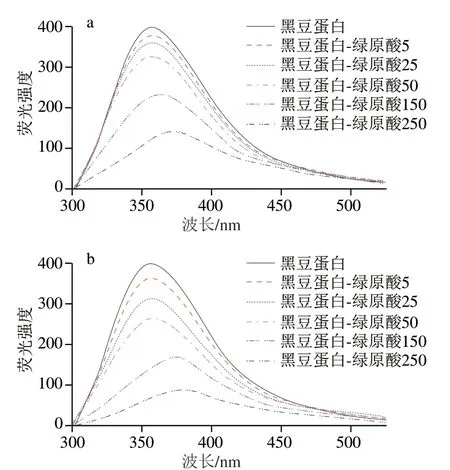
图2 黑豆蛋白-绿原酸非共价和共价复合物的荧光光谱Fig. 2 Fluorescence spectra of BSPI-CA non-covalent and covalent conjugates
2.3 圆二色谱图分析
由图3可知,在波长190~260 nm范围内,蛋白质圆二色性发生改变,表明绿原酸复合会导致蛋白质构象转变。对于黑豆蛋白-绿原酸非共价复合物,随绿原酸含量增加,α-螺旋相对含量逐渐降低,无规卷曲相对含量逐渐升高(表1)。在蛋白质二级结构中,α-螺旋结构是肽链通过氢键稳定的紧密螺旋结构,由于全部肽键均可成氢键,α-螺旋结构非常稳定[28]。而α-螺旋相对含量的降低则表明蛋白质中有序结构遭到破坏,同时无规卷曲相对含量的增加,进一步说明蛋白质分子趋于松散和无序。Jia Jingjing等[29]研究表明绿原酸能够降低β-乳球蛋白中的α-螺旋含量。Shen Fei等[30]也发现茶多酚的非共价作用会引起卵白蛋白中α-螺旋的减少和β-折叠的增加,从而形成结构更加松散的蛋白质。此外,共价交联后黑豆蛋白结构变化的趋势与非共价基本一致,只是α-螺旋相对含量降低程度更加明显。这可能是因为蛋白质与绿原酸之间的共价作用较为稳定,多酚结合率更高,因此对蛋白质结构的影响更为显著。这一结果与Sui Xiaonan等[13]研究结果相似,该研究发现在大豆蛋白-花青素复合物的制备中,共价复合物的有序结构降低明显高于非共价复合物。
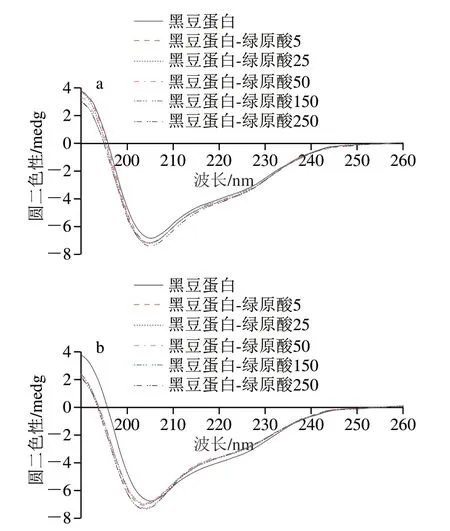
图3 黑豆蛋白-绿原酸非共价和共价复合物的圆二色谱图Fig. 3 CD spectra of BSPI-CA non-covalent and covalent conjugates

表1 黑豆蛋白-绿原酸非共价和共价复合物的二级结构相对含量Table 1 Secondary structures of BSPI-CA non-covalent and covalent conjugates
2.4 乳化性分析
由表2可知,与绿原酸交联后,所得复合物的乳化性有显著提高,乳化活性和乳化稳定性分别升高至80.37 m2/g和27.07 min(非共价作用),以及89.82 m2/g和33.83 min(共价作用)。这主要是因为绿原酸能够显著改变蛋白质结构,使蛋白质结构趋于松散和无序,进而达到更好的亲水-疏水平衡,形成稳定的界面乳化剂层,使黑豆蛋白-绿原酸复合物较天然黑豆蛋白表现出更优秀的乳化性能[31-32]。Jia Zhenbao等[33]也在表没食子儿茶素没食子酸酯修饰乳清蛋白的研究中发现,多酚的交联能够改变蛋白质的二级、三级结构,并增强蛋白的乳化性能。此外,黑豆蛋白-绿原酸共价复合物乳化性要高于非共价复合物,这与共价作用更强的稳定性有关。从圆二色和荧光结果看(表1和图2),共价作用对蛋白质的结构影响更大,且复合物具有更高的多酚结合率(图1),因此共价复合物乳化能力的提升也更加明显。

表2 黑豆蛋白-绿原酸非共价和共价复合物的乳化性Table 2 Emulsifying properties of BSPI-CA non-covalent and covalent conjugates
2.5 黑豆蛋白-绿原酸复合物的抗氧化性测定
由图4可知,在添加绿原酸后,所得蛋白复合物的抗氧化性随绿原酸含量增大而逐步提升(P<0.05)。有研究表明酚类物质能够作为H+和电子供体,终止自由基链反应,因此酚类物质能够有效增加蛋白质的抗氧化能力[6,9]。此外,相较于非共价复合物,相同绿原酸含量下,共价复合物具有更高的多酚结合率,引入更多的酚羟基,因此有利于共价复合物发挥出更强的抗氧化作用。

图4 黑豆蛋白-绿原酸非共价和共价复合物的抗氧化性Fig. 4 Antioxidant activity of BSPI-CA non-covalent and covalent conjugates
2.6 绿原酸对黑豆蛋白乳液性质的影响
2.6.1 乳液基本性质的测定
根据复合物乳化性测定的结果,绿原酸含量为150 μmol/g和250 μmol/g时,所得复合物的乳化性虽有升高,但已无显著差别。因此,选择150 μmol/g为绿原酸的最佳添加量,制备黑豆蛋白-绿原酸非共价和共价复合物,且将其作为乳化剂稳定纳米乳液,进一步考察绿原酸交联对乳液稳定性和抗氧化性的影响。由表3可知,黑豆蛋白-绿原酸非共价和共价复合物稳定的纳米乳液具有更小的乳滴粒径和更均匀的粒径分布(多分散性指数<0.2)。这说明绿原酸能够提高黑豆蛋白的两亲能力,增强蛋白质在油水界面的吸附[34]。这一结论也与界面蛋白含量的测定结果一致,随界面蛋白含量的增加,乳液平均粒径逐渐降低。Sabouri等[35]在研究儿茶素与酪蛋白的相互作用时也发现酚羟基可与蛋白质中的羧基作用,改善蛋白质的两亲性质,从而降低蛋白质界面张力,促进蛋白质在油水界面上的吸附。另一方面,绿原酸还能够有效增加乳滴的表面电荷,使乳液Zeta电位的绝对值显著升高(P<0.05)。这有利于乳滴之间保持比较强的静电排斥,获得较小的平均粒径。其中,稳定的共价作用,可获得更高的多酚结合率,使黑豆蛋白-绿原酸共价复合物具有更多的负电荷,形成平均粒径最小的纳米乳液。Sui Xiaonan等[13]也发现花青素能够有效降低大豆蛋白乳液的粒径,增加乳液的Zeta电位绝对值,并且共价作用的影响更为显著,有利于高稳定性乳液的制备。

表3 黑豆蛋白-绿原酸复合物乳液的平均粒径、Zeta电位和 界面蛋白含量Table 3 Mean particle sizes, zeta-potentials and AP contents of BSPI-CA conjugate-stabilized nanoemulsions
2.6.2 乳液的贮存稳定性
如图5所示,天然黑豆蛋白乳液稳定性较差,在第10天时,粒径已经显著升高(P<0.05),说明乳液已经发生了絮凝和聚结。而黑豆蛋白-绿原酸非共价复合物稳定的乳液次之,在第10天乳液粒径虽然也增加,但升高程度较天然黑豆蛋白低。黑豆蛋白-绿原酸共价复合物乳液的稳定性最好,在第20天才出现乳液粒径增加。这是因为绿原酸能够降低乳液的平均粒径,而较小粒径的乳滴在布朗运动中更能保持稳定,对抗重力导致的沉降[3]。另外,更高的Zeta电位使乳液具有更强的静电排斥,有效防止了乳滴之间的聚集,进一步保持了乳液的稳定[34]。所以,综合粒径和Zeta电位两方面的原因,自身粒径最小、Zeta电位最高的黑豆蛋白-绿原酸共价复合物纳米乳表现出了最佳的贮存稳定性。

图5 黑豆蛋白-绿原酸复合物乳液在贮存期间的平均粒径Fig. 5 Mean particle sizes of BSPI-CA conjugate-stabilized nanoemulsions during storage
2.6.3 乳液的氧化稳定性
如图6所示,黑豆蛋白纳米乳的POV和TBARS值增长最快,油脂氧化迅速,乳液氧化稳定性较差。而黑豆蛋白-绿原酸非共价复合物纳乳液的POV和TBARS值整体较天然蛋白低,说明其具有一定抗氧化能力,但氧化稳定性也不理想。相比,黑豆蛋白-绿原酸共价复合物乳液的氧化稳定性改善最为明显。Jacobsen等[4]研究表明乳液的氧化稳定性与乳化剂的抗氧化性有关。这是因为油脂氧化易于发生在油水界面处,绿原酸交联提高了蛋白乳化剂的抗氧化性,乳化剂层有效阻挡了氧化剂与油脂的作用,抑制了油脂氧化[36]。同时,与可逆的非共价作用相比,稳定的共价作用使黑豆蛋白-绿原酸共价复合物具有更高的抗氧化性,更强的油水界面吸附能力,有利于形成更加致密的乳化剂膜,使乳液氧化稳定性的提升更加显著。Fan Yuting等[2]也发现多酚交联可以明显降低乳清蛋白乳液的POV和TBARS值的增长速度,提高乳液的氧化稳定性。

图6 黑豆蛋白-绿原酸复合物乳液在贮存期间的POV(a)和 TBARS值(b)Fig. 6 POVs (a) and TBARS values (b) of BSPI-CA conjugatestabilized nanoemulsions during storage
3 结 论
由于多酚能够在碱性条件下氧化成醌,与蛋白质之间形成稳定的共价作用,相较于可逆的非共价作用,黑豆蛋白-绿原酸共价复合物的多酚结合率明显高于非共价复合物。并且共价作用对黑豆蛋白的结构影响也更为显著,蛋白质结构更为无序和松散。
绿原酸有效改善了蛋白质的亲疏水平衡,使蛋白质的乳化性能提升,同时为蛋白质引入了大量的酚羟基,增强了蛋白质的抗氧化性。
较高的多酚结合率和更稳定的结合都使得黑豆蛋白-绿原酸共价复合物的乳化性和抗氧化性更为优越。所以,黑豆蛋白-绿原酸共价复合物所制备的纳米乳平均粒径最小,Zeta电位绝对值最大,界面蛋白含量最高,说明其在油水界面的吸附能力最强,具有较强的空间位阻排斥和静电排斥,进而使乳液表现出较高的贮存稳定性和氧化稳定性。因此,绿原酸交联是改善乳液载体稳定性和抗氧化性的可行途径。

