无菌体液中耐碳青霉烯肠杆菌科细菌的临床分布及耐药性分析*
张鸿娟,孟雪斐,马志刚,单 斌△
1.昆明医科大学第一附属医院医学检验科,云南昆明 650032;2.云南省医学检验临床研究中心,云南昆明 650032;3.云南省检验医学重点实验室,云南昆明 650032
细菌耐药已成为全球公共健康领域的重大挑战,其中尤以耐碳青霉烯类肠杆菌科细菌(CRE)引起的感染形势最为严峻。CRE菌株所致感染具有高病死率、高耐药性、高传播性的特点[1]。根据美国疾病预防控制中心对CRE的定义,满足以下任意一个条件的肠杆菌科细菌即定义为CRE:(1)对亚胺培南、美罗培南、厄他培南或多利培南任何一种碳青霉烯类抗菌药物耐药者,对于天然对亚胺培南敏感性降低的细菌(如摩根菌属、变形杆菌属和普罗威登菌属等),需参考除亚胺培南外的其他碳青霉烯类抗菌药物的药敏结果;(2)产生碳青霉烯酶[2]。研究显示,CRE所致侵袭性感染的病死率可达56.7%[3]。CRE菌株通常还携带有对其他抗菌药物耐药的基因,对抗菌药物呈广泛耐药甚至全耐药的特征,使临床的抗感染治疗面临无药可用的困境。碳青霉烯酶耐药基因大多数位于可移动基因元件上,导致其很容易在不同肠杆菌科细菌以及其他革兰阴性杆菌间转移,在短时间内可导致大范围的流行播散[4]。2019年全国细菌耐药监测网(CARSS)数据显示,全国1 429所医院临床分离的肺炎克雷伯菌对碳青霉烯类抗菌药物的平均耐药率为10.9%,部分省市甚至超过20%[5]。本研究旨在分析昆明医科大学第一附属医院无菌体液(含全血、脑脊液、胸腔积液、腹水、无菌部位引流液)中检出的CRE分布及耐药特点,以期为临床合理使用抗菌药物提供依据,改善患者结局,减轻患者疾病负担。
1 资料和方法
1.1菌株来源 菌株来源于昆明医科大学第一附属医院2020年1月至2021年2月临床无菌部位标本经培养瓶培养,药敏结果为亚胺培南或美罗培南耐药的肠杆菌科细菌,依据保留同一患者相同细菌第一株的原则剔除重复菌株后纳入最终分析。
1.2仪器和设备 美国BD全自动微生物培养系统 Bactec Fx200,英国BAKER生物安全柜,法国生物梅里埃公司微生物鉴定及药敏分析系统,法国生物梅里埃公司全自动平板接种仪,美国THERMO CO2培养箱,美国GE凝胶电泳图像分析仪(Image Quant LAS 500),天隆科技基因扩增热循环仪,PowerPac3000型电泳仪。
1.3质量控制 全自动微生物分析仪和药敏纸片扩散法均按照美国临床实验室标准化协会(CLSI)要求进行质量控制。质控菌株为大肠埃希菌ATCC25922、金黄色葡萄球菌ATCC25923、表皮葡萄球菌ATCC49134、肺炎克雷伯菌ATCC700603、阴沟肠杆菌ATCC700323、铜绿假单胞菌ATCC27853、肺炎链球菌ATCC49619、粪肠球菌ATCC29212、屎肠球菌ATCC35667,每周进行一次质控。采用正确的消毒方法及由受过培训的专业人员按照标准操作程序进行无菌体液标本的采集,以保证检验前质量。
1.4方法
1.4.1细菌鉴定及药敏试验 参照《血培养检测规范化操作》进行标本的正确采集并将其快速置于全自动微生物培养系统。仪器报警有阳性瓶时,取出阳性培养瓶充分颠倒混匀,涂片进行革兰染色镜检,同时用1 mL无菌注射器抽取瓶内适量培养液,常规转种血琼脂平板、麦康凯平板,每个平板3~5滴4区划线,脑脊液标本加种巧克力平板和沙保罗琼脂平板,置35 ℃、5% CO2培养箱培养18~24 h。根据菌落形态特点,作初步判断,然后使用法国生物梅里埃公司微生物鉴定及药敏分析系统进行药敏试验。药敏试验结果参照CLSI标准进行结果判读,发现非敏感菌株即进行表型确证试验。
1.4.2表型确证试验 采用改良碳青霉烯灭活试验(mCIM)进行表型确证试验。取1 μL接种环满环生长于琼脂平板上的过夜培养纯菌落,于2 mL TSB肉汤中,振荡混匀10~15 s。每管放入一张含10 μg美罗培南的无菌纸片,确认纸片浸没于菌悬液中。(35±2)℃大气环境孵育(4±0.25)h。孵育结束时,立即用生理盐水制备0.5麦氏浊度的大肠埃希菌ATCC 25922菌悬液。菌悬液制备和平板涂布必须在15 min内完成,干燥3~10 min。用10 μL接种环将美罗培南纸片从TSB肉汤中取出,将纸片贴于试管内壁,轻轻按压以挤去纸片上多余水分,然后将纸片取出贴于已涂布有大肠埃希菌ATCC 25922的MHA平板上。100 mm的MHA平板最多贴4张纸片,150 mm的MHA平板最多贴8张纸片;倒置平板,(35±2)℃大气环境孵育18~24 h;测量抑菌圈直径。美罗培南抑菌圈直径为6~15 mm,或直径为16~18 mm但抑菌圈内有散在菌落,判读为碳青霉烯酶阳性;抑菌圈直径≥19 mm,判读为碳青霉烯酶阴性;抑菌圈直径为16~18 mm,或直径为≥19 mm但抑菌圈内有散在菌落,判读为碳青霉烯酶不确定。
1.4.3PCR扩增CRE菌株的耐药基因 煮沸法裂解提取细菌DNA,扩增的碳青霉烯酶基因包括blaKPC、blaNDM、blaOXA-48、blaIMP、blaVIM。PCR反应体系(50 μL):RNase/DNase-free水15.0 μL,BlasTaq 2×PCR MasterMIX 25.0 μL,模板4.0 μL,引物F 2.0 μL,引物R 2.0 μL。PCR反应条件:94 ℃预变性 5 min;94 ℃变性30 s,退火(温度见表1)30 s,72 ℃延伸30 s(30个循环);72 ℃延伸5 min。引物序列及退火温度见表1。引物由北京擎科生物有限公司合成,2%琼脂糖凝胶进行电泳,电泳时间30 min。电泳结果显示阳性的扩增产物送北京擎科生物有限公司进行测序分析。测序结果与NCBI数据库进行比对。

表1 PCR扩增引物及退火温度
1.5统计学处理 采用WHONET5.6和SPSS22.0进行结果处理和分析,率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1患者基本情况与菌株分类 从无菌体液中分离鉴定出46株CRE。46株CRE菌株来源的患者中男40例,女6例;年龄为17~90岁,中位数为50岁;住院天数为4~93 d,中位数为31 d;患者30 d病死率为32.6%(15/46)。46株CRE菌株共分布于5种标本,其中引流液来源于无菌部位,为胰腺引流液及胆管引流液(表2);共来源于10个科室,其中急诊监护室占37.0%,重症医学科占30.4%(表3)。

表2 无菌体液中CRE菌株分布情况
2.2细菌种类分布 46株CRE菌株中肺炎克雷伯菌43株,大肠埃希菌1株,产气克雷伯菌1株,阴沟肠杆菌1株。耐碳青霉烯类肺炎克雷伯菌中检出携带blaKPC基因 32株、blaOXA-48基因7株、blaIMP基因 1株,检出同时携带blaKPC、blaOXA-48基因2株,检出未携带blaKPC、blaOXA-48、blaNDM、blaIMP、blaVIM基因的菌株1株。耐碳青霉烯类大肠埃希菌1株,耐药基因为blaOXA-48。耐碳青霉烯类产气克雷伯菌1株,耐药基因为blaOXA-48。耐碳青霉烯类阴沟肠杆菌1株,耐药基因为blaNDM。
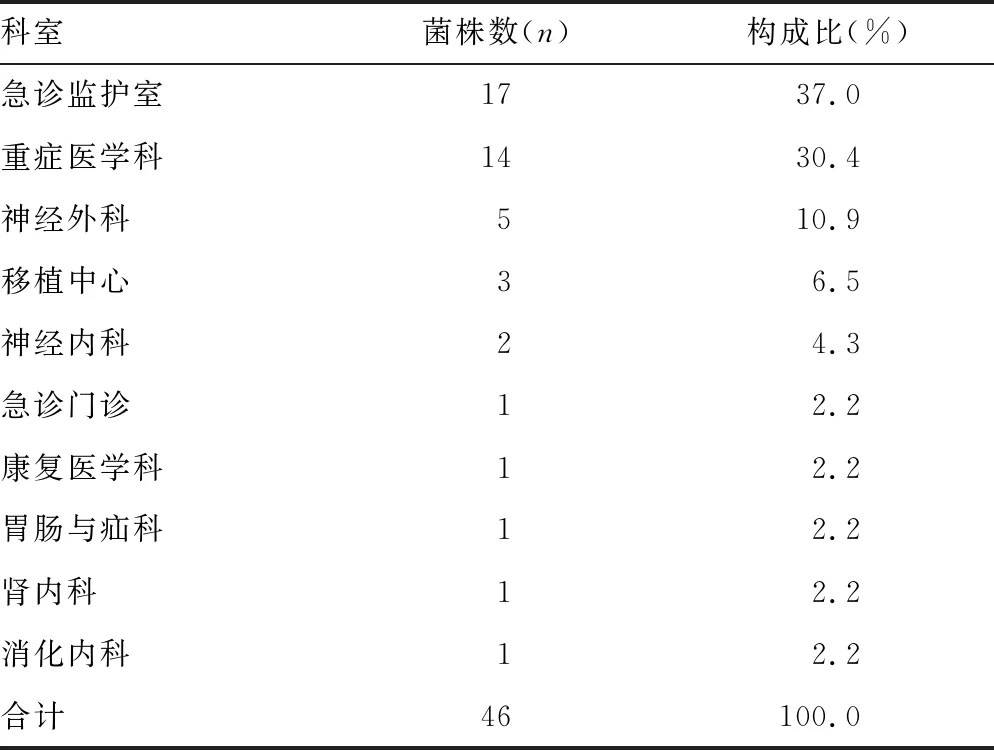
表3 无菌体液中CRE菌株来源科室的分布情况
2.3药敏试验结果 46株无菌体液中分离的CRE除对碳青霉烯类抗菌药物(亚胺培南或美罗培南)耐药外,对β-内酰胺类、氨基糖苷类、大环内酯类、磷霉素等抗菌药物普遍耐药,未发现对替加环素耐药的菌株(表4)。
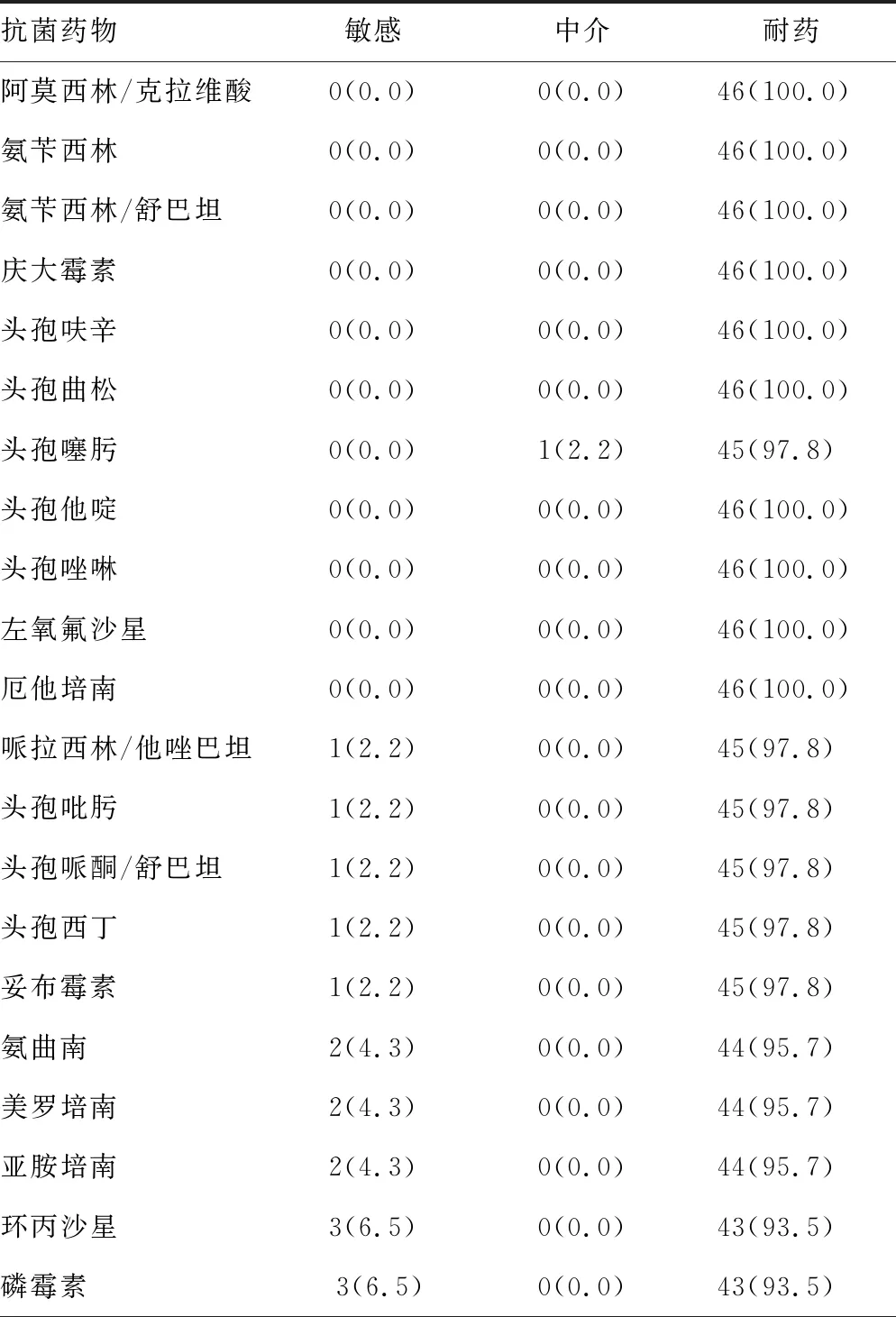
表4 46株CRE菌株对常见抗菌药物的药敏试验结果[n(%)]
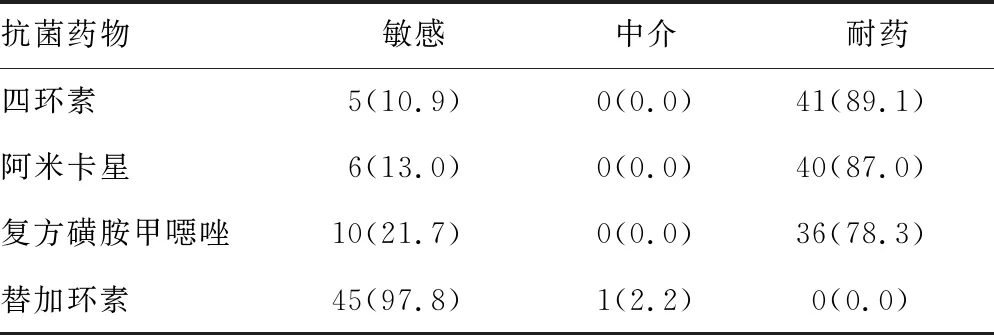
续表4 46株CRE菌株对常见抗菌药物的药敏试验结果[n(%)]
3 讨 论
碳青霉烯类抗菌药物被认为是治疗肠杆菌科细菌感染的最后一道防线[6]。随着CRE的检出率不断升高,临床抗感染治疗面临无药可用的困境,患者及其家属因疾病所遭受的痛苦和经济负担显著增大。CRE引起的侵入感染,病死率高。有研究显示,我国CRE血流感染30 d病死率为46.2%[7]。在血液病患者中,CRE导致的血流感染病死率甚至高达77.3%[8]。本研究中,无菌体液分离出CRE的患者30 d病死率为32.6%(15/46),低于文献报道。这可能与本研究标本来源中包括胸腔积液、腹水及无菌部位引流液相关。有研究表明,医疗器械使用、侵入性医疗操作是医院获得性CRE的风险因素。呼吸机表面、气管内套管是耐碳青霉烯类肺炎克雷伯菌传播的重要危险因素[9]。本研究中,所有患者均进行了侵入性操作,有的患者有2项以上的侵入性操作,同时患者普遍病情危重、年龄较大、常合并多种疾病、有外伤等,促使肠道、呼吸道和尿路定植的细菌发生感染。CRE定植导致CRE感染率高达16.5%,而且定植发展为感染的患者病死率更高[10]。有研究显示,通过对入住ICU患者进行CRE的主动筛查,病房产碳青霉烯酶细菌的定植率从28.6%下降至5.6%,感染率从35.7%下降至2.8%[10]。因此,有条件的医疗机构宜结合自身特点、耐药菌监测数据对特定人群进行CRE的主动筛查。
不同国家、不同地区、不同医院、不同人群以及不同细菌所产的碳青霉烯酶种类均有差异[11]。我国临床分离的CRE菌株产生的碳青霉烯酶以KPC、NDM和OXA-48型为主。中国细菌耐药检测网(CHINET)对2018年收集自全国39所医院935株CRE菌株的研究结果显示,产KPC、NDM和OXA-48型碳青霉烯酶的菌株所占比例分别为51.6%、35.7%和7.3%[12]。本研究中产OXA-48型碳青霉烯酶的菌株占23.9%(11/46),与全国统计数据有差异,其原因一方面是由于本研究样本数量较少,另一方面是由于地区差异。本研究标本来源医院为省级三级甲等医院,接收大量下级医院的危重症患者,11株产OXA-48型碳青霉烯酶的菌株中,10例来自下级医院,而且入院前已有多日当地医院治疗史,病情较重,转院后均入住ICU,这也说明对入院患者,尤其是入住ICU的患者,入院时进行CRE主动筛查是非常必要的。有2株菌株同时产KPC和OXA-48型碳青霉烯酶,为产碳青霉烯酶复合酶的菌株。有1株常见的5种基因型检测结果均为阴性,可能为罕见基因型或其他耐药机制。
本研究中,无菌体液中分离的CRE未出现对替加环素耐药的菌株,对常见的抗菌药物呈普遍耐药。医院对无菌体液中分离的CRE采取的抗感染措施为大剂量碳青霉烯类、替加环素及其他抗菌药物两药或三药联合使用。联合用药方案发挥抗菌药物之间的协同作用,优于单药治疗,能够有效降低病死率[13]。目前,针对CRE的联合治疗方案常用两药联合,如以替加环素为基础联合碳青霉烯类或氨基糖苷类或磷霉素。对于重症患者及深部位感染,可考虑三药联合治疗[14]。除替加环素外,治疗CRE感染的药物还有多黏菌素类和头孢他啶/阿维巴坦。多黏菌素类主要杀菌机制是药物所带的正电荷与细菌细胞膜上的负电荷脂多糖结合,进而破坏细胞膜发挥杀菌作用[15]。头孢他啶/阿维巴坦主要抗菌机制是阿维巴坦抑制多种类型的β-内酰胺酶,进而保护头孢他啶的杀菌作用[16]。不同种类的抗菌药物对产不同碳青霉烯酶菌株的抗菌活性不同[17-18],如头孢他啶/阿维巴坦对产 KPC 和 OXA-48 型丝氨酸碳青霉烯酶菌株具有高度抗菌活性,但对产金属 β-内酰胺酶菌株无抗菌活性。不恰当的抗感染治疗影响患者的结局[19]。根据不同碳青霉烯酶的特征开展联合药敏试验,有助于制订精准的抗感染治疗方案[20]。因此准确、快速地对 CRE产生的碳青霉烯酶进行检测分型,对于临床抗感染治疗的精准用药和医院感染预防控制具有重要的价值,实验室应结合自身条件及临床需求开展碳青霉烯酶型的检测。