小鼠肠道3型固有淋巴样细胞检测与分析方法研究
余 利,蒋 玲,周 杰,候鹏飞,糜漫天,易 龙
(陆军军医大学军事预防医学系军队营养与食品卫生学教研室/重庆市医学营养研究中心/重庆市营养与食品安全重点实验室,重庆 400038)
肠黏膜免疫组织是机体免疫系统的重要组成部分。肠腔中大量的食物抗原、代谢产物、微生物等给肠黏膜中的各种免疫细胞提供了非常特殊的微环境,免疫细胞与微生物相互共进化而达到平衡。当这种平衡被破坏时,往往会发生炎症或感染。肠黏膜上皮及固有层中有许多不同种类的免疫细胞,固有淋巴样细胞(innate lymphoid cells,ILCs)是一类新近定义的细胞家族,在快速启动早期免疫反应限制病原体入侵、促进组织修复以及调节抗原特异性免疫反应中发挥重要作用。ILCs是一类异质性免疫细胞群,属淋巴细胞家族成员,由共同淋巴祖细胞(common lymphoid progenitor,CLP)分化而成,其既不属于传统的T细胞、B细胞,也缺乏抗原特异性受体TCR和BCR,但却能介导获得性免疫相关功能,因此成为了固有免疫与获得性免疫之间的“桥梁”。根据细胞表型、分泌细胞因子及其分化所依赖的不同转录因子,ILCs可分为1型固有淋巴样细胞(group 1 innate lymphoid cells,ILC1)、2型固有淋巴样细胞(group 2 innate lymphoid cells,ILC2)、3型固有淋巴样细胞(group 3 innate lymphoid cells,ILC3)和调节型固有淋巴样细胞(regulatory innate lymphoid cells,ILCreg)四类。其中,ILC3主要分布在肠黏膜固有层中,在维持肠道稳态、抵御外界病原体、维护肠道屏障功能方面具有重要作用[1-4],与2型糖尿病、非酒精性脂肪性肝病等慢性疾病及炎症性结肠炎等的发生密切相关[5-6],因此其成为了近年来免疫学领域研究的新热点。但是,肠黏膜固有层ILC3的检测和分析存在较多技术难点,本研究在借鉴国内外相关研究的基础上,针对小鼠小肠和结肠组织消化、固有层淋巴细胞多标记物共标和流式细胞术检测、ILC3的IL-22表达分析等环节,建立了一套成熟可行的检测和分析方法,现报告如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性C57BL/6小鼠10只,体质量20~25 g,购自陆军军医大学实验动物中心,普通饲料常规喂养,实验前12 h禁食。
1.1.2 主要试剂 胎牛血清(fetal bovine serum,FBS)、RPMI 1640培养基购自美国Hyclone公司;磷酸盐缓冲液(phosphate buffer saline,PBS)购自中杉金桥公司;Hanks和D-Hanks平衡盐溶液购自碧云天生物公司;小鼠重组IL-23蛋白购自R&D Systems公司;β-巯基乙醇购自Sigma-Aldrich公司;布雷非德菌素A和莫能霉素购自BD Bioscience公司;青霉素/链霉素(penicillin-streptomycin,P/S)混合溶液购自碧云天生物公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、二硫苏糖醇(dithiothreitol,DTT)、羟乙基哌嗪乙硫磺酸(N-2-hydroxyethylpiperazine-N-ethane-sulphonicacid,HEPES)和DNA聚合酶Ⅰ(DNase Ⅰ)购自上海生工生物公司;Percoll密度梯度离心分离液购自美国GE Healthcare公司;胶原酶D和分散酶购自瑞士Roche公司;固定/破膜试剂盒购自美国BD Bioscience公司、foxp3/转录因子染色试剂盒购自美国eBioscience公司;大鼠抗小鼠CD45 APC-CY7、CD3 FITC、CD90.2 PE-CY7、RORγt PE及IL-22 PerCP eFluor710均购自美国BD Bioscience公司,以上抗体工作浓度均为1∶100。
1.2 主要仪器
流式细胞仪(BD FCSverse,BD Biosciences公司,美国)、高速低温离心机(Beckman Coulter,德国)、台式低速水平离心机(L530,Cence湘仪离心机仪器有限公司,中国)、THZ-C恒温振荡器(江苏太仓实验设备厂,中国)、电子天平(METTLER TOLEDO,瑞士)。
1.3 实验方法
1.3.1 试剂配制 小肠预消化液:D-Hanks平衡盐溶液中加入1 mmol/L DTT、5 mmol/L EDTA、10 mmol/L HEPES、5%FBS,充分混匀,以0.22 μm过滤器过滤后置于37 ℃孵箱中备用,每只小鼠需要约20 mL。小肠消化液:Hanks平衡盐溶液中加入0.5 mg/mLⅡ型胶原酶、100 μg/mL DNase Ⅰ、10% FBS,充分混匀,以0.22 μm 过滤器过滤后置于37 ℃孵箱中备用,每只小鼠需要约10 mL。小肠密度梯度离心液:首先配制含2%FBS的RPMI 1640培养基,用该溶液和Percoll密度梯度离心分离液混合制成30% Percoll工作液,置于室温备用,每只小鼠需要约10 mL。结肠预消化液:D-Hanks平衡盐溶液中分别加入10 mmol/L HEPES和5 mmol/L EDTA,充分混匀,每只小鼠需要约10 mL。结肠消化液:Hanks平衡盐溶液中分别加入500 μg/mL胶原酶D、500 μg/mL DNase Ⅰ、0.5 U/mL分散酶和2%FBS,充分混匀,每只小鼠需要约15 mL。Percoll工作液:首先用10×PBS与Percoll密度梯度离心分离液按照1∶9的体积比混合,制备100% Percoll,再与1×PBS按不同的体积比混合可得到不同浓度的Percoll工作液。IL-22检测细胞刺激培养液:在RPMI 1640培养基中分别加入50 ng/mL IL-23、55 nmol/L β-巯基乙醇、20% FBS、2%青霉素—链霉素溶液、布雷非德菌素A(1∶1 000)和莫能霉素(1∶1 500),充分混匀。
1.3.2 小肠及结肠组织分离和前处理 肠组织分离:小鼠用5%水合氯醛麻醉后固定在手术板上,用75%乙醇消毒腹部,“工”形打开腹膜,剪开小肠与胃结合部,用镊子游离小鼠肠道组织,从回盲部完全分离小肠,切除盲肠后,在近直肠处完全分离结肠组织。肠组织前处理:将小肠和结肠组织分别置于4 ℃预冷的PBS中,去除肠系膜、脂肪组织和小肠Peyer’s淋巴结(可通过其不透明的颜色和节点结构来识别),沿肠道长轴剪开肠组织,在预冷的PBS中洗涤2次,除去粪便和黏液。
1.3.3 小肠和结肠固有层淋巴细胞分离 小肠固有层淋巴细胞分离:将小肠转入50 mL无菌EP管中,每管加入20 mL小肠预消化液,37 ℃、210 r/min震荡20 min,连续消化2次,涡旋后弃上清。用Hanks平衡盐溶液漂洗组织2次,加入10 mL小肠消化液,37 ℃、210 r/min震荡30 min,连续消化3次,收集每次的消化液,用70 μm细胞筛过滤到50 mL无菌EP管中,4 ℃、2 000 r/min离心10 min,重悬并合并细胞沉淀。每个样本用10 mL 30% Percoll工作液,2 000 r/min离心10 min,弃上清,保留细胞沉淀,1×PBS洗涤1次,用含20% FBS的RPMI 1640培养基重悬细胞。结肠固有层淋巴细胞分离:将结肠转入50 mL无菌EP管中,每管加入5 mL结肠预消化液,37 ℃、180 r/min震荡20 min,重复2次,涡旋后弃上清。立即将结肠转移到预冷的PBS中清洗,随后置于纸巾上轻拍,再用剪刀将结肠剪碎成约4 mm×4 mm的小块,然后转移到装有5 mL结肠消化液的50 mL无菌EP管中,37 ℃、210 r/min震荡20 min,重复消化3次,收集每次的消化液,用70 μm的细胞筛过滤到50 mL无菌EP管中,加入5 mL含2%FBS的RPMI 1640培养基,混匀后4 ℃、800×g离心10 min。每个样本用7 mL含2%FBS的RPMI 1640培养基重悬沉淀,加入3 mL 的100% Percoll工作液,涡旋15 s,充分混匀,1 300×g离心20 min,1×PBS洗涤1次,用含20% FBS的RPMI 1640培养基重悬细胞。
1.3.4 ILC3染色和流式细胞术检测 取分离后的肠黏膜固有层淋巴细胞,加入PBS(1 mL/1.5 mL EP管),混匀洗涤1次后,500×g离心5 min。弃上清,余约100 μL液体,涡旋细胞。加入流式检测表面抗体CD45 APC-CY7、CD3 FITC和CD90.2 PE-CY7各1 μL,4 ℃避光孵育30 min。加入1 mL PBS,混匀洗涤1次,500×g离心5 min,弃上清。加入1 mL 转录因子1×固定/破膜工作液,涡旋细胞,室温避光孵育30 min。700×g离心5 min,再加入1 mL的1×固定/破膜缓冲液,洗涤1次。以700×g离心5 min,余约100 μL液体,加入1 μL RORγt PE抗体,混匀,室温避光孵育30 min。加入PBS(1 mL/1.5 mL EP管),混匀洗涤,700×g离心5 min。弃上清,用300 μL PBS重悬细胞,随后上机检测,利用FlowJo(10.0版本)软件分析。
1.3.5 ILC3表达IL-22的检测 取分离后的肠黏膜固有层淋巴细胞,用新鲜配制的IL-22检测细胞刺激培养液重悬后,加入到24孔细胞培养板中,置于37 ℃、5% CO2孵箱中刺激和孵育4 h,随后收集细胞进行染色,细胞固定/破膜后同时加入IL-22 PerCP eFluor710抗体,其余步骤同1.3.4,随后上机检测,利用FlowJo(10.0版本)软件分析。
2 结果
2.1 小鼠小肠和结肠固有层淋巴细胞分离
小肠和结肠ILC3的检测首先要获取小肠和结肠固有层淋巴细胞单细胞悬液,分离步骤见图1,总分离时间约3 h。
2.2 小鼠小肠和结肠固有层ILC3及IL-22表达检测
本研究采用CD45+CD3-CD90.2+RORγt+多标记物共标的流式分析策略检测小肠和结肠ILC3(图2a),同时固有层淋巴细胞分离后体外刺激4 h,利用胞内流式细胞术进一步检测ILC3表达IL-22的水平(图2b),结果显示,在小肠和结肠中,ILC3在淋巴细胞中的占比分别为(8.30±2.42)%和(1.43±0.34)%,IL-22+ILC3在RORγt+ILC3中的占比分别为(38.98±8.76)%和(85.86±1.72)%,见图2c、d。

a:打开小鼠腹腔;b:分离小肠和结肠组织;c:去除肠系膜和脂肪组织;d:去除小肠和结肠内容物;e:待消化的小肠和结肠;f:将分离干净的小肠和结肠组织置于预冷的PBS中;g:分别加入小肠和结肠预消化液;h:于37 ℃摇床中消化;i、j:将组织用Hanks平衡盐溶液洗涤后加入消化液;k:过滤消化液;l:Percoll工作液纯化细胞
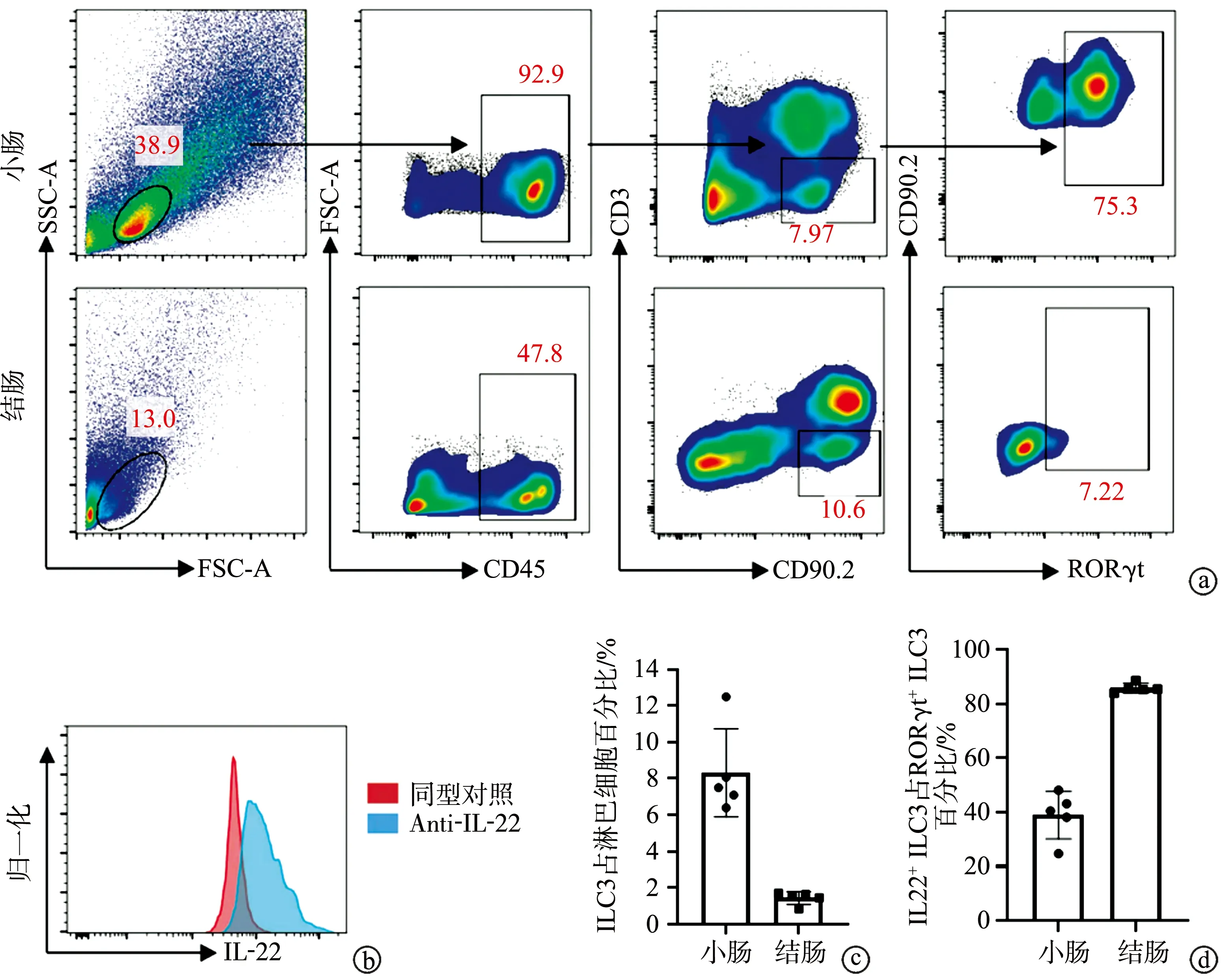
a:小肠和结肠固有层ILC3检测;b:胞内流式细胞术检测ILC3表达IL-22的水平;c、d:小肠和结肠固有层ILC3比例及IL-22表达水平
3 讨论
免疫学的发展让我们逐渐认识到,疾病高发组织器官(如肝、肠、肺、脑等)由于具有独特的结构、功能和组织微环境,形成了独特的区域免疫特性,一些重要免疫细胞群、免疫分子在疾病的发生发展中起着关键作用[7-8]。肠道既是机体吸收营养的主要器官,也是机体最大的黏膜免疫器官,是抵御病原体入侵的重要防线,肠道屏障对维持肠道局部及机体的稳态有着重要作用。ILCs是机体固有免疫的重要组成部分,在启动早期反应清除病原体入侵和感染、黏膜稳态维持、组织修复中发挥重要作用。ILCs的四个亚型ILC1、ILC2、ILC3和ILCreg[9]分别与辅助性T细胞1(Th1)、辅助性T细胞2(Th2)、辅助性T细胞17(Th17)和调节性T细胞(Treg)互为“镜像细胞”。其中,ILC3几乎全部分布于胃肠黏膜固有层中,是维持肠黏膜固有免疫及屏障功能的关键效应细胞。
肠道稳态是肠黏膜屏障、肠道菌群、营养代谢物质等相互作用形成的动态平衡状态[10]。作为在生理状态下肠黏膜组织中分布较广泛的ILCs亚群,ILC3主要通过分泌IL-22、IL-17、GM-CSF等细胞因子对抗致病菌,诱导机体对共生菌群及食物抗原的免疫耐受,并促进肠黏膜损伤修复,从而维持肠道稳态。IL-22是ILC3分泌的主要效应细胞因子,属于IL-10家族,主要由NCR+ILC3分泌,在稳态下可被黏附于肠上皮的共生菌群诱导产生,是维持肠道稳态的重要细胞因子。ILC3能够产生IL-22作用于肠上皮细胞的异二聚体受体IL-22R1、IL-22R2,激活信号转导与转录激活因子3和核苷酸结合寡聚化结构域2信号通路,使其分泌Muc1、Muc3、Muc10和Muc13等黏蛋白及RegⅢβ、RegⅢγ等抗菌肽以对抗致病菌,限制共生菌与上皮细胞的接触,避免产生肠道炎症[11]。此外,ILC3还可以通过分泌IL-17发挥促炎作用,诱导炎症性肠病的发生[12]。因此,ILC3与肠道屏障功能、多种肠道相关疾病的发生密切相关。ILC3以表达转录因子RORγt为特征,RORγt与ILC3的存活、分化和免疫功能密切相关,能够通过ROR反应元件介导IL-22表达。
原代分离肠ILCs及检测ILC3的数量和功能对于开展实验研究十分重要,但是肠ILCs的分离和ILC3的检测存在一些技术难点,且国内外不同实验室在方法上亦不统一。首先,小鼠肠黏膜固有层存在大量胶原纤维,且小肠和结肠组织中胶原纤维种类差异较大,因此选择合适的胶原酶进行消化是关键;其次,分离时间的长短与细胞活力密切相关,因此探索最优化的分离方法,缩短分离时间尤为关键;此外,由于ILC3的检测需采用多个标记物共标并通过多色流式细胞术进行,但既往ILC3细胞表面标志物和分析策略在国际上尚未完全统一,因此探索公认且便捷的表面标志物至关重要。
目前,关于肠ILCs的分离和ILC3的检测,国内外多个实验室先后建立了一些初步方法,但不同实验方法都存在一定局限性,且不同实验室之间的方法也存在一定差异。本实验室结合国内外相关研究,进一步探索和优化了ILCs分离和ILC3检测的实验条件,取得了较好的效果。本研究主要的技术特点和创新包括以下三个方面:①建立了有效去除肠系膜淋巴组织、Peyer’s淋巴结及肠上皮间淋巴细胞的方法,可避免其对固有层淋巴细胞的干扰。先机械分离肠系膜和脂肪组织,再识别小肠组织的Peyer’s淋巴结并予以去除,最后利用EDTA-DTT法将上皮层与固有层充分分离,实验结果提示,该方法基本排除了肠道其他淋巴细胞的影响,保证了固有层淋巴细胞的纯度。②建立了分别针对小肠和结肠胶原纤维的消化方法。对于小肠组织,本研究利用0.5 mg/mL Ⅱ型胶原酶消化3次的方法。由于Ⅱ型胶原酶含有更高的梭菌蛋白酶活性,有利于水解小肠固有层组织中具有三股超螺旋结构的天然胶原纤维,可充分分离小肠固有层淋巴细胞,同时加入100 μg/mL DNase I,可防止细胞死亡后释放大量的DNA导致细胞粘连,从而有效地分离出固有层单细胞悬液。对于结肠组织,本研究采用500 μg/mL胶原酶D和0.5 U/mL分散酶进行消化。胶原酶D有较低的胶原酶活性和极低的胰蛋白酶活性,能在水解胶原纤维的同时最大程度地保护细胞蛋白的完整性。分散酶也称中性蛋白酶,是一种非特异性的金属蛋白酶,可以有效水解Ⅳ型胶原纤维和纤连蛋白,适合结肠组织固有层淋巴细胞的消化分离,加入适量的DNase I后同样也可防止细胞粘连,从而有效地分离出固有层淋巴细胞单细胞悬液。但是,针对不同研究目的、实验动物和干预因素,不同实验中所采用的消化酶存在很大差异,如Wang等[13]在分离肠道固有层ILCs时选用的是Ⅱ型和Ⅲ型胶原酶,Chun等[14]则是采用胶原酶D消化分离结肠固有层ILCs,而在Dutton等[15]、Melo-Gonzalez等[16]和Zhou等[17]的研究中均采用Ⅷ型胶原酶进行小肠ILCs的消化分离。本研究所建立的方法适用于24周(6月龄)的C57BL/6小鼠,该年龄的小鼠肠道结缔组织较多,消化较困难。因此,根据不同情况选择合适的胶原酶以及消化时间,能够有效分离更多数量和有活性的ILCs。③建立了基于多种标志物的ILC3流式细胞术检测方法。ILC3自发现以来,其检测标志物随着认识的不断深入和免疫学技术的发展而不断变化,如CD45+Lin-CD127+RORγt+、CD45+Lineage-Thy1+RORγt+、CD45+Lin-CD127+CD90+RORγt+Tbet+/-等[18]。由于RORγt为核内转录因子,无法实现活细胞染色。近年来随着研究发展,为了实现ILC3的分选,CD45lowThy1.2high、CD45+Lin-CD90.2+NK1.1-NKp46+/-KLRG1-等分选策略也相继被公认,其中固有淋巴细胞为辅助性T细胞的镜像细胞,因此也常用CD3-代替Lineage-的标志物对ILC3进行标记[19]。本研究采用流式分析策略检测小肠和结肠ILC3,结果显示,此方法可成功分离小肠和结肠中的ILC3细胞,且小肠中ILC3细胞数比结肠中多,与国外同类研究基本一致[20-22]。
综上,本研究建立了一种小肠和结肠固有层ILC3检测和分析的方法,应用不同消化液分别消化小肠和结肠固有层淋巴细胞,进而通过多色流式细胞术检测ILC3及IL-22的表达,方法稳定可靠,重复性较好,为研究小肠和结肠ILC3打下了良好的基础。此外,由于肠黏膜固有层中还存在大量其他淋巴细胞亚群,本研究所建立的肠黏膜固有层淋巴细胞分离和ILC3的检测方法,也可为肠黏膜其他淋巴细胞如肠上皮间淋巴细胞、固有层T淋巴细胞、B淋巴细胞等的检测分析提供借鉴和参考。

