miR-129靶向调节Twist1抑制乳腺癌细胞的增殖、迁移和侵袭
黄方杰,苏仕新,成玉嫦
[1.中国科学院大学深圳医院(光明)甲乳外科,广东 深圳 518000;2.中国科学院大学深圳医院(光明)肾内科,广东 深圳 518000]
乳腺癌是女性常见的恶性肿瘤之一,具有较高的病死率[1]。早期乳腺癌临床症状不明显,容易造成误诊、漏诊,导致错失最佳治疗时机[2]。探究临床诊断及病理监测的生物学指标对乳腺癌的治疗及预后具有重要意义。miRNA为非编码的小分子RNA,其通过结合靶基因的3’UTR区影响mRNA转录,抑制蛋白质翻译,是理想的肿瘤标记物。miR-129家族成员在人类癌症中发挥着重要作用[3],且与多种恶性肿瘤(如宫颈癌、食管癌、直肠癌等)的发生、发展密切相关[4]。研究发现miR-129在乳腺癌组织中呈低表达,可能与乳腺癌细胞的迁移及侵袭有关[5]。然而,目前关于miR-129在乳腺癌细胞增殖、迁移中的作用尚不明确,因此本研究选取人乳腺癌SKBR3、AU565细胞系作为研究对象,探讨miR-129对乳腺癌细胞增殖、迁移及侵袭的影响,并研究其潜在的生物学机制。
1 材料与方法
1.1 实验细胞
SKBR3和AU565细胞系由中国科学院细胞库提供,所有细胞株均在37 ℃、10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素的PRMI-1640培养基中进行培养。采用等分冷冻法进行保存,可供6个月内使用。
1.2 试剂与仪器
柠檬酸钠溶液购自北京普析生物科技有限公司;PBS购自潍坊中汇化工有限公司;乙醇购自济南乐俊化工有限公司;氯仿购自上海渊诺试剂有限公司;异丙醇购自天津大茂试剂有限公司;胎牛血清购自北京亚米生物科技有限公司;去离子水由天津科技大学制备。Control-mimic、miR-129-mimic、miR-mimic-shRNA质粒、miR-129引物及U6引物均由南京金斯瑞合成。
Trizol试剂盒、反转录试剂盒、实时荧光定量PCR试剂盒(SYBR Premix Ex Taq)、ECL显色液购自Agencourt AMPure XP;RNA提取试剂盒购自上海酶联生物科技有限公司;实时荧光定量PCR仪购自美国ABI公司;离心机购自上海卢湘仪器有限公司;Lipofectamine 2000试剂盒、流式细胞仪、恒温培养箱、凝胶成像系统及全自动酶标仪均购自赛默飞世尔科技有限公司。
1.3 方法
1.3.1 细胞转染 将SKBR3或AU565细胞系均匀铺在6孔板中,待生长密度达60%时进行细胞转染。将细胞分为Control-mimic组、miR-129-mimic组、miR-129-mimic+miR-mimic-shRNA组。利用Lipofectamine 2000试剂盒将SKBR3、AU565细胞系分别转染Control-mimic、miR-129-mimic和miR-129-mimic+miR-mimic-shRNA,所有转染步骤均按照试剂盒说明书执行,转染24 h后收集细胞用于后续研究。
1.3.2 RT-PCR检测细胞系中miR-129的表达水平 取转染48 h后的细胞,采用Trizol法提取细胞中的RNA,采用microRNA茎环法逆转录试剂盒合成cDNA,采用RT-PCR试剂盒进行实时定量PCR,条件设置为:预变性90 ℃、5 min,变性95 ℃、10 s,退火60 ℃、30 s,延伸70 ℃、30 s,共 40个循环,以上所有操作严格按照说明书进行。miR-129上游引物序列为3’-GATACTCACTTTTTGCGGTCT-5’,下游引物序列为3’-GTGCAGGGTCCGAGGT-5’;U6上游引物序列为3’-CGCTTCGGCAGCACATATAC-5’,下游引物序列为 3’-CAGGGGCCATGCTAATCTT-5’。
1.3.3 CCK-8法检测细胞增殖能力 将细胞以3×104/mL的密度接种于96孔培养板中,每孔接种150 μL细胞,置于37 ℃、5%CO2的恒温培养箱中培养过夜,然后加入质粒处理,继续在恒温培养箱过夜。培养结束后,在每孔中加入10 μL CCK-8试剂,继续培养4 h。用酶标仪检测各孔的OD值,计算细胞生长速率。
1.3.4 划痕实验检测细胞迁移能力 用PBS将细胞制成混悬液,各取5×105个细胞置于6孔板中孵育,确保细胞融合率达到100%,用枪头在培养皿中进行划痕,PBS洗涤后,置于不含血清的PRMI-1640培养基中,拍照记录初始划痕宽度,然后置于培养基中培养48 h,再次拍照记录培养后划痕宽度,两次划痕的差值即为细胞的迁移距离。
1.3.5 Transwell实验检测细胞侵袭能力 采用预先铺好基质胶的Transwell小室,取200 μL细胞铺于Transwell小室的上室,在下室加入500 μL含15%胎牛血清的PRMI-1640培养基,于37 ℃、5%CO2条件下培养48 h,使用甲醛固定细胞,结晶紫染色后,每个小室取5个视野,计算细胞侵袭能力。
1.3.6 靶向基因预测及双荧光素酶报告系统 采用生物信息学软件TargetScan预测miR-129与Twist1的3’-UTR端是否存在结合位点。使用Promega荧光素酶检测试剂盒对Control-mimic组与miR-129-mimic组细胞荧光强度进行检测:12孔板每孔加入细胞裂解液250 μL,室温振荡15 min,吸取20 μL细胞裂解液,加入100 μL双荧光素酶底物后立即放入生物发光检测仪检测Firefly荧光强度。在原管加入100 μL Stop&Glo Reagent,轻柔混匀后立即检测Renilla荧光强度。
1.3.7 Western blot检测miR-129对Twist1蛋白的影响 取转染48 h后的细胞,用含蛋白酶抑制剂(Roche Molecular Biochemicals)的细胞裂解液(20 nm Tris-HCl pH 7.4,5 mmol/L EDTA,1% Trition X-100,150 mmol/L NaCl,1% DTT)进行裂解,提取总蛋白,进行SAS-PAGE凝胶电泳,转膜后用5%的脱脂奶粉进行封闭,然后分别用相应的一抗、二抗对PVDF膜进行孵育,充分洗涤后加入ECL底物显色液,采用凝胶成像系统进行曝光。采用ImageJ测定Control-mimic组与miR-129-mimic组中Twist1蛋白的灰度值并统计表达差异。
1.4 统计学方法
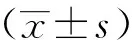
2 结果
2.1 miR-129的表达水平检测
相比于Control-mimic组,miR-129-mimic组SKBR3细胞和AU565细胞中miR-129的表达水平显著上调(t=3.45、3.21,P<0.05),见图1。
2.2 miR-129-mimic抑制乳腺癌细胞的增殖
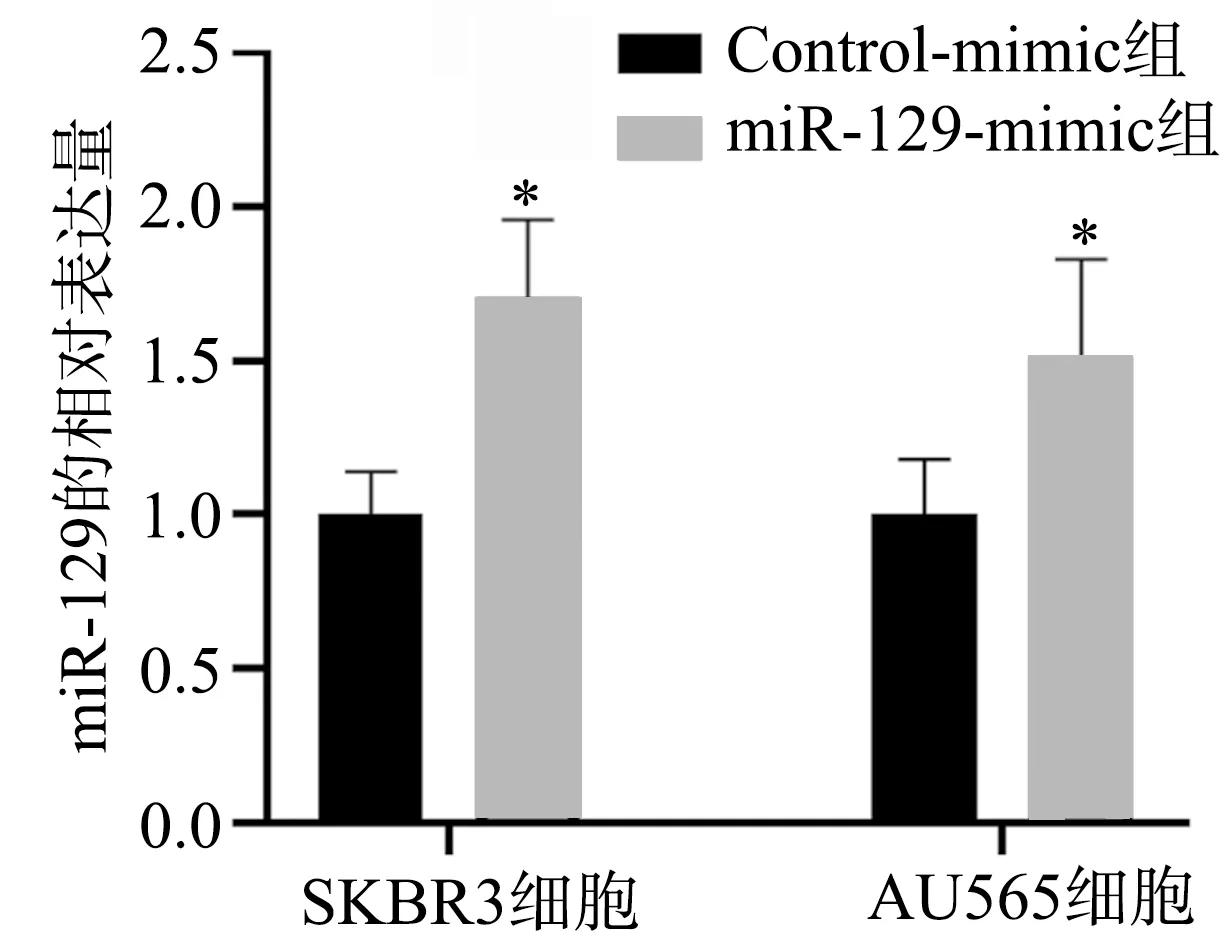
SKBR3和AU565细胞中转染miR-129-mimic后,miR-129-mimic组细胞的增殖能力显著低于Control-mimic组(P<0.01);miR-129-mimic+miR-mimic-shRNA组逆转了miR-129-mimic导致的细胞增殖能力降低(P<0.01),但与Control-mimic组相比,其增殖能力无明显变化(P>0.05),见图2。
2.3 miR-129-mimic抑制乳腺癌细胞迁移及侵袭
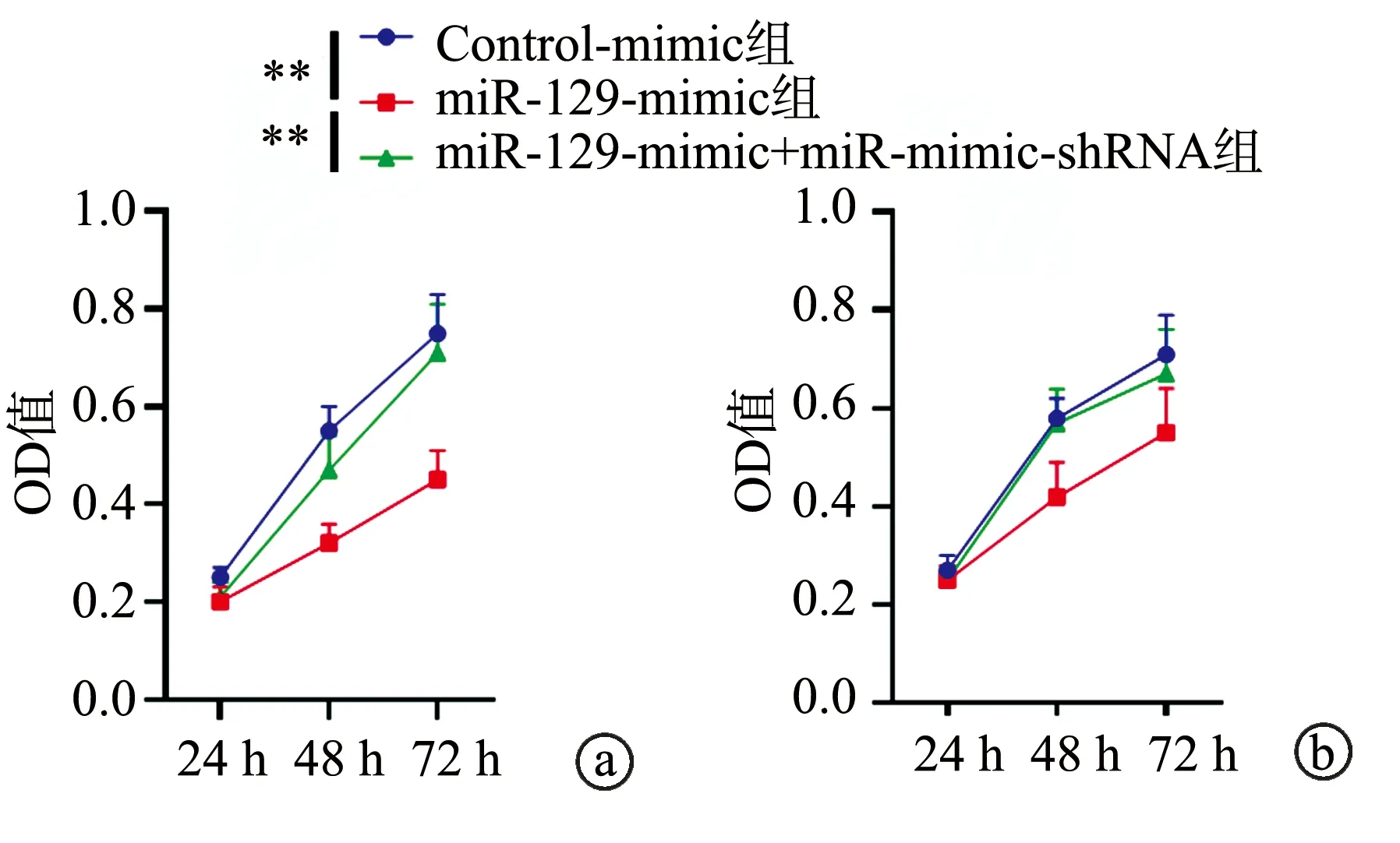
与Control-mimic组比较,miR-129-mimic组中SKBR3和AU565细胞的迁移及侵袭能力明显下降,差异具有统计学意义(P<0.05),提示miR-129具有抑制乳腺癌细胞侵袭及迁移的作用,见图3。
*:与Control-mimic组比较,P<0.05
a:SKBR3细胞增殖能力;b:AU565细胞增殖能力 **:与miR-129-mimic组比较,P<0.01
a:细胞迁移实验结果;b:细胞侵袭实验结果 *:与Control-mimic组比较,P<0.05;**:与Control-mimic组比较,P<0.01
2.4 miR-129靶向调控Twist1
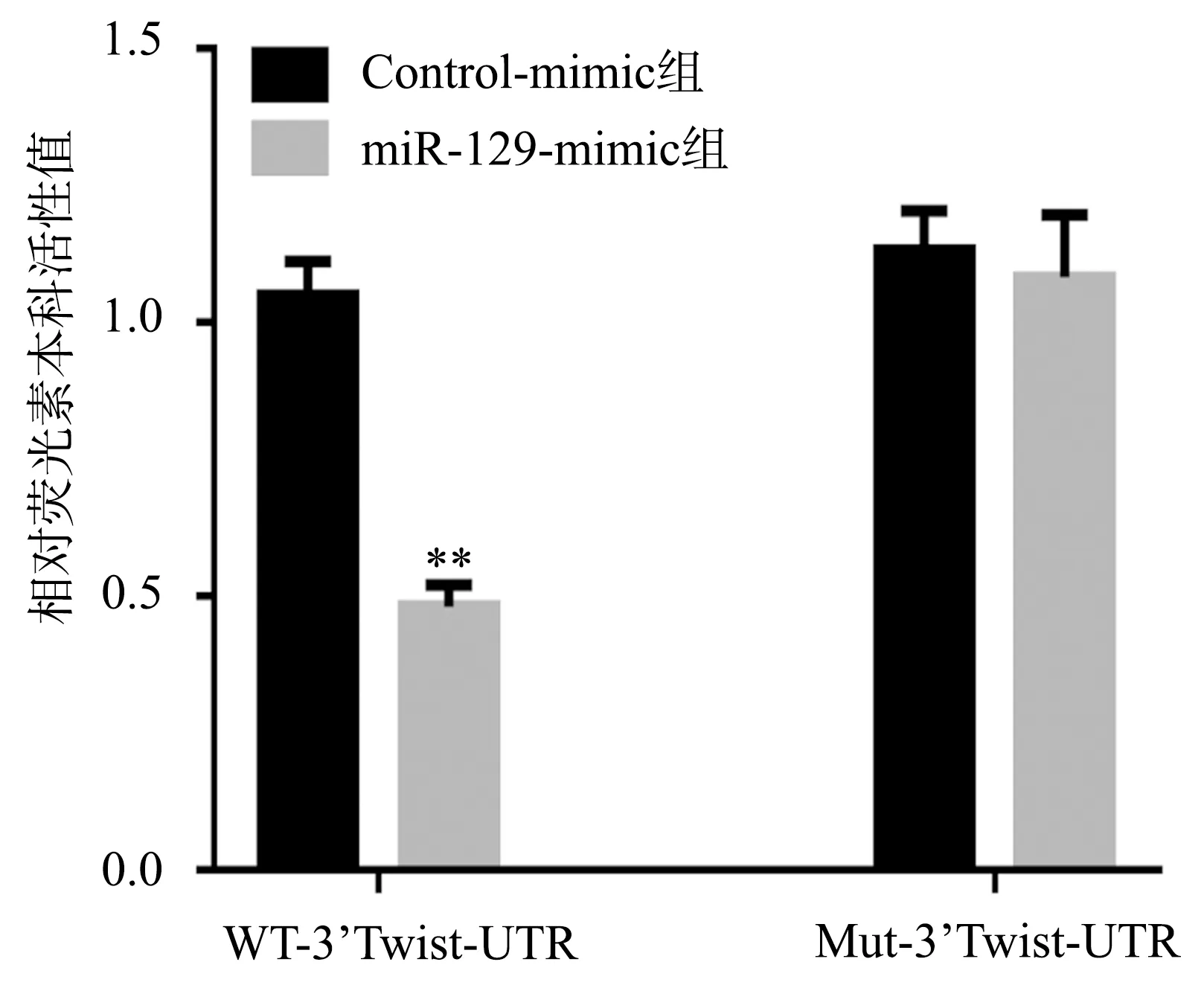
生物信息学软件分析显示,miR-129与Twist1的3’-UTR端有互补结合位点,见图4。双荧光素酶试验结果显示,miR-129-mimic组中WT-3’Twist-UTR的荧光素酶活性明显低于Control-mimic组(P<0.01);而miR-129-mimic组中Mut-3’Twist-UTR的荧光素酶活性与Control-mimic组比较,差异无统计学意义(P>0.05),见图5。
2.5 上调miR-129对Twist1蛋白的影响
在SKBR3、AU565细胞中,与Control-mimic组比较,miR-129-mimic组SKBR3细胞和AU565细胞中Twist1蛋白水平下降,差异具有统计学意义(P<0.01),见图6。
**:与Control-mimic组比较,P<0.01
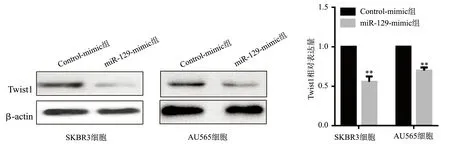
**:与Control-mimic组比较,P<0.01
3 讨论
我国乳腺癌患者约占全球乳腺癌患者的12%[6]。乳腺癌侵袭性强、恶性程度高,并且其组织学异质性大,患者预后往往不够理想[7]。随着分子生物学的不断发展,基因治疗成为了乳腺癌治疗的新方向[8]。但乳腺癌的发生、发展受多种分子机制的影响,因此,研究乳腺癌的发病机制对其治疗具有重要意义。
miRNAs是一类长度为20~24个核苷酸的非编码RNA,通过与内源性mRNA碱基配对抑制靶基因的表达来发挥其生物学功能,进而影响肿瘤的发生、发展[9]。miR-129为一种常见的miRNAs,可影响炎症因子及血管上皮细胞的生成,且对肿瘤细胞增殖、迁移、侵袭等过程均具有一定的调控作用[10]。有研究表明miR-129在膀胱癌、肝细胞癌及甲状腺癌中呈低表达[11]。本研究中miR-129-mimic组SKBR3和AU565细胞D的增殖能力明显低于Control-mimic组,说明miR-129在一定程度上能够抑制乳腺癌细胞的增殖。
细胞的迁移与侵袭是影响恶性肿瘤患者预后的关键,出现肿瘤细胞迁移的乳腺癌患者往往具有较高的耐药性,治疗较为复杂,生存期短。肿瘤细胞的迁移、侵袭与上皮—间质转化密切相关,会导致肿瘤细胞失去极性,表现出一定的迁移性,进而侵袭正常组织[12-14]。贺炳胜等[15]研究表明,miR-129能够在一定程度抑制乳腺癌细胞的迁移及侵袭,进而抑制病情的进展,延长患者的生存期。本研究结果显示,miR-129-mimic能够使人乳腺癌细胞SKBR3、AU565的迁移及侵袭能力明显下降,说明miR-129在一定程度上能够抑制乳腺癌细胞的迁移、侵袭,对肿瘤的发展起到一定的调控作用。
研究表明miR-129对乳腺癌存在多种调控途径。miR-129可通过调控Notch信号通路影响乳腺癌肿瘤干细胞自我更新的能力,也可靶向CAMK2N1干预乳腺癌细胞增殖[16-17]。但miR-129对乳腺癌迁移与侵袭的作用机制尚不明确,且其靶点尚未发现。本研究通过生物信息学方法证实了miR-129与Twist1的3’-UTR端有互补结合位点,且miR-129中Twist1的荧光素酶活性明显下降;进一步通过Western blot检测发现,转染了miR-129-mimic的SKBR3和AU565细胞中Twist1表达水平降低。因此推测miR-129通过靶向调节Twist1发挥生物学作用。
综上所述,miR-129与乳腺癌的发生、发展密切相关,其能够在一定程度上靶向调节Twist1进而影响肿瘤细胞的增殖、迁移及侵袭,是乳腺癌诊断及治疗的潜在靶点。

