血清外泌体miR-575与ER阳性乳腺癌患者他莫昔芬辅助治疗预后的相关性研究
林 蝶,林传忠,李 凡
(1.上海中医药大学博鳌国际医院药剂科,海南 琼海 571400;2.海南医学院第二附属医院胸外科,海南 海口 570311)
乳腺癌是我国女性癌症死亡的主要原因之一[1]。他莫昔芬属于雌激素受体(estrogen receptor,ER)的拮抗剂,近30年来一直是ER阳性乳腺癌患者的主要辅助治疗药物[2],然而大部分患者在初期治疗成功后会产生耐药性,这对于临床治疗是一个巨大的挑战[3-4]。目前,他莫西芬的耐药机制仍未明确,但有研究结果显示异常表达的miRNAs在他莫昔芬抵抗中发挥重要作用[5]。Liu等[6]证实在获得性他莫昔芬抗性的ER阳性乳腺癌细胞中,miR-575表达上调,并通过靶向细胞周期蛋白依赖性激酶抑制剂1B(cyclin-dependent kinase inhibitor 1B,CDKN1B)和乳腺癌易感蛋白1(breast cancer susceptibility protein 1,BRAC1)抑制肿瘤干细胞表型和他莫昔芬抗性;进一步的分子机制研究亦表明,ERα以E2依赖性方式反式激活miR-575表达,而CDKN1B和BRCA1则通过抑制细胞周期蛋白D1和ER之间的相互作用来拮抗ER活性,因此作者推断靶向miR-575有望成为逆转或阻止他莫昔芬耐药的潜在策略。为了证实该推断,本研究拟基于临床样本探讨miR-575与他莫昔芬辅助内分泌治疗后ER阳性乳腺癌患者预后的相关性,以期为临床ER阳性乳腺癌患者他莫昔芬耐药的预防及治疗提供参考。
1 资料与方法
1.1 生物信息学分析
从Broad Institute’s GDAC Firehose数据库中下载乳腺癌队列的临床数据和microRNA表达数据。在TCGA数据集中,共753例患者既有miR-575的表达数据,也有存活随访数据,中位随访时间为26.02个月(0~216.6个月)。在METABRIC数据库中,共有1 283例患者既有miR-575的表达数据,也有存活随访数据,中位随访时间为118.13个月(0~355.2个月)。生物信息学分析miR-575在乳腺癌组织中的表达情况及其与患者预后的关系。
1.2 临床资料
收集2015年1月至2016年4月在上海中医药大学博鳌国际医院接受他莫昔芬辅助内分泌治疗的162例ER阳性乳腺癌患者(年龄18~53岁)的血液样本作为观察组。纳入标准:绝经前女性;经病理组织学证实为原发性乳腺癌,且免疫组化结果证实为ER阳性;行乳房切除术;完成化疗或放疗后,经相关检查证实无复发或转移指征;至少接受5年以他莫昔芬为基础的辅助内分泌治疗;患者之间在生物学上无血缘关系。排除标准:近期服用过其他内分泌药物;肝、肾严重损伤或合并严重心脑血管疾病。另外按照1∶1比例收集年龄与观察组相匹配(年龄18~53岁)的165例非癌志愿者的血液样本作为对照组。本研究已获得上海中医药大学博鳌国际医院医学伦理委员会的批准,所有参与者对本研究知情同意。
1.3 样本采集
在辅助内分泌治疗前收集血液样本,置于含有乙二胺四乙酸二钾的采血管中。全血标本在室温下静置15 min,凝固后以3 000 r/min 离心10 min,分离血清,于-80 ℃保存备用。另外收集观察组患者术中新鲜肿瘤组织样本,置于液氮中24 h后,于-80 ℃保存备用。
1.4 血清外泌体的提取和鉴定
通过超速梯度离心法从血清样本中分离获取外泌体:使用外泌体分离试剂,以6 000 r/min去除细胞碎片30 min;将样本转移至新鲜试管中,4 ℃环境下用沉淀液沉淀外泌体颗粒;以12 000 r/min 离心35 min,然后用0.22 μm滤器过滤,再以120 000 r/min超速离心2 h,获得纯化的外泌体颗粒。将分离的外泌体颗粒固定在2.5%戊二醛溶液中至少2 h。然后转移至干净的铜网上,用2%磷钨酸染色后置于透射电镜下获得图像。Western blot法检测外泌体标志蛋白表达水平,小鼠抗人初级抗体购自美国CST公司,CD63、CD9、TSG101按1∶1 000稀释。
1.5 实时荧光定量PCR法检测miR-575表达水平
按照Trizol试剂(invitrogen,美国)说明书进行血清外泌体和组织样本总RNA的抽提,取总RNA溶液吸光度(A260 nm/A280 nm)为1.8~2.1、浓度为 25 ~50 ng/mL的样本,于-80 ℃保存。按照逆转录试剂盒说明书(TaKaRa,日本)将RNA逆转录为cDNA,并于-20 ℃保存。按照荧光定量PCR试剂盒说明书(TaKaRa,日本)进行PCR反应(miR-575及内参U6引物设计及合成由广州锐博公司完成),反应条件为95 ℃ 10 s,60 ℃ 33 s,共40个循环。用2-ΔΔCt法以U6为内参计算miR-575的相对表达水平。
1.6 随访及疗效评价
ER阳性乳腺癌患者术后口服他莫昔芬治疗至少持续5年,按照WHO制定的统一标准评估疗效。所有患者在前2年每3个月随访1次,在第3年每6个月随访1次,之后每年随访1次直至死亡或截至2021年6月。按照实体瘤疗效评价标准评估临床疗效,获得完全缓解、部分缓解和疾病稳定的患者视为他莫昔芬敏感,出现疾病进展的患者视为他莫昔芬耐药。根据患者对他莫昔芬的耐药情况将其分为抵抗组和敏感组,分析血清外泌体miR-575表达水平与术后疾病进展的关系。根据影像学证据,定义任何可测量的病灶维度增加超过25%,或经活检证实患侧乳腺、胸壁或远处器官出现新的病灶,或患侧/非患侧所属区域出现肿大淋巴结为疾病进展。
1.7 统计学处理
利用SPSS 19.0统计软件分析数据,对miR-575相对表达量进行正态性检验,结果不符合正态分布,因此以中位数(四分位数)表示,进行非参数检验,检验水准为α=0.05。绘制Kaplan-Meier生存曲线,并进行LogRank检验。采用单因素和多因素Cox回归模型分析影响ER阳性乳腺癌患者他莫昔芬治疗预后的临床因素。绘制受试者工作特征(receiveroperatingcharacteristic,ROC)曲线,计算曲线下面积(areaunderthecurve,AUC)。
2 结果
2.1 生物信息学分析
生物信息学结果显示,在TCGA数据库和GSE45666队列中,miR-575在乳腺癌组织中的表达水平明显高于正常乳腺组织(P<0.001),见图1a。在所有类型乳腺癌或ER阳性乳腺癌患者中,miR-575的表达水平升高与Nottingham病理学分级较高有关(P<0.001),而这一结果在HER阳性或三阴性乳腺癌患者组织中并未得到证实(P>0.05),图1b。通过Kaplan-MeierPlotter在线软件比较不同miR-575表达水平的乳腺癌患者的总体生存率,对于所有类型乳腺癌患者或ER阳性患者,miR-575高表达的患者其预后明显差于miR-575低表达的患者(P<0.05),而对于ER阴性患者,miR-575表达水平与预后则无显著关联(P>0.05),图1c。
2.2 血清外泌体的鉴定
从血清样本中分离得到外泌体颗粒,通过透射电镜和特异性蛋白标记物CD63、TSG101进行鉴定,外泌体囊泡呈圆形或椭圆形,粒径为80~120 nm;纳米颗粒跟踪分析显示,囊泡的平均大小为100 nm,密度约为2.5×107/mL;外泌体蛋白标志物CD63、CD9、TSG101呈阳性表达(图2)。
2.3 观察组和对照组血清外泌体miR-575表达差异
经实时荧光定量PCR法检测,观察组患者血清外泌体miR-575相对表达水平高于对照组[1.834(1.168,2.519)vs.1.003(0.901,1.217),Z=-8.871,P<0.001]。观察组患者血清外泌体与乳腺癌组织miR-575相对表达水平呈正相关(rs=0.726,P<0.001),见图3。
2.4 观察组患者血清外泌体miR-575表达水平与术后疾病进展的关系
随访5年,110例患者对他莫昔芬耐药,纳入抵抗组,52例患者对他莫昔芬敏感,纳入敏感组。抵抗组血清外泌体miR-575相对表达水平明显高于敏感组[2.097(1.700,3.163)vs.1.168(0.947,1.524),Z=-7.164,P<0.001]。根据血清外泌体miR-575相对表达水平将患者分为高表达组(>中位值1.834)和低表达组(≤中位值1.834),绘制Kaplan-Meier曲线,高表达组患者中位疾病进展时间为36.0个月(6.0~57.0个月),短于低表达组的51.0个月(18.0~60.0个月)(χ2=14.267,P<0.001),见图4。
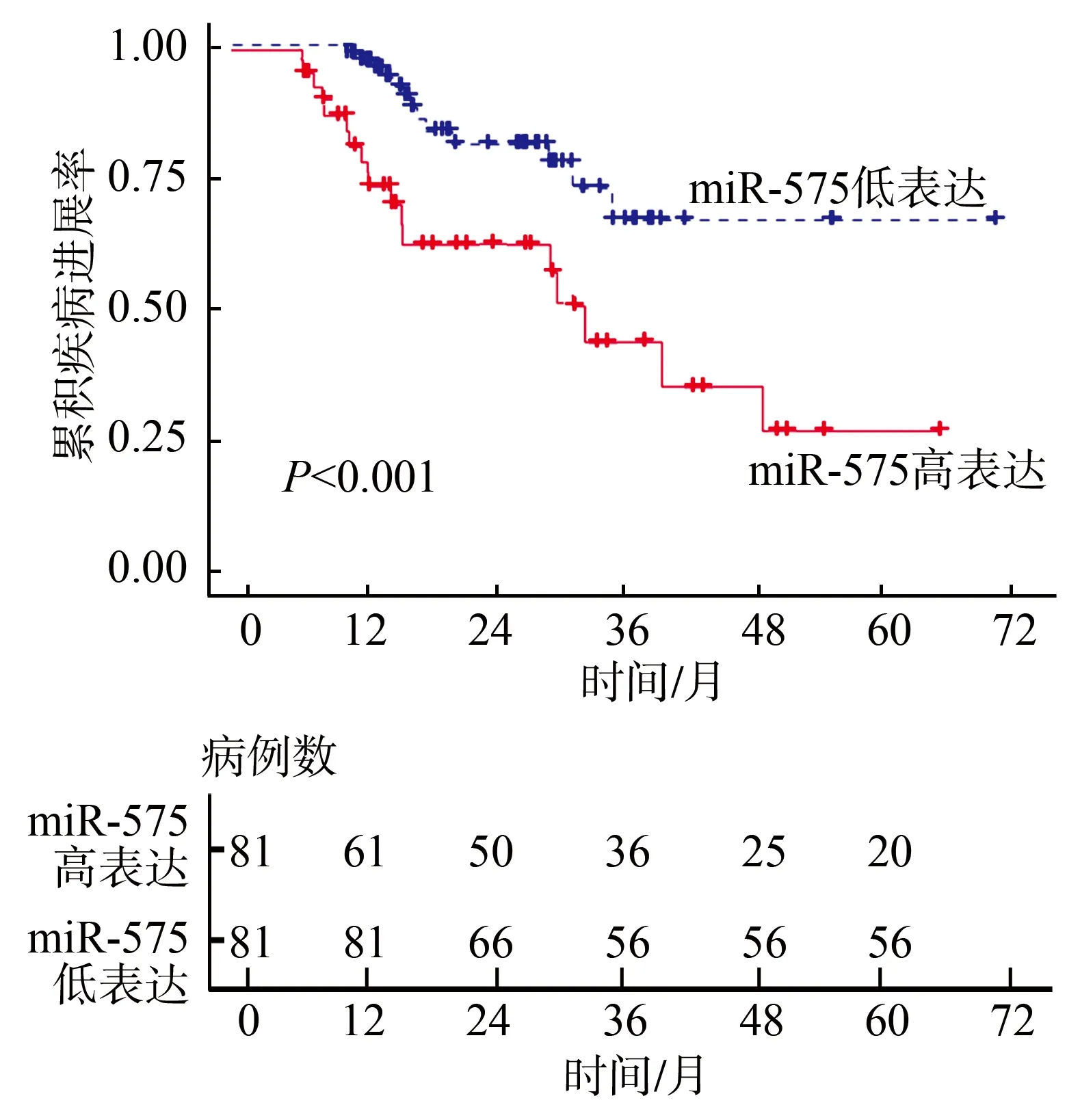
图4 Kaplan-Meier曲线
2.5 单因素和多因素Cox回归分析
经分析,TNM分期为Ⅲ/Ⅳ期、HER2阳性表达以及血清外泌体miR-575高表达均是ER阳性乳腺癌患者接受他莫昔芬辅助内分泌治疗预后不良的独立危险因素(P<0.05),见表1。
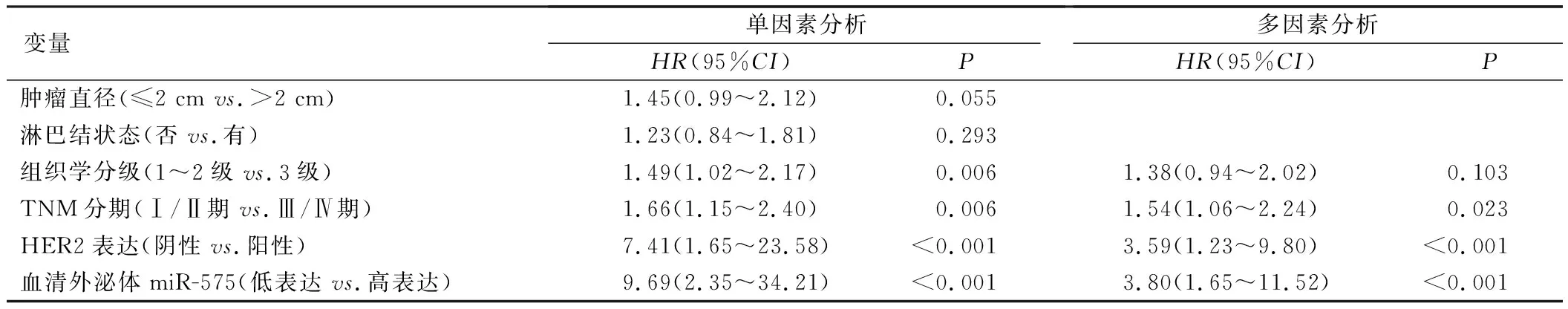
表1 单因素和多因素Cox回归分析影响ER阳性乳腺癌患者他莫昔芬治疗预后的临床因素
2.6 ROC曲线分析
对于观察组患者,血清外泌体miR-575表达水平预测5年疾病进展的AUC为0.850(95%CI:0.789~0.910),Cut-off值为1.622,在该阈值下,灵敏度和特异度分别为78.8%和82.7%,见图5。
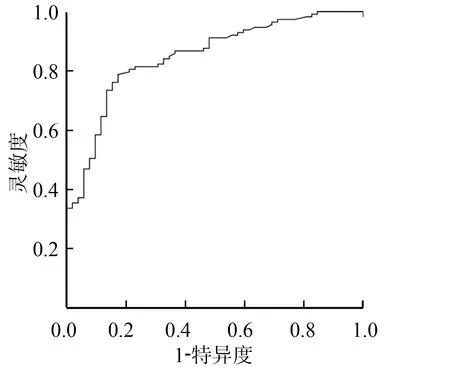
图5 ROC曲线
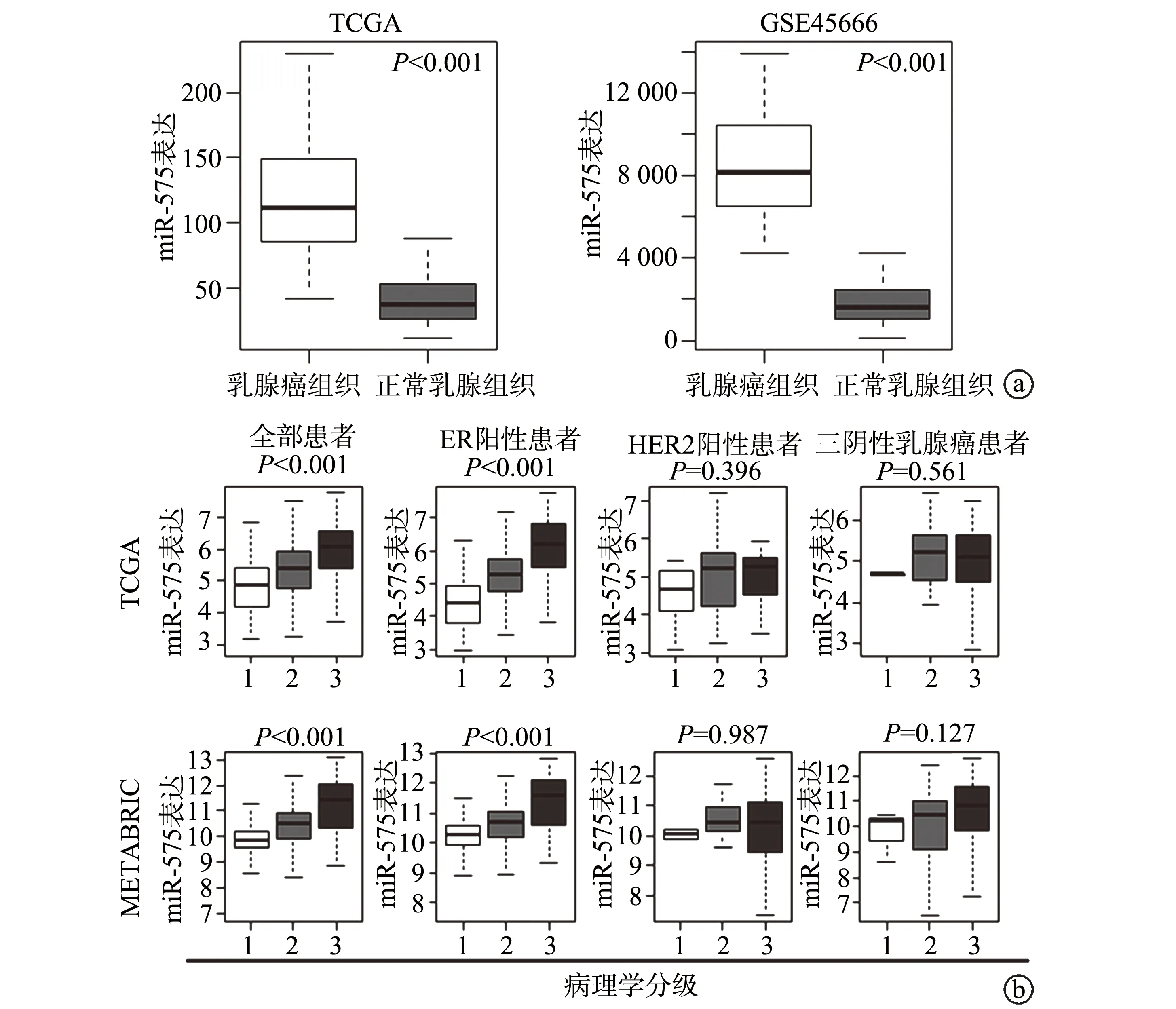
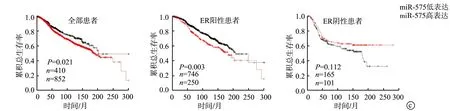
a:TCGA队列(乳腺癌组织:n=87;正常乳腺组织:n=87)和GSE45666队列(乳腺癌组织:n=101;正常乳腺组织:n=15)分析;b:miR-575表达水平与Nottingham病理分级的关系;c:Kaplan-Meier分析不同miR-575表达水平患者的总生存率
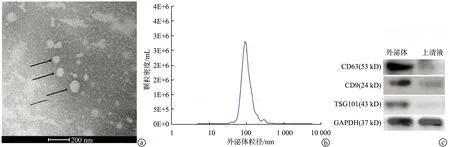
a:透射电镜下观察(黑色箭头:外泌体颗粒);b:纳米颗粒跟踪分析;c:Western blot检测蛋白表达
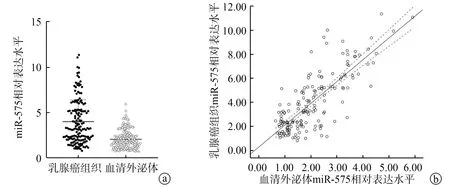
a:血清外泌体和乳腺癌组织中miR-575的表达;b:血清外泌体与乳腺癌组织miR-575表达的相关性
3 讨论
乳腺癌内分泌治疗无论是作为术后预防复发转移的辅助治疗,还是复发转移后的解救治疗都有十分重要的意义[7]。众所周知,雌激素具有促进乳腺肿瘤形成和增殖的能力,通过ERα信号通路抑制雌激素促肿瘤作用是他莫昔芬等靶向疗法成功的原因[8-9]。尽管这些疗法有效,但大约50%的ER阳性乳腺癌患者表现出新生耐药性[10],导致肿瘤复发和治疗失败,因此若要改善ER阳性乳腺癌患者的预后,降低耐药性仍然是一个重大的临床挑战。
miRNAs是近年来发现的长度约为22 nt的内源性短链RNA,其不编码蛋白质,可通过与编码蛋白质的mRNA互补结合,诱导翻译抑制或转录降解,从而调控细胞分化、生长、增殖、代谢、凋亡等[11]。miRNAs作为最有前景的用于液体活组织检查的标志物之一,有助于疾病早期检测,这对于癌症的及时发现具有重要意义。有报道称miRNAs可通过直接与ESR1 mRNA的3’ UTR结合来抑制ERα的表达,使雌激素/ERα靶向治疗产生耐药性;反之,雌激素/ERα激活可以调节miRNAs的表达,这可能促进ER阳性乳腺癌的发生[12]。因此,靶向调控特定miRNAs逐渐成为治疗ER阳性乳腺癌的一种有效策略,并能够显著提高患者对内分泌治疗的敏感性。miR-575是位于4q21.22位点的miRNAs,于2009年被首次报道,因其在包括癌症在内的不同类型疾病中发挥重要作用而备受关注[13]。Wang等[14]的研究表明,bh3样含基序蛋白是miR-575非小细胞肺癌发生的直接靶点,并且其在肺癌的发展过程中具有关键作用。Qin等[15]发现miR-575在胆囊癌患者的肿瘤组织中显著过表达,其下调可通过靶向p27Kip1显著抑制胆囊癌的发生。以上研究均说明miR-575作为促癌因子参与了癌症的发生和发展。Liu等[6]分析了20个原发性乳腺癌组织样品和不同乳腺癌细胞中miR-575的表达情况,结果发现在大多数ER阳性乳腺癌组织和细胞中miR-575表达上调,这与雌激素/ERα可上调miR-575表达有关;经过进一步研究发现,CDKN1B/p27和BRCA1是miR-575的下游靶点。BRCA1是抑制雌激素诱导的ER信号转导并阻断转录活性的重要因子,而CDKN1B通过抑制核移位和Cyclin D1相互作用拮抗ER活性,因此CDKN1B/p27和BRCA1可能是阻止ER进入细胞核转录miR-575表达的原因,这为本研究提供了基础分子机制支持。本研究首先通过生物信息学分析发现,miR-575在乳腺癌组织中的表达水平明显高于正常乳腺组织,在ER阳性患者中,miR-575的表达水平升高与Nottingham病理学分级较高和预后不良有关;进一步通过实时荧光定量PCR法实验发现,ER阳性乳腺癌患者血清外泌体miR-575相对表达水平高于非癌对照人群;同时,Kaplan-Meier曲线、Cox回归分析以及ROC曲线等方法证实,血清外泌体miR-575高表达是ER阳性乳腺癌患者接受他莫昔芬辅助内分泌治疗预后不良的独立危险因素。
综上,本研究发现治疗前血清外泌体miR-575表达水平较高的ER阳性乳腺癌患者经他莫昔芬治疗5年内疾病进展风险较高,且预后不良。因此,治疗前血清外泌体miR-575表达水平可作为预测ER阳性乳腺癌患者他莫昔芬敏感性的一个重要参考指标,有望成为生物学治疗的重要靶点,可为ER阳性乳腺癌患者制订合理、合适的治疗方案提供新的理论支持,对延长患者的生存期及提高患者生活质量具有重要意义。

