定志益聪颗粒对血管性痴呆大鼠认知功能的改善作用及其机制
从琳 杨秀娟 王栩 杨元庆 张智龙
(1天津中医药大学,天津 301617;2天津市中医药研究院附属医院针灸科)
血管性痴呆(VD)可由脑血管病危险因素、显性脑血管病及非显性脑血管病引起,是血管性认知障碍(VCI)发展至重度的表现〔1〕,以记忆的缺失和高级认知功能障碍为主要临床表现〔2〕。杨元庆等〔3〕以自拟验方定志益聪汤(DZYC)治疗VD,临床效果显著,研究表明,此方可改善VD患者的智能状态、认知功能和日常生活功能,但作用机制尚不明确。
近年发现,双侧颈总动脉永久性闭塞致慢性脑低灌注可引起β-淀粉样肽(Aβ)的沉积〔4,5〕,Aβ又协同增强脑缺血再灌注损伤诱导的tau蛋白磷酸化,导致神经细胞死亡,加重认知障碍〔6〕。糖原合成酶激酶(GSK)-3β可调节Aβ产生;细胞周期素依赖性蛋白激酶(CDK)5与GSK-3β又同为tau蛋白磷酸化的重要蛋白激酶〔7〕。本实验探讨DZYC对VD的治疗是否为通过下调GSK-3β和CDK5的表达,进而减少了Aβ1~42和磷酸化tau蛋白的沉积。
1 材料与方法
1.1实验动物 雄性SPF级SD大鼠62只,体质量(240±10)g,购于北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2016-0006。饲养于中国医学科学院放射医学研究所动物中心,使用许可证号SYXK(津)2019-0002,实验动物伦理审查批准编号TCM-LAEC2019017。饲养环境12 h自然昼夜节律,温度(23±2)℃,相对湿度(55±15)%。予大鼠标准饲料和饮用水,自由进食/水。
1.2药物 DZYC组成:党参15 g、茯苓20 g、石菖蒲20 g、远志20 g、女贞子15 g、枸杞子15 g、益智仁30 g、熟地黄20 g、当归20 g、赤芍15 g、川芎15 g、桃仁10 g、红花10 g。上述药物购于天津市中医药研究院附属医院,由天津市医药科学研究所制剂中心制备为颗粒剂,每1 g颗粒相当于2.31 g生药。盐酸多奈哌齐(规格5 mg/片,卫材中国药业有限公司,国药准字H20050978)。
1.3主要试剂 放射性免疫沉淀法(RIPA)裂解液(P0013B)、二喹啉甲酸(BCA)蛋白浓度测定试剂盒(P0010S)购于上海碧云天生物技术有限公司;孔径0.22 μm聚偏氟乙烯(PVDF)膜(ISEQ15150)、孔径0.45 μm PVDF膜(IPVH00010)购于美国Millipore公司;5 mg/ml牛血清白蛋白(BSA)(G3522)购于广州捷倍斯生物科技有限公司;小鼠抗Gsk-3β抗体(ab93926)、兔抗CDK5抗体(ab40773)购于英国Abcam公司;兔抗Aβ1~42抗体(bs-0107R)购于北京博奥森生物技术有限公司;兔抗P-tauS202抗体(BA1759)、兔抗P-tauS396抗体(BM4496)、兔抗P-tauT231抗体(BM4464)、辣根过氧化物酶(HRP)标记羊抗小鼠IgG抗体(BA1050)、HRP标记羊抗兔IgG抗体(BA1054)购于武汉博士德生物工程有限公司;免疫显色试剂(Dako-K5007)购于美国Agilent Technologies公司。
1.4主要仪器设备 ZS-001型Morris水迷宫(MWM)视频分析系统(北京众实迪创科技发展有限责任公司);BX53型生物显微镜(日本Olympus);Legend Micro21R型冷冻高速离心机,vario skan LUX型多功能酶标仪(美国Thermo Fisher);DYY-7C型电泳仪电源,DYCZ-24DN型垂直电泳槽,DYCZ-40型电转仪(北京六一仪器厂);JT-12J型电脑生物组织脱水机,JK-6型生物组织摊烤片机(武汉俊杰电子有限公司)等。
1.5模型制作 大鼠适应性饲养3 d后,以MWM定位航行试验剔除逃避潜伏期数值极值大鼠2只,保证实验大鼠智能无明显差异。参考Wakita等〔8〕方法,通过双侧颈总动脉永久性闭塞法制作VD模型40只。大鼠术前12 h禁食,麻醉后于颈部正中取纵向长约1.5 cm切口,钝性游离双侧颈总动脉并结扎;假手术方法同造模方法,但只分离颈总动脉,不结扎。术后以硫酸庆大霉素局部滴注抗感染3 d。造模后第50~55天以MWM定位航行试验筛选成模大鼠,以假手术组大鼠的逃避潜伏期均值为参考值,计算各造模大鼠的平均逃避潜伏期与参考值之差占该鼠平均逃避潜伏期的比例,该值>20%者判定为造模成功〔9〕。术后死亡大鼠9只,未成模大鼠1只。
1.6分组与给药 随机将大鼠分为正常组10只,假手术组10只;30只成模大鼠分为模型组、多奈哌齐组、DZYC组各10只。DZYC组剂量5 g/kg;多奈哌齐组剂量2.6×10-4g/kg(相当于人体用量5 mg/d);正常组、假手术组、模型组予等量生理盐水。自造模后第56天灌胃给药,1次/d,连续30 d。
1.7MWM行为学测试评价认知功能 干预结束后,次日开始MWM行为学测试,共计7 d。前6 d为定位航行试验,考察大鼠的空间学习能力;第7天为空间探索试验,考察大鼠的空间记忆能力。将一金属圆柱体设于水下约1.5 cm,置于第Ⅰ象限作为隐蔽平台。设逃避潜伏期为90 s,若90 s内大鼠搜索到平台并停留5 s,则生成逃避潜伏期;若90 s内大鼠未搜索到平台,则逃避潜伏期为90 s,此时需人为将大鼠引至平台停留10 s,以助其记忆平台位置。前6 d大鼠每日分别从水迷宫两对角象限的缸边入水,行定位航行试验2次;第7天撤掉隐蔽平台,从水迷宫第Ⅲ象限的缸边入水,行空间探索试验,记录90 s内经过隐蔽平台的次数、第Ⅰ象限停留时间、第Ⅰ象限路程。
1.8IHC法检测海马CA1区GSK-3β、CDK5的阳性表达 MWM行为学测试结束后,次日各组随机选5只大鼠麻醉后以4%多聚甲醛(PFA)灌注处死,取脑组织浸泡于4%PFA固定液24 h后,脱水透明、浸蜡包埋,切片备用。切片脱蜡复水后,经抗原修复,3%H2O2阻断内源性过氧化物酶,羊血清室温封闭30 min,加入一抗4℃孵育过夜(GSK-3β为1∶200,CDK5为1∶100)。次日复温后漂洗一抗,加入HRP标记二抗,37℃孵育20 min,漂洗后滴加新鲜配制的DAB显色液,经苏木素复染、脱水透明封片。于400倍光学显微镜下观察各组5只大鼠海马CA1区GSK-3β、CDK5的阳性表达。每张切片于海马CA1区取3个不同视野摄片,统计各图片平均光密度(AOD)值,以Image-Pro Plus6.0软件进行图像分析。
1.9Western印迹法检测海马组织GSK-3β、CDK5、Aβ1~42、P-tauS202、P-tauS396、P-tauT231的表达量 各组另5只大鼠经颈椎脱臼处死,冰盒上钝性分离海马组织,液氮冻存。组织以0.1 g/ml加入RIPA裂解液〔内含1%苯甲基磺酰氟(PMSF)、1%磷酸酯酶抑制剂〕充分裂解40 min,4℃离心5 min(12 000 r/min),取蛋白上清定量,加蛋白上样缓冲液,100 ℃变性10 min,-20℃冻存。配置十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(Aβ1~42用15%分离胶,其余指标用12%分离胶),各泳道蛋白上样40 μg,电泳分离后,电转(电转液不含SDS)至PVDF膜(Aβ1~42用孔径0.22 μm,其余指标用孔径0.45 μm),室温封闭2 h(P-tauS202、P-tauS396、P-tauT231用1% BSA,其余指标用5%脱脂奶粉),加入一抗(GSK-3β为1∶1 000,CDK5为1∶2 000,Aβ1~42、P-tauT231为1∶500,P-tauS202、P-tauS396为1∶300),4℃孵育过夜。次日复温后漂洗一抗,加入HRP标记二抗,37℃孵育2 h后漂洗,曝光显色。以目的蛋白灰度值/内参蛋白GAPDH灰度值测定目的蛋白在各样品的相对含量。
1.10统计学方法 采用SPSS25.0软件进行方差分析、Kruskal-WallisH秩和检验。
2 结 果
2.1各组大鼠MWM行为学测试结果 在6 d的定位航行试验中,各组大鼠的平均速度,组间差异无统计学意义(P>0.05)。在第1、2天的定位航行试验中,各组大鼠的逃避潜伏期,组间差异无统计学意义(P>0.05)。在随后4 d的定位航行试验中,各组大鼠的逃避潜伏期均呈逐渐下降趋势。经repeated measure ANOVA检验,逃避潜伏期与时间有交互。简单效应分析发现:模型组大鼠与空白组、假手术组比较,差异有统计学意义(P<0.05);多奈哌齐组、DZYC组大鼠与模型组比较,差异无统计学意义(P>0.05)。但在第5、6天的定位航行试验中,多奈哌齐组、DZYC组大鼠的逃避潜伏期较模型组明显缩短(P<0.05),DZYC组与多奈哌齐组之间,差异无统计学意义(P>0.05)。空间探索试验中的经过平台次数、第Ⅰ象限停留时间、第Ⅰ象限路程,组间差异均有统计学意义(均P<0.001)。与正常组、假手术组大鼠比较,模型组的经过平台次数、第Ⅰ象限停留时间、第Ⅰ象限路程减少(P<0.05);与模型组大鼠比较,多奈哌齐组、DZYC组的经过平台次数、第Ⅰ象限停留时间、第Ⅰ象限路程增加(P<0.05);DZYC组与多奈哌齐组之间,差异无统计学意义(P>0.05)。见表1。

2.2各组大鼠海马CA1区GSK-3β、CDK5的阳性表达 与正常组、假手术组大鼠比较,模型组海马CA1区GSK-3β的阳性表达明显增多(P<0.05);与模型组大鼠比较,多奈哌齐组、DZYC组的GSK-3β阳性表达减少(P<0.05);DZYC组与多奈哌齐组之间,差异无统计学意义(P>0.05)。而各组大鼠海马CA1区CDK5阳性表达,组间差异无统计学意义(P>0.05)。见表2和图1、图2。

表2 各组大鼠海马CA1区GSK-3β、CDK5的阳性表达

图1 各组大鼠海马CA1区GSK-3β的阳性表达(IHC,×400)
2.3各组大鼠海马组织GSK-3β、CDK5、Aβ1~42及磷酸化tau蛋白的表达量 与正常组、假手术组大鼠比较,模型组海马组织GSK-3β、Aβ1~42、P-tauS 396、P-tauT231的表达量明显增高(P<0.05);与模型组比较,多奈哌齐组、DZYC组GSK-3β、Aβ1~42、P-tauT231的表达量明显降低,多奈哌齐组P-tauS396的表达量明显降低(均P<0.05)。DZYC组与多奈哌齐组之间,差异无统计学意义(P>0.05)。而各组大鼠海马组织CDK5、P-tauS202的表达量,组间差异无统计学意义(P>0.05)。见表3、图3。
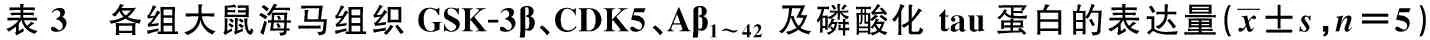
1~5:正常组,假手术组,模型组,多奈哌齐组,DZYC组
3 讨 论
作为继阿尔茨海默病(AD)之后的第二大痴呆类型〔10~14〕,VD现今患病人数已占痴呆总患者的15%~20%〔15〕,其治疗形势严峻,不容小觑。
迄今为止,VD的发病机制尚不十分明确。目前发现其可能的发病机制〔16~18〕主要为胆碱能系统损伤、兴奋性氨基酸毒性作用、氧化应激反应、炎性反应、神经细胞凋亡、Aβ和tau蛋白沉积、遗传机制等。临床药物治疗主要为胆碱酯酶抑制剂、兴奋性氨基酸受体拮抗剂等〔19〕,但存在一定的不良反应〔20,21〕。近年发现,某些中药单药与复方制剂可通过靶向VD的可能发病机制而改善血管性认知功能〔22〕,中草药或为治疗VD的潜在药物〔23〕。如细叶远志皂苷可上调胆碱乙酰转移酶的表达〔24〕;当归小分子多糖能够抑制Tau蛋白的表达〔25〕;黄芩苷可以抑制脑组织中Aβ的形成和小胶质细胞的活化〔26〕等。
Aβ的沉积和tau蛋白过度磷酸化是VD和AD的共性病理机制之一〔27〕。GSK-3β和CDK5在生成Aβ和磷酸化tau蛋白的过程中具有重要作用,二者既有共性,又有不同。GSK3和CDK5是脑内调节tau蛋白磷酸化的最重要的蛋白激酶〔28〕。研究发现,GSK-3β和CDK5可磷酸化相同位点的tau蛋白〔29〕,如本实验中的Ser396、Thr231位点。此外,GSK-3β参与β-淀粉样前体蛋白的代谢、调节产生Aβ〔30〕。Aβ1~42是Aβ中最常见的单异构体亚型之一,由于其疏水性较强,能够形成不溶性的聚集体,故因难以清除而更易聚集沉积〔31〕。CDK5可使tau蛋白在Ser202位点发生磷酸化〔32〕,但其基础活性较低,需要被激活以磷酸化tau蛋白〔33〕。异常磷酸化的tau蛋白可促进Aβ的沉积,同时Aβ又可活化GSK-3β、CDK5而诱导tau蛋白的异常磷酸化〔34〕,如此往复而成恶性循环。最终,Aβ在神经细胞外沉积形成老年斑,过度磷酸化的tau蛋白在神经细胞内形成神经纤维缠结,二者共同参与缺血后海马神经元的损害,并导致认知功能的障碍。
VD属于中医学“痴呆”“呆病”范畴。张智龙〔35〕善于治疗脑血管疾病,认为:脑为髓之海,非养不满,脑病易虚,非养不实;脑为元神之府,非清不静,脑病易闭,非清不开。故脑病易虚易闭,治疗需牢记“清”“养”二字。根据多年临床经验,总结治疗VD的理法方药:VD病位在脑,与肾密切相关。临床以虚实夹杂者为多见,虚者因肾精不足,脑髓空虚;实者由痰浊蒙窍,瘀阻脑络;以本虚标实、脑髓空虚、痰瘀闭阻、神机失用为病机关键。治疗需养精益髓、清浊开闭以达调理神机之功,自拟DZYC为治疗VD的基础方。方中党参、茯苓,性平味甘,健脾补中而宁心安神。菖蒲、远志,苦、辛而温,善治痰浊蒙窍之证。女贞子甘凉、枸杞子甘平、益智仁辛温,三味兼顾肾阴肾阳,补肾而养精益髓。熟地黄甘而微温,补肝肾而生精补髓;当归辛甘、苦温,善治一切血虚血滞之证;赤芍苦而微寒,善治血分有热有瘀之证;川芎辛温,行气以活血;桃仁甘平、质润,破血逐瘀;红花辛散、温通,活血通经,六药合用为桃红四物汤,重在活血化瘀,养血生精。全方攻补兼施、升降相因、寒温并用,药性平和,符合方剂三要素;同时直应VD之关键病机。
海马是大脑中负责学习和记忆的主要区域,与记忆和空间导航密切相关〔36〕,海马CA1区在空间导航和记忆巩固方面具有重要作用〔37〕。本实验结果显示,模型组大鼠在MWM行为学检测中表现出空间学习、记忆能力的损伤,而DZYC可提高VD大鼠的空间学习、记忆能力,其疗效与多奈哌齐基本相当。说明DZYC可能通过下调海马组织GSK-3β的表达,进而减少VD大鼠海马组织Aβ1~42、P-tauT231的表达。但本实验中,CDK5、P-tauS202的表达在各组大鼠并无差异,与以往报道〔38,39〕不相一致,考虑或为实验动物的鼠种、鼠龄及实验造模方法不尽相同的原因。Aβ的沉积是Aβ的生成和降解清除共同作用的结果;而Tau蛋白的磷酸化程度又取决于蛋白激酶的磷酸化和蛋白磷酸酯酶的去磷酸化。本实验仅为对DZYC治疗VD作用机制的初步探索,今后的实验研究中,将尝试从Aβ清除的相关因子和蛋白磷酸酯酶的角度共同探索;并扩大样本量,设计回复实验进行验证,以明确DZYC治疗VD的作用机制。
综上,DZYC可能通过下调海马组织GSK-3β的表达,进而减少了海马组织Aβ1~42和P-tauT231的沉积,改善了VD大鼠的认知功能。

