终末期肾脏病持续非卧床腹膜透析患者血清活性维生素D与超敏C反应蛋白、白细胞介素-6和中性粒细胞/淋巴细胞比值的关系
陈孟娴 赵元刚,* 扬 柳 张 春
持续非卧床腹膜透析(Continuous Ambulatory Peritoneal Dialysis, CAPD)是终末期肾脏病(End-Stage Renal Disease, ESRD)患者有效的肾脏替代治疗模式[1]。行CAPD的ESRD患者通常营养不良,矿物质及骨代谢紊乱[2],而炎症状态是心血管病事件的危险因素[3]。活性维生素D(1,25-dihydroxyvitamin D,VitD)具有调节钙磷代谢,减轻炎症反应,延缓肾脏病进展等作用,ESRD患者体内VitD水平常出现进行性下降[4]。作为衡量成人体内维生素D状态的重要指标VitD,以及反映肾脏病患者微炎症状态的常规精确的生化指标高敏C反应蛋白(High Sensitivity C-reactive Protein, hs-CRP)、白细胞介素-6(Interleukin-6, IL-6)和中性粒细胞/淋巴细胞比例(Neutrophil to-lymphocyte Ratio, NLR)[5]在ESRD患者实施CAPD前后,其水平将出现明显改变,且VitD的变化与三种炎性因子水平存在一定关系[6]。本文拟观察ESRD患者CAPD前后血清VitD hs-CRP、IL-6和NLR水平变化及其相关性。
1 资料与方法
1.1 研究对象与分组
选取2018-01—2020-12本院肾脏病透析中心收治接受CAPD的ESRD患者247例,其中男141例,女106例;年龄41-76岁,平均 58.50±9.14岁。依据国际肾脏病协会(Kidney Disease Outcomes and Quality Initiative,KDOQI)临床实践指南[7]对人体血清VitD水平的定义,将纳入患者分为VitD正常组(n=56,VitD>30ng/ml)、VitD不足组(n=80,20ng/ml
1.2 病例纳入和排除标准
纳入标准:(1)接受CAPD治疗,透析龄超过3个月,CAPD治疗期间患者尿素清除指数(Urea Clearance Index, Kt/V)≥1.7,且病情稳定;(2)从行CAPD开始至第3个月未给患者服用活性VitD;(3)临床资料完整。排除标准:(1)近1个月内有各种急慢性活动性感染,3个月内应用激素类药物或免疫抑制剂治疗者;(2)合并活动炎症性疾病、自身免疫性疾病,内分泌紊乱等全身系统性疾病者;(3)罹患恶性肿瘤者;(4)甲状旁腺切除者或精神疾病患者。
1.3 血液标本采集和检测
采集ESRD患者CAPD治疗前和CAPD治疗三个月后(对照组于体检当天),所有纳入受检者均在清晨同一时间段,采集空腹肘正中静脉血,分装于含EDTA-K2加抑肽酶的抗凝试管和含分离胶的促凝试管中,每支试管2ml血液。抗凝管中静脉血于当天送检验科,用全自动血液分析仪和配套试剂检测中性粒细胞、淋巴细胞数量并计算得出NLR。促凝管中静脉血收集后静置10-20min,台式高速离心机(ST16R,美国Thermo Scientific公司)3 000rpm离心10min,分离血清保存于-80℃低温冰箱(DW-150W200,中国海尔电器公司),待样本采集完整后,采用双抗体夹心ABC-ELISA (Bio-Rad酶标仪51900,美国Thermo公司)和酶标板快速孵育器(8-3821A,美国Thermo Fisher公司)检测血清VitD、hs-CRP和IL-6水平。所有操作均严格按照仪器和试剂说明书进行。
1.4 统计学处理

2 结 果
2.1 CAPD前后各组相关检测因子水平的比较
CAPD前以及CAPD后,各组血清VitD以及hs-CRP、IL-6和NLR水平差异均有统计学意义(P<0.01)。与对照组比较,CAPD前,VitD正常组、VitD不足组和VitD缺乏组患者血清VitD水平明显降低,而hs-CRP、IL-6和NLR水平均显著增高(t均>10.31,P均<0.01)。VitD正常组、不足组和缺乏组患者间血清VitD水平逐步下降且各组间具有显著差异(t均>12.57,P均<0.01),炎性因子hs-CRP、IL-6和NLR水平均逐步明显增高,相互两组间比较差异均有统计学意义(t均>19.09,P均<0.01)。与CAPD前比较,CAPD后,VitD正常组、不足组和缺乏组患者血清VitD水平均降低,hs-CRP、IL-6和NLR水平升高,差异均有统计学意义(t均>10.85,P均<0.01)。见表1。

表1 CAPD治疗前后各组血液相关检测因子水平比较
2.2 CAPD前后ESRP患者血清VitD水平与各炎性因子水平的相关性
在CAPD前后,患者血清VitD水平均与hs-CRP、IL-6和NLR水平均呈负相关(P<0.05)。见表2。
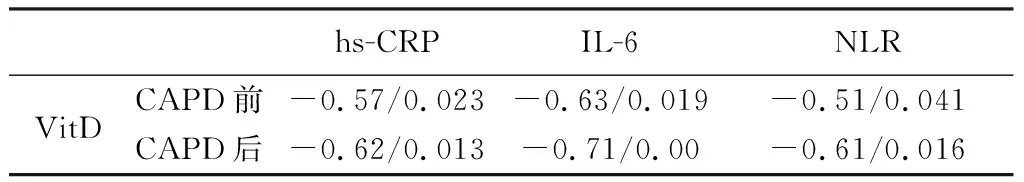
表2 CAPD前、后ESRD患者血清VitD水平与各炎性因子水平的相关性比较(r/P)
3 讨 论
CAPD以其安全有效、简单便捷、易操作,适宜于居家使用。作为肾病患者的终身替代疗法,它能更好保护患者的残余肾功能,提高生活质量,延续生命周期[8]。但在ESRD患者执行CAPD前自身已出现转移性钙化并发症及VitD缺乏。而活性VitD能够调节免疫细胞的增殖、分化以及细胞因子表达。所以,ESRD患者体内VitD缺乏,意味着炎性细胞增加及其炎性因子水平增多, 微炎症状态加重[9]。本观察发现,与对照组比较,ESRD患者体内VitD水平均显著下降,且VitD水平缺乏的患者在所收集病历中所占比率显著增多,即使是VitD水平正常的患者,其体内VitD水平水平亦处于正常值下限。同时,ESRD患者体内hs-CRP、IL-6和NLR水平不仅较对照组显著增高,且随着VitD水平下降分组,上述炎性因子水平出现明显增加趋势。提示活性VitD缺乏,激活内源性炎症细胞增加,提高炎性因子水平,可能为ESRD患者在即将实施CAPD后可能出现不利因素和副作用产生有益影响[10]。
而长期卧床进行CAPD的患者,因室外活动减少,日光照射机会缺乏,以及持续暴露于葡萄糖高渗透析液、机械应力、导管长期置入体内造成腹膜损伤和灌入刺激,更加容易引起钙磷代谢紊乱和微炎症状并发症,造成体内可利用的活性VitD减少,炎性因子水平增高[11]。本实验观察发现,CAPD各组患者VitD水平在各自组别中均下降,且处于各分组值的下线,甚至缺乏组患者VitD水平下降到严重缺乏状态。而各组的炎性因子hs-CRP、IL-6和NLR水平在随着VitD水平下降的过程中,也逐渐增加,出现VitD缺乏组高于VitD不足组,VitD不足组高于正常组,提示CAPD患者均出现VitD水平逐级下降,伴随hs-CRP、IL-6和NLR水平逐渐增加的变化趋势。同时,本观察经过对比CAPD前的患者VitD以及hs-CRP、IL-6和NLR的水平,发现实施CAPD后,患者血液VitD水平明显下降,hs-CRP、IL-6和NLR水平显著增加。说明在对ESRD患者实施CAPD之后,在没有其他临床治疗干预措施存在和实验室检测实时评估情况下,VitD水平下降和hs-CRP、IL-6和NLR水平增加是不可避免,VitD 下降伴随着hs-CRP、IL-6和NLR水平增加,对ESRD患者开展CAPD同时,需要防治VitD下降及其伴随微炎症状并发症,避免在实施CAPD过程中,因患者钙代谢异常和微炎症加重,所引起心血管病恶性事件和肾脏超滤衰竭发生[12]。
由于ESRD患者在接受CAPD前后体内自身固有免疫系统和适应性免疫系统出现缺陷和紊乱,引起新型免疫调节剂VitD水平下降,炎性因子水平增加[13]。提示在CAPD治疗前后,ESRD患者体内VitD水平下降与炎性细胞因子水平升高存在关联[14]。本文研究也证实在CAPD前后,ESRD患者均出现VitD水平下降,伴随hs-CRP、IL-6和NLR水平升高,呈显著负相关。并且CAPD后,VitD水平下降与hs-CRP、IL-6和NLR水平升高的负相关性绝对值均分别高于CAPD前,说明在CAPD前后,ESRD患者体内VitD水平下降与hs-CRP、IL-6和NLR水平升高具有明显的相关性,且CAPD后比CAPD前的相关性更强。提示CAPD模式在给肾病患者带来积极治疗优势的同时,更需要观察患者体内VitD水平下降,并给予适当补充,调理患者固有免疫和适应性免疫异常改变;检测hs-CRP、IL-6和NLR水平动态变化,防止CAPD过程中微炎症发生[15]。从而保护好患者残余肾功能,让ESRD患者在利用其优势中尽量获益,更好延长生命周期。
◀

