血必净联合乌司他丁治疗脓毒症急性肺损伤临床研究*
龚光远,欧 红,张文军,周 静,杨 敏,李天泉,徐智会
(重庆市綦江区人民医院重症医学科,重庆 401420)
脓毒症是引起急性肺损伤甚至急性呼吸窘迫综合征的重要原因,患者肺部多呈弥漫性肺泡损伤,肺通透性增加及肺水肿,需及时给予有效治疗,必要时给予体外膜肺氧合治疗[1]。研究显示,炎症通路的激活,导致肺泡上皮和血管内皮细胞受损,引起肺泡积液,是脓毒症急性肺损伤发生、发展的重要机制[2]。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎性小体是炎性反应激活的重要环节,该通路的激活是炎性疾病及恶性肿瘤发生及发展的重要机制之一,抑制NLRP3炎性小体,有望成为上述疾病治疗的关键[3-4]。血必净注射液治疗胰腺炎、脓毒症等炎性疾病效果良好[5]。乌司他丁属免疫调节类药物,广泛用于胰腺炎、脓毒症等重症疾病的临床治疗,与血必净联用有良好的协同效应[6-7]。本研究中探讨了血必净联合乌司他丁治疗脓毒症急性肺损伤的临床疗效,以及对患者外周血NLRP3 炎性小体表达水平的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:年龄不小于18岁;符合脓毒症国际共识指南[8]诊断标准;存在急性肺损伤,即有呼吸困难或窘迫症状;低氧血症,氧合指数(PaO2/FiO2)<300 mmHg(1 mmHg = 0.133 kPa);胸部X 线摄片示双肺浸润,肺动脉楔压低于18 mmHg,无左心房高压表现。本研究方案经医院医学伦理委员会批准,患者及其家属均签署知情同意书。
排除标准:合并自身免疫系统疾病;入院24 h 内死亡;恶性肿瘤;对本研究拟用药物过敏。
病例选择与分组:选取我院2017 年1 月至2020 年10月收治的脓毒症急性肺损伤患者120例,按治疗方法的不同分为对照组和观察组,各60 例。观察组患者中,男33 例,女27 例,平均年龄(60.2±10.5)岁;对照组患者中,男35 例,女25 例,平均年龄(60.8±9.8)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
两组患者入院后均根据国际脓毒症诊治指南采用早期复苏、补液、使用抗菌药物、机械通气及血液净化等常规治疗,并予呼吸机辅助通气氧疗,同时加用注射用乌司他丁(广东天普生化医药股份公司,国药准字H19990134,规格为每支10 万U)40 万U,加入5%葡萄糖注射液250 mL 中静脉滴注,3 次/日。观察组患者加用血必净注射液(天津红日药物公司,国药准字Z20040033,规格为每支10 mL)100 mL,溶于0.9%氯化钠注射液静脉滴注,2次/日。两组均连续治疗7 d。
1.3 观察指标及疗效判定标准
观察指标:1)基因水平。取患者治疗前及治疗7 d后的静脉血各3 mL,分离提取人外周血单核细胞(PBMCs),提取总RNA,以实时荧光定量聚合酶链反应(qRT - PCR)法检测NLRP3 及半胱氨酸蛋白酶1(cas‐pase - 1)mRNA 水平;以RNA 为模板合成cDNA;建立25 μL 扩增反应体系,以GAPDH 为内参,计算各组相应基因的2ΔΔCt值[9]。2)外周血细胞因子及内毒素水平:取患者治疗前及治疗7 d 后的静脉血各3 mL,离心,分离,得血清,采用酶联免疫吸附(ELISA)法检测白细胞介素1β(IL-1β)、白细胞介素18(IL-18)及内毒素水平,试剂盒均购自南京建成生物公司工程研究所,按说明书操作。3)血气指标。检测患者治疗前后的氧合指数、二氧化碳分压、乳酸水平、肺泡- 动脉氧分压差。4)病情严重程度评分。记录患者治疗前及治疗7 d 后的肺损伤预测评分(LIPS)和急性生理与慢性健康状态Ⅱ(APACHEⅡ)评分。
疗效判定:痊愈,体温36~37 ℃、呼吸频率<20次/分、心率<90 次/分、白细胞计数(4~10)×109L-1;显效,病情显著改善,但体温、呼吸频率、心率、白细胞计数尚有1 项未达痊愈标准;有效,病情有所改善,体温、呼吸频率、心率、白细胞计数等有所改善,但不明显;无效,未达上述标准或病情加重(见脓毒症诊治指南)[8]。总有效为前三者之和。
安全性:记录治疗期间患者恶心呕吐、腹痛、头晕、皮疹等不良反应发生情况。
1.4 统计学处理
采用SPSS 19.0 统计学软件分析。计量资料以±s表示,行t检验;计数资料以率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
结果见表1 至表5。对照组与观察组留置重症监护病房时间[(9.8 ± 2.1)d 比(9.6 ± 1.9)d]、总住院时间[(14.5 ± 2.6)d 比(14.1 ± 2.8)d]、插管率(75.00%比78.33%)、有创机械通气时间[(37.4 ± 6.3)h 比(37.7 ± 7.1)h]、无创机械通气时间[(30.9 ± 5.9)h 比(31.2±6.6)h]均相当(P>0.05)。治疗期间,对照组出现3 例不良反应,包括腹痛、恶心呕吐、皮疹各1 例;观察组出现4 例不良反应,包括恶心呕吐、头痛各1 例,皮疹2 例。两组不良反应发生率相当(5.00%比6.67%,P>0.05)。
表1 两组患者外周血人单核细胞中NLRP3及caspase-1 mRNA水平比较(±s,n=60)Tab.1 Comparison of NLRP3 and caspase - 1 mRNA levels in the PBMCs between two groups(±s,n=60)

表1 两组患者外周血人单核细胞中NLRP3及caspase-1 mRNA水平比较(±s,n=60)Tab.1 Comparison of NLRP3 and caspase - 1 mRNA levels in the PBMCs between two groups(±s,n=60)
注:与本组治疗前比较,*P <0.05。表2至表4同。Note:Compared with those before treatment,*P <0.05(for Tab.1-4).
组别对照组观察组t 值P 值NLRP3 mRNA治疗前1.04±0.12 1.03±0.16 0.387 0.699治疗后0.70±0.15*0.55±0.18*4.959 0.000 caspase-1 mRNA治疗前1.02±0.16 1.05±0.13 1.227 0.262治疗后0.73±0.14*0.56±0.19*5.580 0.000
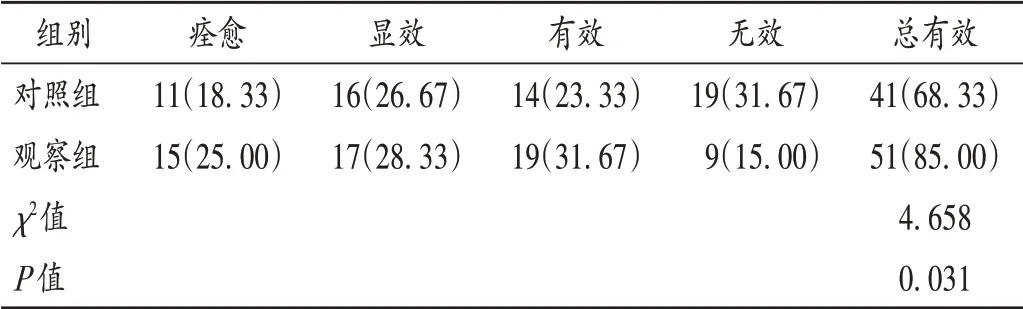
表5 两组患者临床疗效比较[例(%),n=60]Tab.5 Comparison of clinical efficacy between the two groups[case(%),n=60]
3 讨论
脓毒症是临床常见的急危重症,其可造成多器官功能障碍,其中急性肺损伤是其严重并发症之一,死亡率极高。脓毒症急性肺损伤发病机制复杂,涉及细菌内毒素、炎性介质、凝血及免疫功能异常等,其中炎性反应失衡是其发生、发展的核心环节[10]。有研究显示,细菌内毒素为脓毒症的不良外界刺激因素,早期即可促进患者机体启动炎性反应,表现为炎性细胞向重要靶器官聚集,分泌炎性细胞因子如IL-6,TNF-α 等[11]。因此,在早期常规治疗的基础上,抑制炎性反应的激活与放大是脓毒症急性肺损伤防治的主要方向。
表2 两组患者血气分析指标比较(±s,n=60)Tab.2 Comparison of blood gas analysis indexes between the two groups(±s,n=60)

表2 两组患者血气分析指标比较(±s,n=60)Tab.2 Comparison of blood gas analysis indexes between the two groups(±s,n=60)
组别对照组观察组t 值P 值氧合指数治疗前223.10±18.25 219.42±21.50 1.011 0.314治疗后275.31±20.82*298.28±19.70*6.073 0.000二氧化碳分压(mmHg)治疗前52.10±4.23 51.82±5.10 0.327 0.744治疗后38.20±5.59*32.24±6.13*5.565 0.000乳酸(mmol/L)治疗前5.23±0.79 5.48±0.68 1.858 0.066治疗后2.05±0.73*1.32±0.41*6.754 0.000肺泡-动脉氧分压差(mmHg)治疗前39.20±4.80 38.81±5.02 0.435 0.664治疗后28.10±5.11*22.42±4.10*6.716 0.000
表3 两组患者炎性因子水平比较(±s,n=60)Tab.3 Comparison of the inflammatory factors levels between the two groups(±s,n=60)

表3 两组患者炎性因子水平比较(±s,n=60)Tab.3 Comparison of the inflammatory factors levels between the two groups(±s,n=60)
组别对照组观察组t 值P 值IL-1β(pg/mL)治疗前45.40±6.21 46.01±7.20 0.497 0.620治疗后30.21±5.62*23.28±5.10*7.073 0.000 IL-18(pg/mL)治疗前34.30±5.02 33.89±5.37 0.432 0.667治疗后24.18±4.63*17.20±5.03*7.909 0.000内毒素(EU/mL)治疗前3.02±0.62 2.98±0.52 0.383 0.703治疗后1.15±0.33*0.72±0.21*8.515 0.000
表4 两组患者病情严重程度评分比较(±s,分,n=60)Tab.4 Comparison of the severity scores between the two groups(±s,point,n=60)

表4 两组患者病情严重程度评分比较(±s,分,n=60)Tab.4 Comparison of the severity scores between the two groups(±s,point,n=60)
组别对照组观察组t 值P 值LIPS评分治疗前9.86±1.22 10.13±1.35 1.449 0.253治疗后6.20±0.83*5.05±0.78*7.821 0.000 APACHEⅡ评分治疗前18.32±4.26 19.01±3.57 0.962 0.338治疗后12.03±3.24*9.26±2.68*5.103 0.000
炎性疾病如器官缺血再灌注损伤、脓毒症、恶性肿瘤等发生机制复杂,但有研究显示,NLRP3 介导的炎性反应是其共同的机制之一[12-13]。Caspase- 1 是NLRP3炎性小体的下游信号分子,其活化可促进细胞凋亡,作为程序性细胞死亡的方式,同时伴有大量下游炎性细胞因子的释放[14]。抑制NLRP3 的激活可显著降炎性反应,减缓其进展[15]。传统中医药治疗炎性疾病如脓毒症的临床疗效较好[16]。
血必净注射液由赤芍、当归、红花、川芎、丹参等中药提取而成,具有拮抗内毒素、调节机体免疫、抑制炎性反应、减轻重要组织器官损伤的作用[17]。乌司他丁属广谱酶抑制剂,可清除机体炎性介质及自由基,改善休克及器官缺血再灌注损伤[18],其多用于脓毒症的治疗,可显著减少炎性介质,进一步改善呼吸和循环功能,降低其死亡率[19]。两者联用有显著协同效应。但该联用对脓毒症急性肺损伤患者NLRP3炎性小体的表达及下游炎性通路的影响尚不清楚。LIPS和APACHEⅡ评分是临床常用的评价肺损伤的重要指标。本研究结果显示,联合用药可显著降低患者的LIPS和APACHEⅡ评分,显著改善肺功能。联合用药显著抑制了脓毒性急性肺损伤患者外周血NLRP3炎性小体及下游相关炎性通路的激活。且观察组加用血必净注射液后不良反应发生率未明显增加。
综上所述,血必净联合乌司他丁治疗脓毒症急性肺损伤临床疗效良好,其作用机制可能与降低患者外周血NLRP3 炎性小体水平,抑制下游炎性通路激活,减轻组织器官功能损伤有关。

