盘点2021:我国生物医药创新发展之浅见*
刘昌孝
(天津药物研究院·释药技术与药代动力学国家重点实验室·天津市药品监管科学研究会,天津 300462)
面对全球新冠疫情的严重压力,我国疫情防控工作在“人民至上,生命至上”的价值理念指引下取得了举世瞩目的成就。在国家战略指引下,2021 年可以说是我国医药产业高质量创新发展承上启下的一年,实现了“十四五”良好开局:医药创新在控制疫情、恢复医药产业经济中发挥了突出作用,在从医药大国向医药科技强国转变的征途中大步迈进;整个生物医药产业和创新生态环境系统逐步完善,医药创新在社会经济发展中的战略性地位更加显著;医药产业链的韧性得到有效提升,实现了由量的增长向质的提升;以临床价值为导向和以患者为中心的研发初衷推动了医药创新高质量发展,推出了多个具有一定国际影响力的创新医药产品和技术指导原则;医药创新能力已经成为国家产业经济实力和强国要素的重要组成部分。
1 回首百年:医药发展历经沧桑
2021 年,恰逢中国共产党建党百年,梳理近百年医药发展史,可以看到中国医药发展的来之不易:从无到有、从小到大、从仿到创、从无序到有序竞争、从多头到科学管理(表1)。回顾世界生物医药发展历程,近几十年除抗肿瘤药和免疫调节药之外的其他领域尚无很大突破,创新发展任务艰巨。当前,我国医药产业经过70 多年奋斗,创新能力大大提高,但也要意识到平衡创新和发展的风险,以及世界格局和疫情因素可能会对医药产业创新格局的变化产生影响。

表1 我国百年医药和产业发展来之不易Tab.1 Difficulties and Achievement in China′s pharmaceutical and industrial development in the past century
2 盘点2021:我国生物医药发展成绩斐然
2.1 高质量发展规划和系列指导原则密集出台,创新药品加速批准
2021 年12 月30 日,国家药品监督管理局(简称国家药监局)等8 部门联合印发《“十四五”国家药品安全及促进高质量发展规划》[1],明确了我国“十四五”期间药品安全及促进高质量发展的主要发展目标,并制定出10个方面的主要任务。
到2021 年年底,国家药监局药品审评中心(CDE)已发布210多个药品临床试验技术指导原则,其中2021年发布了26 个(含10 个最终稿和16 个征求意见稿)关于抗肿瘤药物临床试验的技术指导原则、8 个关于抗菌药物临床试验的技术指导原则。2021 年7 月2 日,CDE《以临床价值为导向的抗肿瘤药物临床研发指导原则(征求意见稿)》[2]提出:“新药研发应以为患者提供更优的治疗选择为最高目标,当选择非最优的治疗作为对照时,即使临床试验达到预设研究目标,也无法说明试验药物可满足临床中患者的实际需要,或无法证明该药物对患者的价值。”该指导原则的发布,不仅对抗肿瘤药的研发提出了更高要求,将加大医药企业新药“真创新”开发难度,降温“me too”行业,也要求进行药物研发时须秉承以临床需求为根本出发点,以为患者提供实际临床价值为最终目的,堪称我国新药研发史上的里程碑事件。
2021 年,国家药监局共批准76 个新药(不包括疫苗,有4 个国产疫苗创新产品获批上市,其中3 个为新冠疫苗),其中进口新药37 个、中药创新药12 个、国产创新药27 个[3],年获批新药数量已接近发达国家水平。这些新药主要涉及肿瘤、自身免疫系统、病毒和感染等疾病用药,其中有不少“中国新”甚至“全球新”的创新产品,如国产首个新冠中和抗体联合疗法、国内首个CAR-T 细胞疗法产品、国产首个抗体偶联药物(ADC)新药等。
在治疗领域和适应证方面,近两年获批或报产一类新药以抗肿瘤药为主。据中国银河证券统计数据,按治疗领域分类,134 个已获批或进入报产阶段的一类创新药中,抗肿瘤药61 个(45.52%),抗感染用药23 个(17.16%),神经系统用药10 个(7.46%),血液系统用药10 个(7.46%),其他治疗领域30 个(22.39%)。抗肿瘤药物是全球新药研发的重点,也是临床治疗需求的真实反映和未来研发的永恒主题。
与此同时,我国医药研究者在国内外学术刊物上发表的研究论文也在世界范围内产生了一定影响,特别是新冠疫情控制研究、传统药物研究、药物研发平台和合作发展等方面的进展[4-9],反映了国内医药创新发展的优势。
2.2 中医药特色发展有亮点
2021 年,服务国家疫情防控需求,疫苗和中西药物共同发展。遵从中药研制规律,鼓励中药传承创新,激发释放了中药创新的活力和潜能。据统计,2016 年至2021年全球医药健康产业中共有21个中药新药获批上市,平均每年4 个。2021 年就有12 个中药新药获批上市,数量为近5年最高,是过去每年的3倍。
2020 年11 月和12 月,国家药监局和国家中医药管理局两次联合召开“经典名方”研发推进会,为鼓励开发中医药遗产奠定了政策法规和技术共识基础。2021年2 月9 日,国务院办公厅《<关于加快中医药特色发展的若干政策措施>的通知》[10]提出,“探索符合中医药特点的医保支付方式,发布中医优势病种,鼓励实行中西医同病同效同价”,并从夯实中医药人才基础、提高中药产业发展活力、增强中医药发展动力、完善中西医结合制度、实施中医药发展重大工程、提高中医药发展效益、营造中医药发展良好环境等7个方面提出了具体要求。
2021 年2 月10 日,国家药监局、国家中医药管理局、国家卫生健康委、国家医保局联合发布《关于结束中药配方颗粒试点工作的公告》(2021 年第22 号)[11],结束了长达20 年的中药配方颗粒试点工作,规定了中药配方颗粒品种实施备案管理,其质量监管纳入中药饮片的管理范畴,由相关部门研究制定或明确其临床使用、价格、医保支付等方面的政策。这一定位凸显出了中药饮片的主体性,中药配方颗粒的临床应用,给医生和患者多了一种选择。
2.3 创新研发从内卷需求向国际循环发展转变
2021 年,我国制药企业许可引进(License - in)项目再创新高,达到100 余起。创新研发呈现了更加多样的变化,如国内制药企业间的相互授权更加频繁,传统制药企业参与程度更加深入,引进的研发进度越来越早等。我国制药企业正在成为国际循环中越来越重要的角色,显现出创新需求和培育创新能力的需求。
随着我国制药企业研发实力不断提升,顺应改革开放、创新发展的对外许可(License-out)模式使中国新药研发进入到世界市场,通过授权或共同开发的模式,让国内制药企业走向世界市场发展。2019 年12 月14 日以来发生的10 起中国企业License-out 重磅交易项目,涉及企业包括恒瑞医药、复宏汉霖、天境生物、豪森药业等[12-14],合作大大促进了其国内发展。
随着中国生物科技(biotech)的不断崛起,国产新药License-out 模式已成大势。越来越多的跨国制药企业也开始与我国创新药企业进行产品合作,中国Biotech的License- out模式风起云涌。从靶点确定到化学分子设计完全依靠自主创新,借助独特的AI 辅助研发平台和产业生态资源,未来我国医药快速向生物医药(Bio‐pharma)发展,以不断提升的硬核创新新药研发能力服务更多全球患者。国内16 家创新企业授权产品包括新药研发的前沿领域热门疗法,如CAR - T,ADC,BTK,EGFR - TKI,PD - 1 等新药走出了坚定的国际合作之路。
2021 年,我国在License - in 模式与License - out模式的权衡方面获得了不少经验。License - in 是促进国际商业合作的模式,其关注点包括:1)头脑需要清晰,由于前端临床前研究缺失,导致引进公司自主开发能力或者药物发现能力不被市场认可;2)权益需要明确,可能会丧失向外授权全球市场的权益;3)内卷发展机遇需要把握,引进管线后的工作主要聚焦于临床开发和商业化推广的内卷式发展;4)商业能力需要提高,临床开发可以交给医药研发合同外包服务机构(CRO),而所引入Biotech 的商业化能力一般都是缺失的,因此短期内拓展市场有难度。License - out 是创新走出国门的模式,其关注点包括:1)能否取得原创认可,由于其原创性可更好地被国际认可,与跨国大制药企业的合作更加受到关注;2)有无外在优势,利用外在优势完善其临床前的不足,特别是机制和前景分析;3)是否具有临床优势,有利于利用多中心临床试验资源,争取时间探索市场的可能性;4)能否共享双赢,合作有利于促进国内发展。
2.4 监管科学新理念推出三大发展红利,创新发展获支持
监管科学新理念,推出了三大发展红利。一是国家鼓励创新和监管科学提升。2021 年医药行业政策密集出台。国家层面发布医疗和医药行业相关政策共计500余条,其中医药政策数量约占60%。这有赖于创新政策推动下的“十一五”至“十三五”规划,以及重大专项推进夯实的基础。二是创新药企业专注研发创新,仿制药企业专注提高质量、降低成本,做大市场规模。2021 年,医药上市公司研发费用持续加码,创新转型趋势延续。三是发展模式积极创新。无论是跟随仿制还是跟随创新、原始创新,以及License - in 和License - out 合作模式促进发展,合作盈利初见成效,防范创新赛道上的阻塞和内耗、把握企业仿与创位置的能力逐渐提高。2018 年以来,围绕创新“烧钱”与投资的关系,科学家-企业家- 投资家(三家)的对话机制,以及投资风险评估正逐步完善。
从监管科学的角度来认识,近年来,国家机构改革持续推进,医药监管“九龙治水”的局面得到很大改观,但涉药的管理部门仍然不少,有国家卫生健康委、中医药管理局、市场监管总局、药监局、发改委、科技部、工信部、医保局、环保部以及公安部、海关和军队单位等。因此,提高部门协调、政策联动、形成监管高效应,对于推进创新型国家建设和健康中国战略性医药产业创新高质量发展至关重要。医药行业期待国家层面能够建立和形成促进国家医药协调发展的工作机制,不仅有利于应对突发卫生公共事件,也有利于医药产业的长期稳定发展。
3 展望未来:创新发展和转型发展面临挑战
3.1 在竞争中发展,创新未必都有未来
药品与人类健康息息相关,各国政府对药品从研发、上市、流通到使用的管理均有严格的法规要求。“药品的生命周期”包括从药品的研发开始,到注册评价、上市使用、再评价,直至由于疗效和安全性问题等原因撤市的整个过程,包括引入期- 成长期- 成熟期- 衰退期(图1)。不同药品在此生命周期中的长短差异很大,现在已经很难看到有像阿司匹林、胰岛素、青霉素那样“高龄将军”的药品。因此,从某种意义上说,创新药物未必都有未来。

图1 药品的生命周期Fig.1 Life cycle of drugs
新药研发由于研发长周期与高投入,其失败的风险极高。近20 年来,药物研发创新的回报率越来越低,由2000年的10%降到2020年的3.1%。表2显示了美国食品药物管理局(FDA)2015年以来批准药品新的临床适应证开始和出现临床负面结果的年份,可见其间隔年份的差异。因此,药品研发企业如何把握相关尺度显得尤为重要。

表2 2015-2020年美国FDA批准新临床适应证年份与出现临床负结果年份的差异比较Tab.2 Comparison of the difference between the years when FDA approved new clinical indications of drugs and the years with negative clinical results from 2015 to 2020
药品的引入、成长、成熟、衰退的生命周期受多种因素影响,其退市的原因有药物本身的优势特点、发展战略、市场竞争等问题,更有临床优势和安全性问题,如因出现疗效更好或副作用更低的新产品而被自然淘汰。药品的使用本身就是一个利益与风险平衡的选择,特别是药品在成长期的大规模临床使用过程中出现标志性“临床终点”不能实现,或不优于现有疗法的情况,就离淘汰不远了。
由于医药行业自身的特点,如受到严格控制及管理的特点,针对以研发为基础的制药企业所推出的处方药,在其生命周期不同阶段的营销战略进行探讨,也是企业发展需要考虑的问题。主要的考虑包括:因新产品在中国上市的滞后性,需要分析产品的优势、竞争特点以及内卷发展的可能性,调整临床开发计划;国内医生的用药习惯和患者的支付能力;产品专利到期对产品生命周期的影响;产品衰退期拐点的分析,对于把握好退出时机也很重要。
3.2 在创新赛道上的差异化发展
在生物医药研发产业链上,不同规模、不同阶段、不同方向的协同发展和组合是获得成功的基本要素。即使在发达国家,一个企业也不可能包罗万象、涵盖所有的方面,我们尤其应该强调创新的差异化发展(图2)。笔者曾在2018 年指出:未来生物医药发展必须重视产业转型的问题,“大型药企”的概念将不复“存在”;医药企业收入将不再仅仅依赖药品“销售”;随着国际合作趋势加强,应对行业的“合规”问题必须加以重视。因此,某方面的发展可能会从零开始,建立起一个全新的产业系统;面对发展机遇,不同类别的企业能否进行紧密合作,也是成功的战略思维需要考虑的问题。
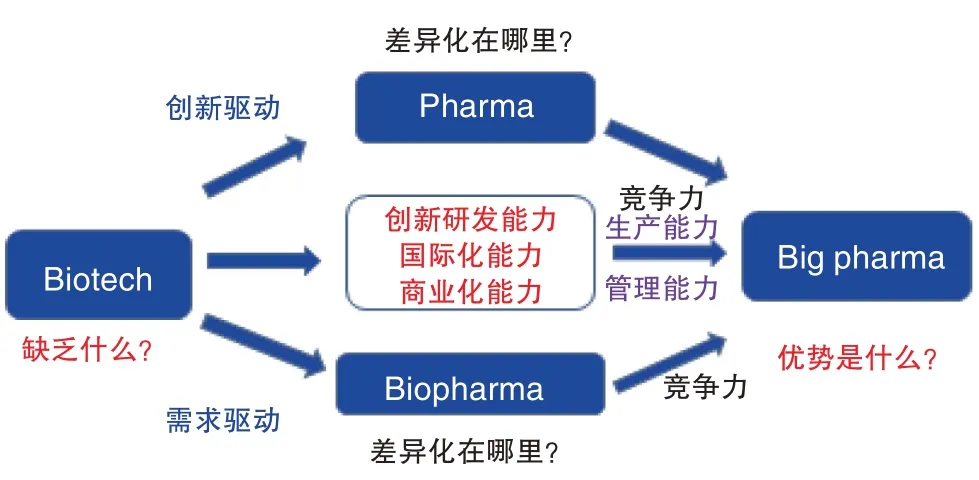
图2 创新的差异化发展Fig.2 Differentiated development of innovation
3.3 创新思维与能力影响创新转化
发展生物医药,需要基础创新、技术创新,而科学、技术、专利人才都是有国界的。认识基础研究的“卡脑子”问题,认识技术上的“卡脖子”问题,解决“双卡”,需要健康的研发生态环境(图3)。

图3 产业转化与创新思维与能力关系Fig.3 Relationship between industrial transformation and innovative thinking and ability
创新驱动下的科学技术问题,需要自主自强地处理好原始创新的“卡脑子”的科学问题和“卡脖子”的技术问题。Science 公布的125 个科学问题,11 个医学与健康问题中有5 个与传染病防治有关,包括流行病预测、病毒性感染、疫苗研发、创新药设计以及抗生素耐药等。“十四五”计划中重点生物医药研发的科学和工程技术问题提出的10 个问题中,有一半是与传染病等重大疾病防治有关的前沿科学和前沿技术问题。面对国家生物医药发展重点,优势基础-产业-人才在哪里?选择突破在哪里?需要研发者“自立-自强-自信”,一切都是买不来、要不来、讨不来的。具有基础研究能力的专业研究院所必须关注国家发展和社会发展的迫切需求,在国家投入下潜心、静心、精心研究,而不图急功近利,努力提高成果的转化和产业化。发达国家对中国的封锁是必然的!
科学规律也提供了药物创新需要谨慎的理由。在有更多的时间观察临床试验中的志愿者之前,我们无法确定一种疗法的长期安全性。药物在生产和上市过程中,如果违背科学规律,就可能面临失败。
3.4 以需求为导向的生物医药发展面临的挑战
3.4.1 从服务国家需求和民生需求看挑战
公共卫生的民生需求战略的变化是转型发展的出发点,从长远看需考虑促进防-医-保产品长效管理机制,把握生物医药由疾病经济向健康经济转型的机遇和挑战。在新的历史时期,坚信创新、协调、绿色、开放、共享的健康发展理念,创新作为社会经济发展的重大战略,将大大促进促进科技成果转化,推动医药向高质量发展。中国生物医药创新是全球创新的重要组成部分,当今世界的深刻变化既带来新挑战,也带来新机遇。
在认识服务国家需求和民生需求与企业担当(图4)这一问题时,面对当前世界形势百年未有之大变局,我国医药产业要提升核心竞争力,走自主自强的发展道路,不断加强对基础理论、基础材料的研究,努力实现对先进制造和先进工艺的研究突破。面对产业发展中遇到的科学技术问题,要克服大而全的发展倾向,建立全新的、紧密的医药产业研发系统,多措并举解决发展问题,如将非核心研发业务外包给专业机构、建立非竞争性的研发联盟等;要建立科学的研发思维,将“谁来做(who)、做什么(what)、在哪里做(where)、什么时候做(when)、为什么做(why)、结果如何(how)”这6个关键维度应用到药物研发中,助力药物研发效率的提高。

图4 服务国家需求和民生需求与企业担当Fig.4 Relationship between serving the needs of the state and people's livelihood and the responsibility of enterprises
洞见未来,就是不忘本来,吸收外来,面向未来。中国医药政策导向从过去直接鼓励产品创新,逐步升级到关注临床价值和临床需求,这无疑进一步延伸和丰富了产业创新的价值内涵。中国的自强,加快了跨国制药企业拥抱中国本土创新创业的速度:从研发中心到创新中心的变化,从被动技术转移到主动技术合作,中国产业环境巨变“in china.for china”更推动了中国本土创新环境和临床需求发展,使其赢得了中国庞大的创新医药市场。
3.4.2 从创新差异化发展看挑战
从创新差异化发展方面看挑战,一是应该看到上市的“me too”新药产品在国内成功商业化的概率不高;二是国内“me too”新药的“类仿制药竞争态势”,才是每个制药企业和投资人需要重点考虑的风险;三是研发投入明显不足,国内“me too”新药的开发成本不到1 亿美元,从新药临床试验申请(IND)到取得新药批件的成功概率高达80%,而欧美“first in class”新药开发成本平均10~26 亿美元,从进入临床试验到取得新药批件的成功率低于10%;四是我国几乎都不做“头对头”临床试验,没有确切数据证明自己的产品更好,价格是唯一最客观的指标;五是我国国际多中心临床试验结果少,内卷式(China only型)研究多,很难进入国际市场。
3.4.3 从Lisence-in 到Lisence-out 模式转变看挑战
License-in 是一种产品引入方式,其核心是“产品引进方”向“产品授权方”支付一定的首付款,双方约定一定金额的里程碑费用(按品种开发进展)和未来的销售提成,从而获得产品在某些国家(地区)的研发、生产和销售的商业化权利。该模式有别于传统的以医药公司自己研究新药或收购创新药公司为主的两种投资方式[15]。License-in模式不是一种好的商业模式。
与License-in 模式不同,License-out 模式一向被认为是创新走出国门,具有诸多优势,有利于利用外在优势,促进国内发展。一个制药企业靠License-in 模式是长不大的,因为原创引不来、买不来、要不来!国外企业是因为看到中国“人多病多”的大市场才愿意合作的。Lisence - in 模式可缩短研发时间、提高研发效率、减少固定投入,通过资金实现研发的“弯道超车”并造就了“再鼎”等知名上市公司。但2021 年Lisence-in 占比过大的制药企业首次公开募股(IPO)多已被否,而Lisence - out 取而代之且大为火爆,交易金额屡创新高。Lisence-out 模式标志着我国科学家的生物医药科研成果被国际同行认可,是企业医药创新能力的体现。
2017 年10 月8 日,中共中央办公厅、国务院办公厅发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)[16],开启了中国创新药的发展大潮。2021 年7 月2 日CDE 发布《以临床价值为导向的抗肿瘤药物临床研发指导原则(征求意见稿)》,则正式宣告中国创新药“套利时代”的结束,引发医药股股价大跌,也引发了行业对“me too”、创新成色和内卷的大讨论。长期以来,IPO 首日股价大涨在大家心目中已是“必然”,并造就了专业打新(买新发行的股票)的“获利一族”,而2021年医药新股则频频破发,更不幸的是IPO 失败。自2019 年7 月科创板开市以来,截至2021 年12 月,共有77 家医药生物企业拟登陆科创板,仅2021 年就有34 家,其中13 家IPO 审核终止,近80%为主动撤回申请。
IDEA Pharma 医药咨询公司以药物发明指数(phar‐maceutical invention indices,PIVI)和 药 物 创 新 指 数(pharmaceutical innovation indices,PINI)两个指标对全球主要制药企业创新力进行排名并发布榜单。在IDEA Pharma看来,发明(invention)是以新颖的方式将想法和技术结合起来,去创造此前不存在的事物;而创新(in‐novation)则是发明的回报,利用发明去创造有意义的价值。
3.4.4 从内卷-商业化看Biotech 短板
研发的终极目标是给患者提供更好的医药产品,因此,科技含量再高的研发成果也必须使其产品上市销售最大化,才能实现研发投入的最高回报。作为首批商业化(上市销售)的本土制药企业自研创新药PD-1,其上市销售远逊于预期,首批上市并已纳入医疗保险的达伯舒、艾瑞卡、百泽安、拓益等4 款国产PD - 1 2021 年前3 季度销售额也就80 多亿元(恒瑞因未披露,暂以其去年销售额的3/ 4 计)。如果创新策略仍然是“快速跟随”,而非原始创新,是不可能没有研发出一种真正具有全球市场竞争力的“first in class”重磅药物,因此而期待形成具有巨大市值和世界市场也是很困难的。
4 结语
回首百年,历经艰难奋斗,我国医药创新能力已大大提高。盘点2021 年,我国生物医药发展成绩斐然。国家鼓励创新和监管科学提升、创新药企业专注研发创新与仿制药企业专注质提高量、发展模式创新这三大发展红利有力支撑了医药创新发展。
在新政环境下,洞见未来医药发展趋势:(1)随着市场信息透明化提升,热门药物被高度关注;(2)大数据引导新药研发成本逐渐降低,导致研发竞争;(3)新药市场独占期缩短,面临着同类新药和仿制药的激烈竞争;(4)断定新药开发风险加剧,投资回报可期更难。从发现到新药批准是一个漫长的过程,成本巨大、风险极高。
为积极有效应对世界医药创新竞争带来的挑战,我国医药行业(包括产业、商业、医疗、投资的整合)必须为可持续发展做好顶层设计,构建可持续的创新生态环境,促进和提升创新主体活力,认清我国制药企业发展的短板,定位好我国创新药领域的目标,才能为我国医药产业进入全球产业链从而提高全球市场份额提供保障。
我国生物医药创新发展,迫切需要加强并完善夯实强国基础、守正创新、完善产业体系、做大国际贸易和实行双循环促进内需等方面的举措,以积极防范和化解世界格局百年未有之大变局给我国医药经济发展、人民卫生健康事业建设带来的冲击和风险。

