花椒根总生物碱抗肿瘤活性研究*
龙奕霄,蒙 永,蒋 霞
(1.广西医科大学,广西 南宁 530021; 2.广西壮族自治区梧州市红十字会医院,广西 梧州 543002;3.广西医科大学第一附属医院,广西 南宁 530021)
花椒根为芸香科花椒属植物花椒Zanthoxylum bun⁃geanumMaxim.的根,收录于《本草纲目》《中华本草》《本草从新》等中药名著,有散寒、除湿、止痛、杀虫等功效,主治虚寒血淋、风湿痹痛、胃痛、牙痛、痔疮、湿疮、脚气、蛔虫病等症[1]。花椒根含有多种生物碱类成分[2-5],民间曾用于宫颈癌的治疗。本研究中探讨了花椒根总生物碱对肿瘤细胞生长的抑制作用。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:DHG-9053A 型电热鼓风干燥箱(无锡玛瑞特科技有限公司);UV-8000 型紫外-可见分光光度计(上海元析仪器有限公司);Synergy H1型多功能检测仪(美国Biotek 公司);DMi8 型显微镜成像系统、EG150H+C型自动组织包埋机、RM2255型半自动轮转切片机(德国Leica公司);Multiskan Go型全波长全自动多功能酶标仪(美国Thermo Fisher 公司);JK-6型生物组织摊烤片机(武汉俊杰电子有限公司)。
试药:白屈菜红碱对照品(中国食品药品检定研究院,批号为111718-201402,供含量测定用);D113 型大孔弱酸性苯丙烯系阳离子交换树脂(天津市津达正源节能环保科技有限公司);溴甲酚绿(天津博迪化工股份有限公司);氟尿嘧啶注射液(上海旭东海普药业有限公司,批号为FA151117);白细胞介素2(IL-2)、肿瘤坏死因子-α(TNF-α)小鼠酶联免疫吸附试验(ELISA)试剂盒(北京科盈美公司,批号分别为19052511,19062513);Tunel 细胞凋亡检测试剂盒(批号为031819190506)、Proteinase K(批号为111318190402)购自上海碧云天生物技术有限公司;其余试剂均为分析纯,水为纯化水。花椒根药材,采自广西壮族自治区南宁市武鸣区大明山,经梧州市红十字会医院梁海雄副主任中药师鉴定为正品。
动物:H22腹腔积液型种鼠,雌雄各半,购自广东省医学实验动物中心,实验动物生产许可证号为SCXK(粤)2013-0002;SPF 级KM 小鼠,体质量18~22 g,雌雄各半,购自广西医科大学动物实验中心,实验动物生产许可证号为SCXK(桂)2014-0002,实验动物使用许可证号为SYXK(桂)2014-0003。饲养温度24~27 ℃,相对湿度40%~70%,自然光照,自由摄食饮水,实验动物饲养及处理符合实验动物伦理学要求。
1.2 方法
1.2.1 供试品溶液制备[6-7]
取药材样品5.0 kg,粉碎,过60目筛,加氨水搅拌并使其充分浸润,放置12 h后,加8倍量氯仿回流提取3次,每次2 h,滤过,回收溶剂,浓缩成浸膏,加2%盐酸溶液溶解,过滤后滤液加氯仿溶液萃取,弃去氯仿液,酸水液过弱酸性阳离子交换树脂,水洗至洗脱液近无色,弃去水洗液,15%醋酸-80%乙醇洗脱,洗脱液回收,浓缩,干燥,得花椒根总生物碱提取物(54.57%)。
质量控制:参考文献[4]配制溴甲酚绿磷酸缓冲液,以白屈菜红碱质量浓度(C)为横坐标、吸光度(A)为纵坐标进行线性回归,得回归方程。采用紫外-可见分光光度法,以白屈菜红碱为对照,测定并分离所得花椒根总生物碱提取物中的生物碱类成分含量,计算样品中总生物碱含量。
1.2.2 小鼠急性毒性实验[8]
实验分为①组、②组、③组、④组、⑤组、⑥组,各10 只,分别灌胃1 000,800,640,512,410,328 g/kg 花椒根总生物碱1 次(每10 g 体质量灌胃0.2 mL)。记录24 h 内小鼠死亡数量及死亡表现症状(见表1),经Bliss拟合计算半数致死浓度(LD50)。未死亡小鼠观察14 d,记录饮食、行为及体格变化。

表1 小鼠急性毒性实验观察项目Tab.1 Observation items of the acute toxicity test in mice
1.2.3 抗肿瘤活性
分组及给药:无菌条件下抽取传代第7天H22小鼠的腹腔积液,用生理盐水稀释成密度为5×106mL-1的单细胞悬液。将60 只KM 小鼠随机分为正常对照组(A组,等体积生理盐水灌胃)、模型组(B 组,等体积生理盐水灌胃)、阳性药物组(C 组,氟尿嘧啶20 mg/kg 腹腔注射)及花椒根总生物碱高、中、低剂量组(D1组、D2组、D3组,100,80,40 g/kg生药灌胃),各10只。右上肢腋窝皮下注射0.2 mL 细胞悬液以复制荷瘤小鼠模型,建模成功后各组小鼠给予相应药物或生理盐水,每天1 次,连续10 d。
组织病理形态学:取瘤块,称定质量,置10%甲醛溶液中固定,常规病理包埋,切4 μm 厚片,苏木素-伊红(HE)染色,显微镜下观察组织病理形态学。细胞凋亡率计算:上述切片以Tunel 法观察细胞凋亡情况。每组每个移植瘤组织随机拍摄3 个视野,各视野图片用Image-Pro Plus 6.0 软件统计,视野内细胞凋亡阳性表达占全视野的百分比为每张图片的细胞凋亡率[9]。抑瘤率计算:摘眼球取血后颈椎脱臼处死小鼠,剥取瘤块,称定质量,计算抑瘤率(IR)。IR=(模型组平均瘤体质量-用药组平均瘤体质量)/模型组平均瘤体质量×100%。
细胞因子水平:末次给药后24 h,记录各组小鼠体质量,摘眼球取血,3 500 r/min 离心10 min,分离,得血清。以ELISA法检测小鼠血清中的IL-2和TNF-α水平。
1.3 统计学处理
采用SPSS 16.0 统计学软件分析。计量资料以X±s表示,行t检验。P <0.05为差异有统计学意义。
2 结果
2.1 急性毒性实验
①组、②组、③组、④组、⑤组、⑥组小鼠分别死亡7,6,2,1,0,0 只,LD50为778.21 g/kg。后续实验中的高、中、低剂量根据1/5,1/10,1/20LD50设定,按调凑整原则生药量分别设定为100,80,40 g/kg。剩余未死亡小鼠继续观察14 d,各动物体表毛色正常,摄食、饮水、排泄及活动正常。
2.2 组织病理形态学
B组肿瘤细胞数目多,排列紧密,细胞核深染;C组、D1组、D2组、D3组肿瘤细胞胞核固缩、胞质疏松,可见凋亡、坏死的肿瘤细胞。详见图1。

图1 各组小鼠肿瘤组织病理形态学变化(HE,×200)Fig.1 Histopathology of tumor tissue of mice in each group(HE staining,×200)
2.3 细胞凋亡
B 组移植瘤凋亡细胞核呈棕色或黑色阳性表达,细胞核突出于细胞边缘,未凋亡细胞核为蓝色;C 组、D1组、D2组移植瘤组织凋亡细胞显著增多,凋亡率显著升高(P<0.01)。详见表2和图2。

图2 各组小鼠移植瘤细胞凋亡情况(Tunel,×400)Fig.2 Apoptosis of transplanted tumor in each group(Tunel staining,×400)
2.4 抑瘤率
与B组比较,C组及D1组荷瘤小鼠瘤体质量显著降低(P <0.01或P <0.05);各用药组抑瘤率见表2。
表2 各组抑瘤率及细胞凋亡率比较(±s,n=10)Tab.2 Comparison of tumor inhibition rate and apoptosis rate in each group(±s,n=10)

表2 各组抑瘤率及细胞凋亡率比较(±s,n=10)Tab.2 Comparison of tumor inhibition rate and apoptosis rate in each group(±s,n=10)
注:与B组比较,*P <0.05,**P <0.01。表3同。Note:Compared with those in group B,*P <0.05,**P <0.01(for Tab.2-3).
组别B组C组D1组D2组D3组剂量(g/kg)0.02 100 80 40体质量(g)实验前21.03±1.16 21.62±2.05 20.65±1.37 20.73±1.21 20.27±1.33实验后29.46±4.80 26.37±5.13*29.75±6.20 30.08±4.90 30.71±3.17瘤体质量(g)1.87±0.21 0.87±0.38**1.18±0.64*1.68±0.71 1.83±0.59抑瘤率(%)53.26 36.85 10.29 2.18细胞凋亡率(%)5.21±1.16 18.57±2.42**17.66±2.81**10.08±1.95**6.47±1.20
2.5 血清IL-2 和TNF-α 水平
与A组比较,B组小鼠血清IL-2和TNF-α水平均显著降低(P <0.01);与B组比较,D1组小鼠血清IL-2水平显著升高(P <0.05),C 组、D1组及D2组小鼠血清TNF-α水平均显著升高(P <0.01)。详见表3。
表3 各组小鼠血清中IL-2和TNF-α水平比较(±s,pg/mL n=10)Tab.3 Comparison of serum IL-2 and TNF-α levels in each group(±s,pg/mL,n=10)
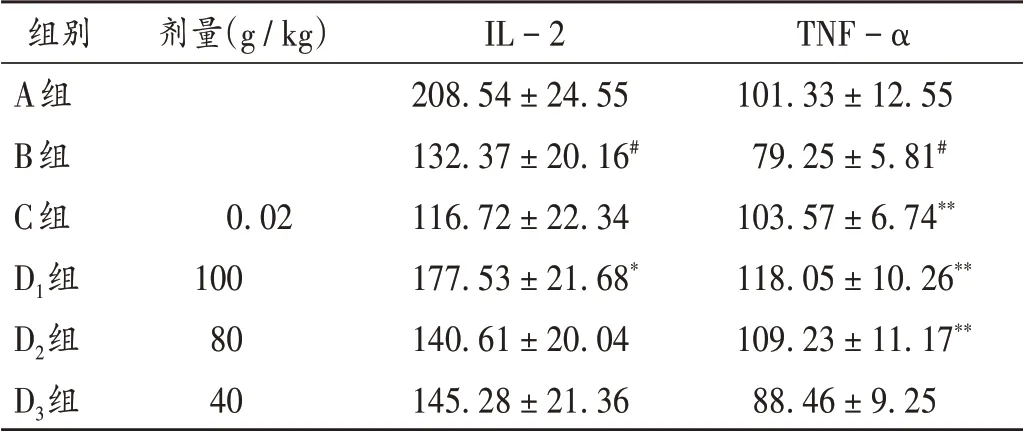
表3 各组小鼠血清中IL-2和TNF-α水平比较(±s,pg/mL n=10)Tab.3 Comparison of serum IL-2 and TNF-α levels in each group(±s,pg/mL,n=10)
注:与A组比较,#P <0.01。Note:Compared with those in group A,#P <0.01.
组别A组B组C组D1组D2组D3组剂量(g/kg)0.02 100 80 40 IL-2 208.54±24.55 132.37±20.16#116.72±22.34 177.53±21.68*140.61±20.04 145.28±21.36 TNF-α 101.33±12.55 79.25±5.81#103.57±6.74**118.05±10.26**109.23±11.17**88.46±9.25
3 讨论
本研究中计算出LD50,为后续制剂研制剂量的设置提供了依据,其长期毒性还需进一步考察。抗肿瘤活性研究中,花椒根总生物碱高剂量组荷瘤小鼠瘤体质量显著减轻,结合HE 及Tunel 染色结果可见,花椒根总生物碱对H22移植瘤的生长有一定抑制作用。
IL-2 是由辅助性T 细胞1(Th1)分泌产生的参与免疫应答的重要细胞因子,对T 细胞和自然杀伤细胞的增殖、活化具有良好的促进作用[10];TNF-α 可促使肿瘤细胞的溶酶体破裂,释放出水解酶而使肿瘤细胞溶解,同时可参与IL-6,IL-8 等细胞因子的激活而诱导肿瘤细胞凋亡[11]。本研究结果显示,花椒根总生物碱高剂量组小鼠血清IL-2 水平明显升高,花椒根总生物碱高、中剂量组小鼠血清TNF-α 水平均明显,升高,说明花椒根总生物碱可能通过调节血清中IL-2和TNF-α 水平来增强机体的免疫应答能力,促进其抗肿瘤活性。
肿瘤细胞增殖与凋亡失衡决定了肿瘤的生长速率。细胞凋亡即细胞程序性死亡,诱导肿瘤细胞凋亡是当前抗肿瘤药研发的重要策略之一[12]。本研究中花椒根总生物碱干预后细胞凋亡率明显升高,表明花椒根总生物碱具有促进肿瘤细胞凋亡的作用,其激活凋亡途径而最终促进细胞凋亡的机制尚待进一步研究。
综上所述,花椒根总生物碱具有体内抗肿瘤作用,其机制可能与增强机体细胞免疫功能及促进肿瘤细胞凋亡有关。

