枸橘苷对人骨肉瘤U-2 OS 细胞的抑制作用*
唐 捷,张丕军,林 维,李超艺
(海南医学院第二附属医院骨科二区,海南 海口 570311)
1 材料与方法
1.1 仪器、试药与细胞
仪器:Thermo HERA cell 150i型细胞培养箱、7500型反转录聚合酶链反应仪(美国Thermo Fisher Scientific公司),Read Max 1900 plus 型酶标仪(上海闪谱生物科技有限公司);DS-500 型微量分光光度计(屹谱仪器制造<上海>有限公司);PowerPac Universa1 型电泳仪(美国Bio - Rad 公司);Tanon 4800 型化学发光成像仪(上海天能科技有限公司);MF43-M 型显微镜(广州市明美光电技术有限公司)。
试药:枸橘苷(成都仪睿生物科技有限公司,批号为DG0073,含量≥98%);CCK- 8 试剂盒(上海碧云天生物技术有限公司,批号为C0037);FBXO2过表达载体(pLVX - EGFP - C1 - FBXO2)和阴性对照(pLVX -EGFP-C1,NC)及两者对应的慢病毒包装(汉恒生物科技<上海>有限公司);Trizol 试剂(美国Thermo Fisher Scientific 公司,批号为15536749);2 × SYBR Green qP‐CR Master Mix(美国Bimake 公司,批号为B21202);FBXO2 抗体(批号为ab133717)、LC3B 抗体(批号为ab192890)、Beclin1 抗体(批号为ab210498)、p62 抗体(批号为ab109012),均购自英国Abcam公司;p-STAT3抗体(批号为4074s)、STAT3 抗体(批号为9139s),均购自美国Cell Signaling Technology 公司;GAPDH 抗体(武汉三鹰生物技术有限公司,批号为10494-1-AP);超敏ECL 化学发光工作液(上海翊圣生物科技有限公司,批号为36208ES60)。
细胞:人骨肉瘤细胞株U - 2 OS(上海继和生物科技有限公司)。
1.2 方法
1.2.1 细胞培养
U - 2 OS 细胞用含10%胎牛血清(FBS)的RPMI 1640 培养基,于37 ℃及5% CO2培养箱中培养。待细胞密度为80%~90%时,用胰酶液消化细胞,以含10%FBS 的RPMI 1640 培养基重悬细胞,按1∶3 比例传代培养。
1.2.2 枸橘苷对U-2 OS 细胞的半数抑制浓度(IC50)
收集不良反应监测数据库中我院2016-2017年89位患者在接受121例/次化疗过程中所出现的Ⅳ度骨髓抑制不良反应病例,化疗前患者血象正常,且KPS评分在70分及以上。收集统计患者的一般情况、肿瘤类型、化疗方案及治疗方案的临床用药问题数据资料,分析骨髓抑制的发生特点、相关影响因素及用药合理性。根据世界卫生组织(WHO)分度标准,血红蛋白<65g/L,或白细胞计数<1.0×109L-1或绝对中性粒细胞计数<0.5×109L-1,或血小板计数<25×109L-1为化疗所致毒性反应分级的Ⅳ度骨髓抑制。患者既往治疗历史见表1。
取对数生长期的U - 2 OS 细胞,接种至96 孔板中(5×103个/孔),于37 ℃及5% CO2培养箱中继续培养24 h。将细胞分为枸橘苷①组、②组、③组、④组、⑤组、⑥组、⑦组(分别予枸橘苷0,5,10,20,40,80,160 μmol/L),每组设3个复孔。另设空白组,仅有培养基和枸橘苷溶液。每孔加入相应药液继续培养24 h,再加入10 μL CCK-8反应液,37 ℃孵育4 h后,检测450 nm波长处的吸光度(OD),平行操作3 次。细胞活力(%)=(OD枸橘苷组-OD空白组)/(OD枸橘苷①组-OD空白组)×100%,以GraphPad Prism 5.0软件计算枸橘苷对U-2 OS细胞的IC50。
1.2.3 U-2 OS 细胞实验
分组:分为空白对照组[等体积磷酸盐缓冲液(PBS)]和枸橘苷低、高剂量组(26 μmol/L和52 μmol/L)。
细胞活力:采用CCK - 8 法检测。取对数期生长的U - 2 OS 细胞,接种至96 孔板中(5 × 103个/ 孔),于37 ℃及5% CO2培养箱中分别培养0,24,48,72 h;每孔加入10 μL CCK-8 反应液,37 ℃培养箱中孵育4 h,检测各孔在450 nm波长处的OD。每组设3个复孔,实验重复3次。
细胞增殖:采用集落形成实验。取对数生长期的U- 2 OS 细胞,接种至24 孔板中(300 个/ 孔),于37 ℃及5% CO2培养箱中连续培养2 周。弃去培养基,以4%多聚甲醛固定细胞,用0.1%结晶紫染液染色1 h,以流水缓慢洗去染液,室温下干燥。记录各组细胞克隆形成数。
FBXO2 mRNA 表达水平:采用反转录聚合酶链反应(RT - PCR)法。收集转染后的U - 2 OS 细胞,采用Trizol 法提取总RNA。采用微量分光光度计测定RNA的浓度,并反转录制备cDNA。引物序列,FBXO2,上游(5′ - 3′)ACTTGGAAGGCTGGTGTGAC,下游(5′ - 3′)TCAAAGGAGGAGGCGAAGTA;GAPDH,上游(5′ - 3′)GGGAAGGTGAAGGTCGGAGT,下游(5′ - 3′)GGGGT‐CATTGATGGCAACA。反应程序,95 ℃、5 min;95 ℃、15 s,60 ℃、30 s,72 ℃、30 s,40 个循环;95 ℃、15 s;60 ℃、60 s;95 ℃、15 s。以GAPDH 为内参,采用2-ΔΔCt法计算FBXO2 mRNA的相对表达水平。
细胞中FBXO2,LC3Ⅰ,LC3Ⅱ,Beclin 1,p62,p -STAT3,STAT3蛋白表达水平:采用Western blot法。收集U-2 OS细胞,以RIPA裂解液裂解细胞。4 ℃、12 000 r /min离心20 min,取上清液,采用BCA 法检测蛋白含量。取30 μg 上样,10%SDS-PAGE 电泳后电转。以封闭液室温封闭2 h,加入FBXO2(1∶1 000,V/V),LC3B(1∶1 000,V/V),Beclin1(1∶1 000,V/V),p62(1∶1 000,V/V),p - STAT3(1∶2 000,V/V),STAT3(1∶2 000,V/V),GAPDH(1∶5 000,V/V)抗体,4 ℃孵育过夜。以辣根过氧化物酶标记二抗(1∶2 000,V/V)室温孵育1 h。加超敏ECL化学发光工作液,采用化学发光成像仪检测蛋白条带。通过Image J软件将条带灰度值数字化,目的条带与内参条带灰度比值为各目的蛋白的相对表达水平。
1.2.4 慢病毒转染细胞实验
分组:分为枸橘苷组(A组)、空白对照组(B组)、枸橘苷对照组(C 组,52 μmol / L)、枸橘苷+ FBXO2 组(D 组,52 μmol/L)。A 组仅加入枸橘苷(52 μmol/L)及相应培养基;B组仅加入等体积PBS及相应培养基。
慢病毒转染:取对数生长期的U-2 OS 细胞,接种至96 孔板中(4×105个/孔),于37 ℃及5%CO2培养箱中培养48 h;弃去旧培养基,加入含5 μg/mL polybrene和2% FBS 的RPMI 1640 培养基,C 组加入50 MOI NC(pLVX-EGFP-C1),D组加入50 MOI FBXO2(pLVXEGFP - C1 - FBXO2),B 组加入等体积PBS,4 组均培养48 h;弃去旧培养基,更换含10% FBS 的RPMI 1640培养基,各孔加入相应药液,继续培养48 h。
检测指标及方法:同1.2.3项。
1.3 统计学处理
采用SPSS 21.0 统计学软件分析。计量资料以±s表示,组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 U-2 OS 细胞实验
IC50实验结果显示,枸橘苷对U - 2 OS 细胞的IC50为52.08 μmol/ L。故后续实验中枸橘苷对U - 2 OS 细胞的抑制浓度选用为26,52 μmol/L。
细胞活力和增殖:与空白对照组比较,枸橘苷低、高剂量组U-2 OS 细胞在24,48,72 h 时的细胞活力显著减弱,克隆形成数显著减少(P<0.05)。详见图1。
细胞自噬:与空白对照组比较,枸橘苷低、高剂量组U-2 OS细胞中LC3Ⅱ/LC3Ⅰ和Beclin1蛋白表达水平均显著升高(P<0.05),p62 蛋白表达水平显著降低(P<0.05)。详见图2。
细胞中FBXO2 表达和STAT3 通路:与空白对照组比较,枸橘苷低、高剂量组U - 2 OS 细胞中FBXO2 mRNA 和蛋白表达水平显著降低(P<0.05),p -STAT3/STAT3显著降低(P<0.05)。详见图3。
2.2 慢病毒转染细胞实验
细胞活力和增殖:与B 组比较,A 组U - 2 OS 细胞在培养24,48,72 h 时活力显著减弱(P<0.05),克隆形成数显著减少(P<0.05);与C 组比较,D 组U-2 OS细胞在24,48,72 h 时的细胞活力显著增强(P<0.05),克隆形成数显著增加(P<0.05)。详见图4。
细胞中FBXO2 mRNA 和蛋白表达:与B 组比较,A 组U-2 OS 细胞中FBXO2 mRNA 和蛋白表达水平显著降低(P<0.05);与C 组比较,D 组U - 2 OS 细胞中FBXO2 mRNA 和蛋白表达水平均显著升高(P<0.05)。详见图5。
细胞自噬:与B 组比较,A 组U - 2 OS 细胞中LC3Ⅱ/LC3Ⅰ和Beclin1蛋白表达水平均显著升高(P<0.05),p62 蛋白表达水平显著降低(P<0.05);与C 组比较,D 组U-2 OS 细胞中LC3Ⅱ/LC3Ⅰ和Beclin1 蛋白表达水平均显著降低(P<0.05),p62 蛋白表达水平显著升高(P<0.05)。详见图6。
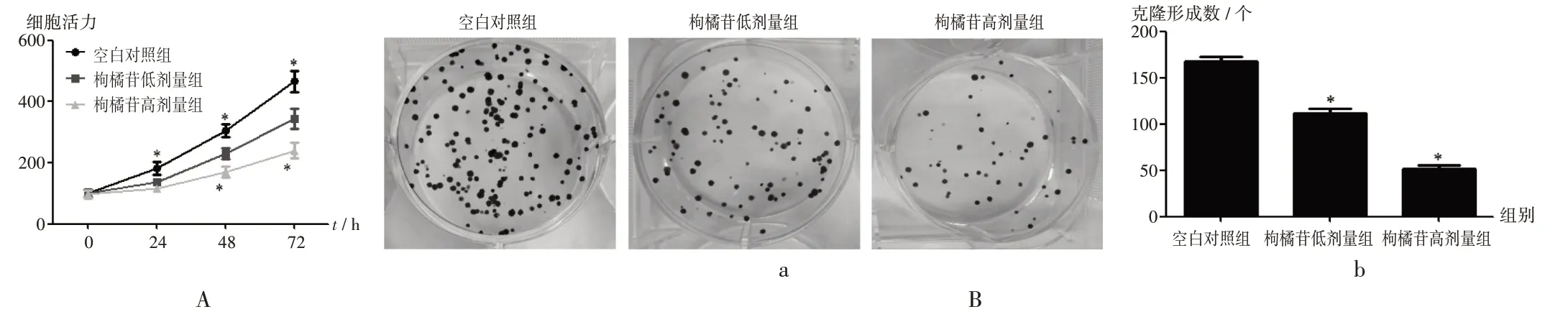
a.显微镜视野 b.统计数据A.细胞活力 B.细胞增殖注:与空白对照组比较,*P <0.05。图2、图3同。图1 枸橘苷对U-2 OS细胞活力和增殖的影响a.Field of microscope b.Statistical dataA.Cell viability B.Cell proliferationNote:Compared with those in the blank control group,*P <0.05(for Fig.1-3).Fig.1 Effect of poncirin on the viability and proliferation of U-2 OS cells

1.空白对照组 2.枸橘苷低剂量组 3.枸橘苷高剂量组A.电泳图 B.LC3Ⅱ/ LC3Ⅰ C.Beclin1、p62蛋白表达图2 枸橘苷对U-2 OS细胞自噬的影响1.Blank control group 2.Poncirin low-dose group 3.Poncirin high - dose groupA.Electrophoretogram B.LC3 Ⅱ/LC3 Ⅰ C.Expression of Beclin1 and p62 proteinFig.2 Effect of poncirin on the autophagy of U-2 OS cells
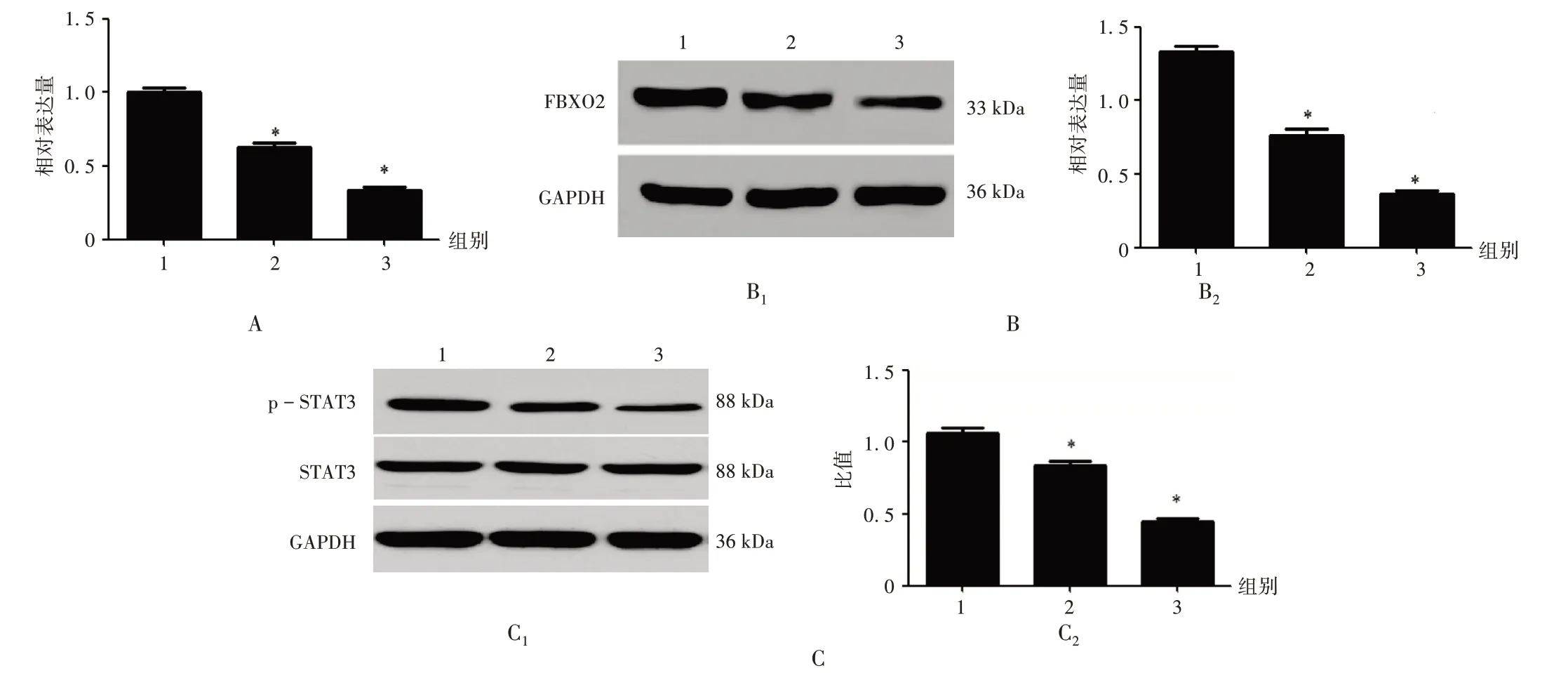
1.空白对照组 2.枸橘苷低剂量组 3.枸橘苷高剂量组B1,C1.电泳图 B2,C2.统计数据A.FBXO2 mRNA表达 B.FBXO2蛋白表达 C.p - STAT3 / STAT3图3 枸橘苷对U-2 OS细胞FBXO2表达和STAT3通路的影响1.Blank control group 2.Poncirin low-dose group 3.Poncirin high-dose groupB1,C1.Electrophoretogram B2,C2.Statistical dataA.Expression of FBXO2 mRNA B.Expression of FBXO2 protein C.p-STAT3/STAT3Fig.3 Effect of poncirin on the FBXO2 expression and STAT3 pathway in U-2 OS cells
慢病毒转染细胞STAT3 通路:与B 组比较,A 组U-2 OS细胞中p-STAT3/ STAT3显著降低(P<0.05);与C 组比较,D 组U-2 OS 细胞中p-STAT3/STAT3 显著升高(P<0.05)。详见图7。
3 讨论
骨肉瘤是原发性骨癌的一种高分级形式,约20%的患者诊断时发现已转移[7]。现临床采用手术切除原发性肿瘤联合化疗,但约1/3的患者出现转移性疾病[8]。
类黄酮属多酚类化合物,包括黄烷酮类、黄烷醇类、花青素类、原花青素类、异黄酮类等成分[9]。枸橘苷属富含黄烷酮的苷类物质,可通过介导胃癌细胞凋亡而发挥抗肿瘤作用[10]。此外,枸橘苷可增强顺铂耐药骨肉瘤细胞对顺铂的敏感性,促进细胞凋亡[11]。自噬在肿瘤细胞迁移和侵袭、肿瘤干细胞维持、治疗抵抗及肿瘤细胞与其微环境之间的交互作用中发挥了关键作用[12]。有研究表明,虎杖苷可显著抑制骨肉瘤细胞的增殖,增加其自噬通量;暴露于自噬抑制剂3- 甲基腺嘌呤后,虎杖苷诱导的细胞自噬显著减弱,而细胞存活率升高[13]。本研究结果显示,枸橘苷可抑制U-2 OS 细胞增殖,提高U-2 OS 细胞中LC3Ⅱ/LC3Ⅰ和Beclin1 蛋白的表达水平,抑制p62 蛋白表达水平的升高,提示枸橘苷可抑制U-2 OS细胞增殖并诱导细胞自噬。

b1.电泳图 b2.统计数据a.FBXO2 mRNA表达 b.FBXO2蛋白表达图5 U-2 OS细胞中FBXO2的表达b1.Electrophoretogram b2.Statistical dataa.Expression of FBXO2 mRNA b.Expression of FBXO2 proteinFig.5 Expression of FBXO2 in U-2 OS cells

a.显微镜视野 b.细胞克隆统计 c.细胞活力图4 过表达FBXO2逆转枸橘苷对U-2 OS细胞增殖的影响注:与B组比较,*P <0.05;与C组比较,#P <0.05。图5至图7同。a.Field of microscope b.Statistics data of clone cells c.Cell viabilityFig.4 Effect of poncirin on the proliferation of U-2 OS cells by the overexpression of FBXO2 reversesNote:Compared with those in group B,*P <0.05(for Fig.4-7);Compared with those in group C,#P <0.05(for Fig.4-7).
大多数F-box 蛋白通过调控参与肿瘤标志性途径底物的表达,促进肿瘤细胞的生长、增殖、进展、转移和侵袭[14]。FBXO2 属F - box 蛋白家族,其高表达与大肠癌转移和大肠癌细胞分期密切相关,是大肠癌患者的独立预后因素[15]。在子宫内膜癌中,FBXO2表达的增强与肿瘤分期、肿瘤分级、肿瘤组织学类型及预后不良有关[16]。本研究结果显示,枸橘苷可抑制FBXO2 的表达,提示枸橘苷可通过抑制FBXO2 的表达而抑制U-2 OS细胞的增殖,并诱导其自噬。
STATs是信号传感器和转录激活因子,配体依赖的STATs 调节级联激活,通常与细胞生长、分化的调节有关[17]。STAT 家族成员STAT3 信号通路能调节肿瘤细胞的增殖、生长和凋亡[18]。目前已有研究证明,可通过诱导细胞自噬抑制STAT3磷酸化,从而抑制脑肿瘤细胞的生长,并促进其凋亡[19],激活STAT3 通路可促进U-2 OS细胞的增殖和转移[20]。FBXO2 可通过激活STAT3 通路促进U-2 OS 细胞增殖[21]。本研究结果显示,枸橘苷可抑制U-2 OS细胞中STAT3的磷酸化,提示枸橘苷可通过抑制FBXO2 表达而抑制STAT3 通路的激活,从而在骨肉瘤细胞中发挥抑制作用。
综上所述,枸橘苷可抑制U-2 OS 细胞增殖,并促进其自噬,其机制可能与抑制FBXO2 表达从而抑制STAT3通路激活有关。

a.电泳图 b.LC3Ⅱ/ LC3Ⅰ c.Beclin1,p62蛋白表达图6 过表达FBXO2逆转枸橘苷对U-2 OS细胞自噬的影响a.Electrophoretogram b.LC3 Ⅱ/LC3 Ⅰc.Expression of Beclin1 and p62 proteinsFig.6 Effect of poncirin on the autophagy of U-2 OS cells by the overexpression of FBXO2 reverses
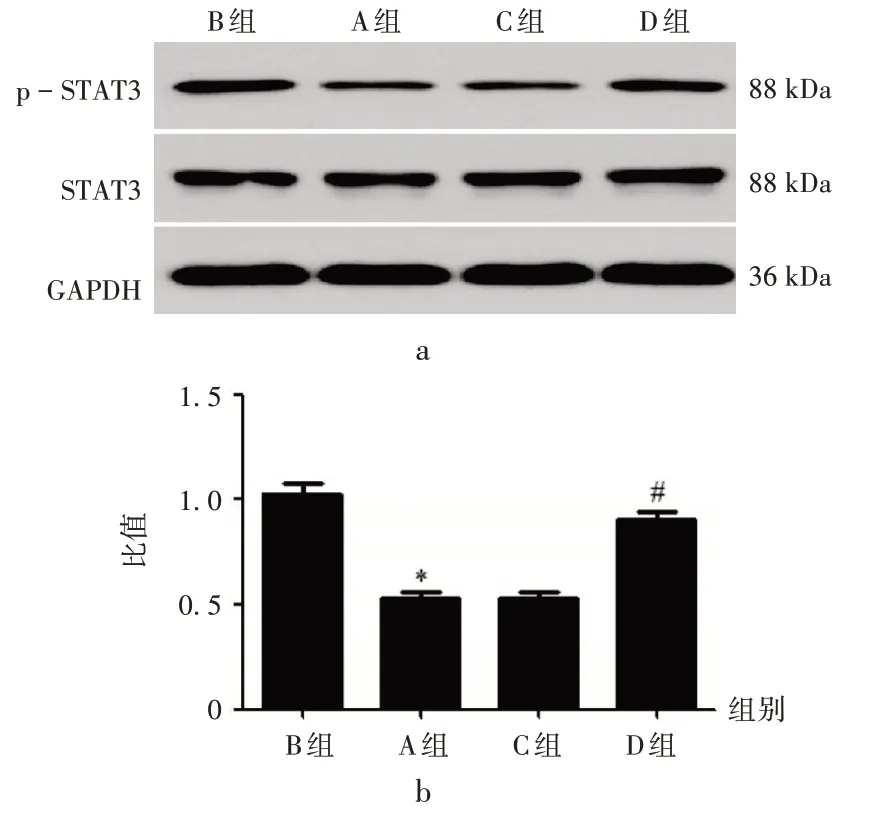
a.电泳图 b.p - STAT3 / STAT3图7 过表达FBXO2逆转枸橘苷对骨肉瘤细胞STAT3通路的影响a.Electrophoretogram b.p-STAT3/STAT3Fig.7 Effect of poncirin on the STAT3 pathway of osteosarcoma cells by the overexpression of FBXO2 reverses

