部分还原氧化石墨烯的制备、表征及对人宫颈癌HeLa细胞的体外杀伤作用
王雪丽,宋相伟,解颜宁,杜妮阳,王振新
(1.吉林工商学院粮食学院,长春 130507;2.长春师范大学生命科学学院,长春 130032;3.中国科学院长春应用化学研究所,长春 130022)
石墨烯因受到其制备方法的制约[1~3]而很难在生物领域实现大规模应用.因此,既具备良好水溶性,又具备与核酸、蛋白质等分子作用能力的氧化石墨烯(GO)相继出现[4].GO自身结构的独特性使其具备了被动靶向运输携载分子的能力,提升了其在药物运输方面的应用潜力.但是,由于GO表面的部分π键被破坏,其传导电子能力比石墨烯弱.利用化学还原法等可将GO还原为部分还原的氧化石墨烯(pRGO)和还原氧化石墨烯(rGO)[5,6].pRGO既保留了GO表面的含氧基团,水分散性良好;又具备较为完整的π键基团,可与DNA等生物分子以非共价键相互作用,成为较易修饰的纳米材料[6].
目前的肿瘤治疗方法多种多样[7~19],但由于疗效不理想及存在副作用,使得研究者聚焦于结合不同治疗方式的协同治疗(Synergistic therapy).以GO和rGO为载体的复合物可以实现光动力治疗(PDT)和光热治疗(PTT)的协同治疗,因而受到广泛关注.
本文以GO为原料,利用温和方法制备了3种部分还原氧化石墨烯(pRGO1—3),并考察了其光热转换能力、单线态氧生成能力及近红外激光照射下的体外细胞杀伤力,希望将pRGO开发为可实现PDT/PTT协同治疗的新型材料.
1 实验部分
1.1 试剂与仪器
氧化石墨购自南京先丰纳米材料公司;单线态氧荧光探针(SOSG)购自Thermo Fisher Scientific公司;HeLa细胞购自南京科佰生物科技有限公司;实验所用其它试剂均为分析纯.
ESCALAB-MKII 250型能谱仪(英国VG公司);Vertex70型傅里叶变换红外光谱仪(德国Bruker公司);Fluke Ti9型红外热像仪(美国福禄克公司);Renishaw 2000型拉曼光谱仪(英国Gloucestershire公司);H600型透射电子显微镜(日本日立公司);Ti-S型倒置荧光显微镜(日本尼康公司);F-280型荧光分光光度计(天津港东科技);1918-C型激光功率计(美国Newport公司).
1.2 实验过程
1.2.1 pRGO1—3的制备 参照文献[6]方法制备pRGO1—3.首先制备1 mg/mL的GO分散液;然后在NaOH浓度分别为10 μmol/L,100 μmol/L和5 mmol/L条件下制备pRGO1,pRGO2和pRGO3.
1.2.2 pRGO1—3的表征 制备1 mg/mL的pRGO1—3贮存液并密封保存,备用.根据实验需要,取一定体积的pRGO1—3贮存液,制备所需的pRGO1—3样品液.分别用紫外可见光谱(UV-Vis)、红外光谱(FTIR)、X射线光电子能谱(XPS)、拉曼光谱(Raman)和透射电子显微镜(TEM)分析测定.
1.2.3 pRGO1—3的稳定性研究 制备20 μg/mL的GO及pRGO1—3的水溶液,分别于制备后的0,1,3,7和14 d测定样品的紫外-可见光谱、红外光谱和透射电子显微镜(TEM).
1.2.4 pRGO1—3的光热性能研究 制备200 μg/mL的GO及pRGO1—3的水溶液,用808 nm(光强计测定功率密度=1.65 W/cm2)光照射,测定并绘制时间-温度曲线.
1.2.5 pRGO1—3的单线态氧检测 将HeLa细胞(1×104个细胞/孔)培养过夜,利用缓冲液洗涤3次,然后用pRGO1—3培养基再培养4 h.采用NIR激光(808 nm,1.65 W/cm2)照射10 min后孵育5 min,用缓冲液洗涤3次,加入10 μmol/L SOSG染色15 min.以488 nm波长光激发后,采用荧光显微镜检测(PBS缓冲液).
1.2.6 pRGO1—3单线态氧生成量的间接检测 将单独的SOSG和SOSG-pRGO1—3复合物经808 nm激光(1.65 W/cm2)照射10 min后;再经488 nm波长光激发,采用荧光光度计检测.
1.2.7 pRGO1—3的细胞毒性实验 无光照条件:分别用含有pRGO1—3的培养基培养细胞4 h,缓冲液洗涤3次,然后用新鲜培养基培养12 h.通过钙黄绿素-AM(Calcein-AM)/碘化丙啶(PI)双染色实验观察细胞存活状态,并用MTT法检测细胞存活率.光照条件:分别用含有pRGO1—3的培养基培养细胞1 h;以808 nm激光(1.65 W/cm2)照射10 min后再孵育5 min,用缓冲液洗涤3次后,加入新鲜培养基继续培养12 h.通过Calcein-AM/PI双染色实验观察细胞存活状态,并用MTT法检测细胞存活率(PBS缓冲液).
2 结果与讨论
2.1 pRGO1—3的结构与形貌表征
图1下方插图显示,GO被部分还原后,颜色逐渐由黄色变为黑色.由图1所示UV-Vis光谱可见,相比于GO的吸收峰(230 nm),pRGO经部分还原后,π共轭体系部分恢复,吸收峰发生红移.还原程度最大的pRGO3的峰位红移至232 nm.GO还原程度的不同会影响石墨烯及其衍生物的NIR吸收性能.pRGO1—3表面官能团逐渐减少,π电子的个数随之增多,产生能级跃迁的概率越高,pRGO1—3在808 nm处的NIR吸收值越强[20,21],由图1上方插图可见,pRGO3的吸收值比pRGO1增大了约5.6倍.
由图2中TEM照片可见,GO与pRGO1—3形貌的差别不显著,均为带有褶皱的半透明薄膜.放置14 d后GO及pRGO1—3的TEM结果如图3所示,其形貌仍为带有褶皱的半透明薄膜.基于pRGO自身结构上的含氧集团,其具有良好的水溶性.测定了GO及pRGO1—3溶于水后14 d内的紫外-可见光谱,结果如表1和图4所示.可见,14 d前后GO及pRGO1—3的吸收峰位置与强度均未出现明显变化,说明pRGO1—3具有较好的稳定性.

Fig.1 UV⁃Vis spectra of GO and pRGO1—3(0.02 mg/mL)

Fig.2 TEM images of GO(A),pRGO1(B),pRGO2(C)and pRGO3(D)

Fig.3 TEM images of GO(A),pRGO1(B),pRGO2(C)and pRGO3(D)after 14 days
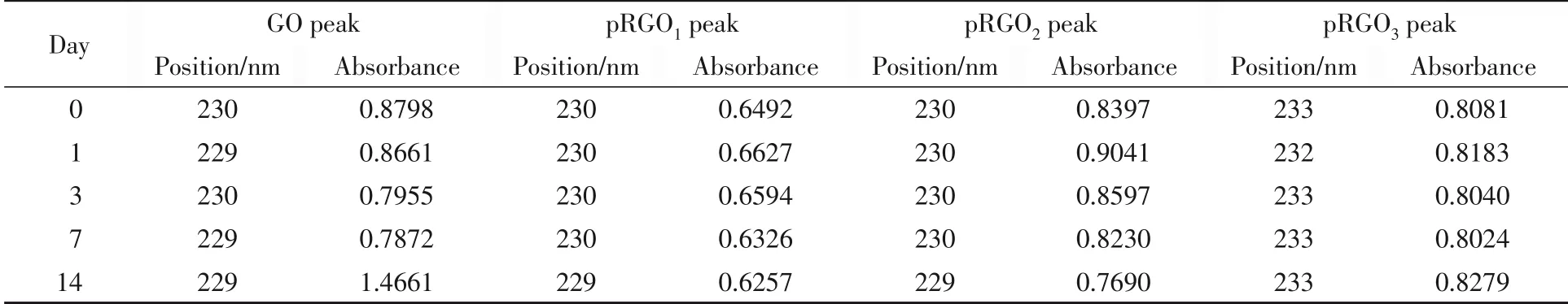
Table 1 Peak position and absorbance of GO and pRGO1—3

Fig.4 Stability of GO(A),pRGO1(B),pRGO2(C)and pRGO3(D)(0.02 mg/mL)in water at different days
图5(A)示出了GO和pRGO1—3的红外光谱表征结果.其中,GO的主要吸收谱带分别位于1070 cm−1(C—O振动),1724 cm−1(C=O振动),1604 cm−1(C=C振动)和3246 cm−1(—OH振动)处[2,3].而pRGO的红外光谱中归属于环氧上C—O的峰(1136 cm−1)消失了,且相比于GO,其它峰位均发生不同程度的红移.图6为放置14 d后GO和pRGO1—3的红外光谱图.可见,放置14 d后峰位变化较小,说明GO和pRGO1—3的稳定性较好.

Fig.5 ATR⁃FTIR spectra(A),Raman spectra(B)and ID/IG(C)of GO and pRGO1—3(200 μg/mL)
采用拉曼光谱研究了C原子晶体的特征峰,GO,pRGO1,pRGO2和pRGO3的拉曼光谱结果示于图5(B).其中,D峰(~1300 cm−1)和G峰(~1680 cm−1)峰强的比值(ID/IG)可用来指征石墨烯结构的变化,含氧功能团减少或者缺陷被修复可导致ID/IG比值降低[4].由图5(C)可见,ID/IG比值由GO的0.93降低到pRGO3的0.84.
GO和pRGO1—3的C1sXPS表征结果如图7所示,可见GO的C1s峰分别位于284.4,284.8,285.9和286.7 eV处,分别归属于C—O,C—C,C=O和O—C=O的结合能[5].pRGO3的C1s峰分别位于284.4,284.8和286.7 eV处,C=O消失了.相比于GO的O/C比值(0.43),pRGO1—3的O/C比值分别为0.41,0.40和0.38,均有所降低,表明其含氧官能团均有所减少.
相应的EDS能谱表征结果如表2所示,相比于GO,pRGO1—3的氧占比逐渐降低,进一步说明pRGO1—3含氧官能团有所减少.

Fig.6 ATR⁃FTIR spectra of GO(A),pRGO1(B),pRGO2(C)and pRGO3(D)before(a)and after(b)14 d
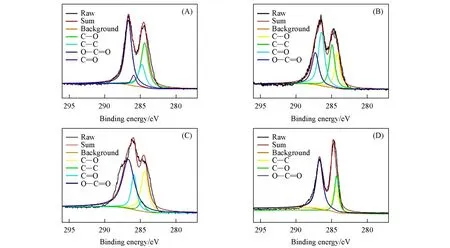
Fig.7 C1s XPS spectra of GO(A),pRGO1(B),pRGO2(C)and pRGO3(D)(200 μg/mL)
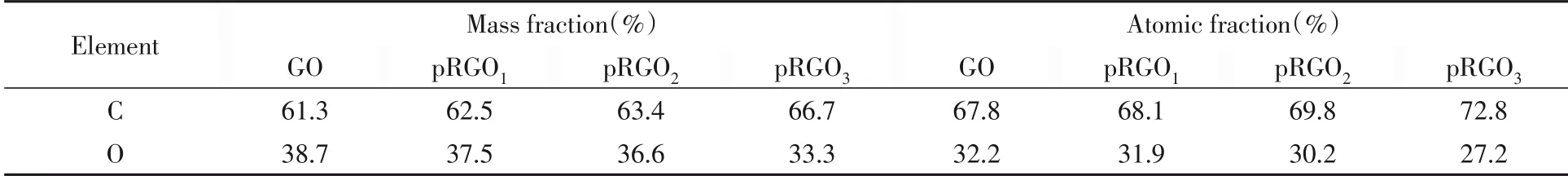
Table 2 EDS data of GO and pRGO1—3
2.2 pRGO1—3的光热转换性能
NIR光吸收的增强使得pRGO溶液显示出高效的光热转化能力.将相同浓度的GO,pRGO1,pRGO2和pRGO3在808 nm光源下以相同功率密度照射10 min后,其温度升高曲线如图8所示.可见,还原程度最大的pRGO3的升温幅度最大,5 min内从25℃升高到45℃.在42~46℃范围内,肿瘤细胞因蛋白功能变化可导致细胞死亡[4].而pRGO1和pRGO2经激光照射后温度升高到约36℃,GO的最高温度则约为30℃.利用下式可计算pRGO1—3的光热转换效率[22]:
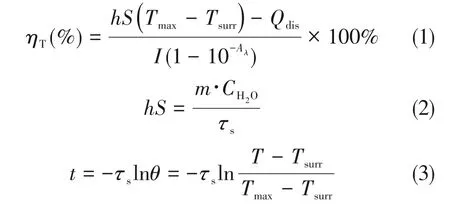
式中:ηT(%)为光热转换效率;h为系统热转换效率;S(m2)为容器的表面积;Tmax(℃)和Tsurr(℃)分别为样品的最高温度和环境温度;I(W)为激光功率;Aλ为激发波长(λ)下样品的吸光度;Qdis(J·s−1)为对照空白样的热量变化.hS通过式(2)计算.其中,m(g)为溶液的质量;CH2O(4.2 J·g−1·℃−1)为水的比热容;τs为系统的时间常数(无量纲),可经式(3)计算.其中,t(s)为冷却过程中的时间;θ为热驱动常数(无量纲);T(℃)为t时刻的即时温度.
经计算得出GO和pRGO1—3的光热转换效率列于表3.其中,pRGO1—3比GO的光热转换能力有所增强.pRGO3的ηT与合成的MOS2纳米球的ηT接近(808 nm,34.46%)[23].pRGO1—3自身具备的光热转换能力及易于修饰的较大表面积使其具有开发成为肿瘤光热疗法新型载体的潜力.

Fig.8 Effects of irradiation time on photothermal heating curves of GO and pRGO1—3

Table 3 Photothermal conversion efficiency of GO and pRGO1—3
2.3 pRGO1—3的细胞毒性
由图9可见,在未经过808 nm激光照射的情况下,当pRGO1—3的培养基浓度低于200 μg/mL时,其培养的HeLa细胞存活率均大于90%;而在经过808 nm激光照射的情况下,当pRGO1—3的浓度逐步增加时,培养的HeLa细胞存活率逐步下降,尤其是当浓度大于200 μg/mL时,其HeLa细胞存活率已降到约50%甚至更低.

Fig.9 Cell viability studies with different concentrations of pRGO1(A),pRGO2(B)and pRGO3(C)
pRGO1—3本身细胞毒性的双染色实验结果如图10(A)所示,未经808 nm激光照射下,pRGO1—3存在时培养的HeLa细胞形态完好,其存活率与对照组基本相同,与MTT实验结果一致,说明pRGO1—3本身的细胞毒性较低.经808 nm激光照射下的实验结果如图10(B)所示,存在pRGO1—3时,培养的HeLa细胞存活率与对照组有较明显的区别.证明pRGO1—3自身的光热效应可杀伤细胞,与MTT实验结果一致.
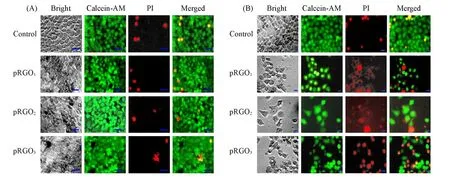
Fig.10 Effect of laser irradiation[wihout(A)and with(B)]on HeLa cell treated with pRGO1—3(scale bar=40 μm)
上述实验结果表明,一定浓度的pRGO1—3在808 nm激光照射下对细胞具备一定的杀伤效果.除了pRGO1—3自身具备的光热转换效应外,也可能是其产生的单线态氧对细胞产生一定的杀伤效果.SOSG与单线态氧作用后可以产生极强的绿色荧光物质SOSG-Endoperoxide(SOSG-EP).如图11(A)所示,pRGO1—3经NIR激光激发后,产生了一定的单线态氧.检测SOSG-EP在488 nm波长激发下的绿色荧光可间接检测反应体系中单线态氧产量[24~26].图11(B)为经NIR照射后反应体系的荧光光谱图,可见,pRGO3反应体系的荧光强度与单独的SOSG相比增强了6.79倍;pRGO1和pRGO2比SOSG分别增大了1.27和2.01倍.
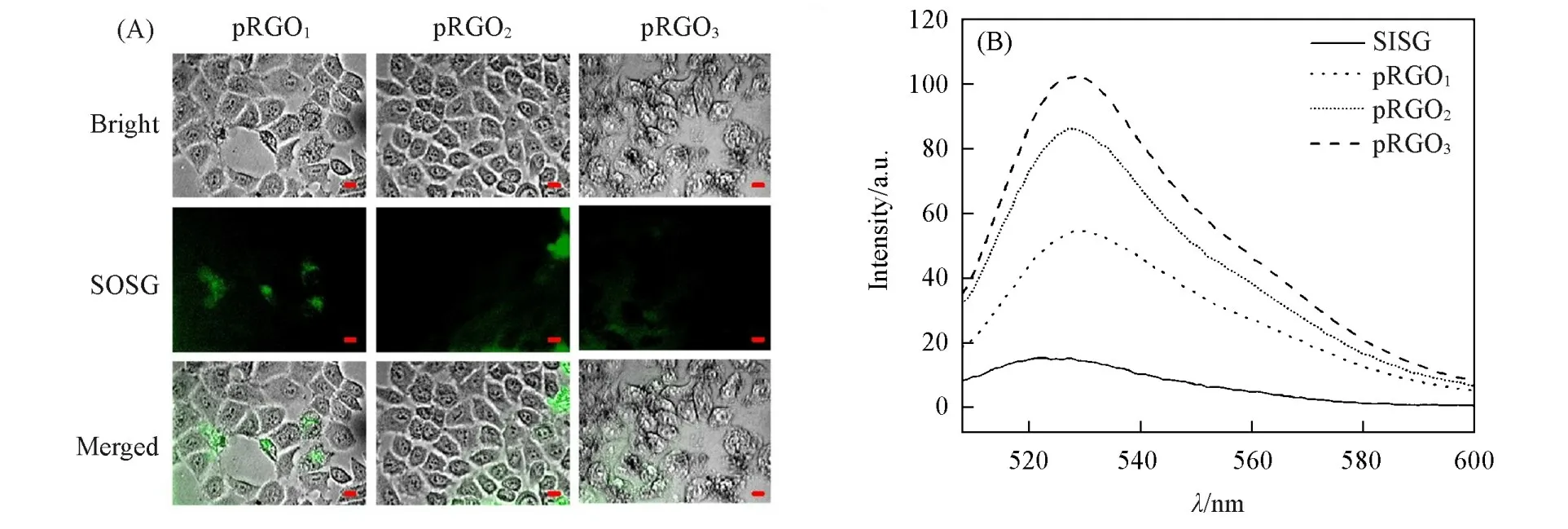
Fig.11 SOSG stained cell images with laser irradiation(scale bar=10 μm)(A)and fluorescence spectra of pRGO1—3⁃SOSG⁃EP after NIR irradiation(B)
3 结 论
利用纳米材料的大分子表面积同时修饰光敏剂/热疗试剂/药物/靶向分子可实现针对肿瘤的协同疗法[27,28].本文考察了pRGO1—3自身的细胞毒性、光热转换效率和单线态氧生成能力,实验结果表明,pRGO1—3自身的细胞毒性低,但是在NIR激光照射下,其自身产生的光热毒性及光毒性具备对细胞的杀伤性.由于pRGO仍具有π共轭体系,可在其表面通过非共价作用修饰具有π共轭结构的适配体等其它分子[29,30],具备成为被动靶向载体的潜力.综上所述,pRGO不仅自身低毒、易修饰,且兼具光热转换能力和一定的光毒效应,有望成为新的纳米载体,实现对肿瘤细胞PTT/PDT的协同靶向治疗.

