建构思维模型 突破除杂问题
邓君 张军平

无机工艺流程题近年来一直是高考试题的宠儿,试题取材于生产实际,内容涉猎面广,考查同学们化学双基知识的学习情况和应用所学知识解决化工生产中有关问题的迁移推理、联想能力,但是同学们普遍得分率不高。本文总结近年来(2016-2021年)全国卷无机工艺流程题考查的内容及所含主要杂质(如表1),试题一般以陌生元素或陌生化合物知识为载体,多次考查到硅、铝、铁氧化物杂质的去除问题,最终得到目标产物。面对此类问题,只要我们熟悉化工流程题的基本结构,建构模型,应用模型,就有信心攻克无机工艺流程题。
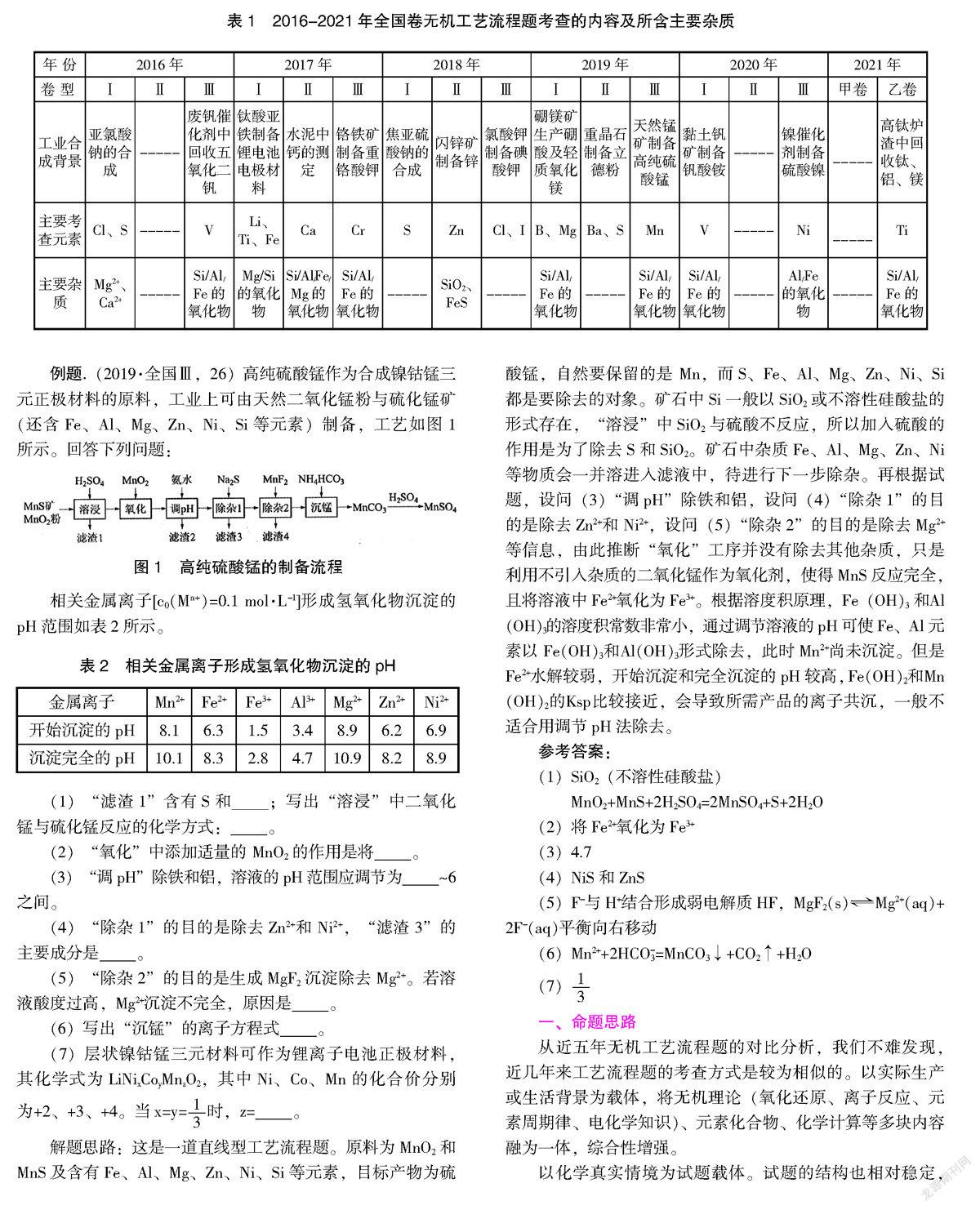
例题.(2019·全国Ⅲ,26)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图1所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如表2所示。
(1)“滤渣1”含有S和;写出“溶浸”中二氧化锰与硫化锰反应的化学方式:。
(2)“氧化”中添加适量的 MnO2的作用是将。
(3)“调pH”除铁和铝,溶液的pH范围应调节为~6之间。
(4)“除杂1”的目的是除去Zn2+和 Ni2+,“滤渣3”的主要成分是。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是。
(6)写出“沉锰”的离子方程式。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=时,z= 。
解题思路:这是一道直线型工艺流程题。原料为MnO2和MnS及含有Fe、Al、Mg、Zn、Ni、Si等元素,目标产物为硫酸锰,自然要保留的是 Mn,而S、Fe、Al、Mg、Zn、Ni、Si都是要除去的对象。矿石中Si一般以SiO2或不溶性硅酸盐的形式存在,“溶浸”中SiO2与硫酸不反应,所以加入硫酸的作用是为了除去S和SiO2。矿石中杂质Fe、Al、Mg、Zn、Ni等物质会一并溶进入滤液中,待进行下一步除杂。再根据试题,设问(3)“调pH”除铁和铝,设问(4)“除杂1”的目的是除去Zn2+和 Ni2+,设问(5)“除杂2”的目的是除去Mg2+等信息,由此推断“氧化”工序并没有除去其他杂质,只是利用不引入杂质的二氧化锰作为氧化剂,使得MnS反应完全,且将溶液中Fe2+氧化为Fe3+。根据溶度积原理,Fe(OH)3和Al(OH)3的溶度积常数非常小,通过调节溶液的pH可使Fe、Al元素以 Fe(OH)3和Al(OH)3形式除去,此时Mn2+尚未沉淀。但是Fe2+水解较弱,开始沉淀和完全沉淀的pH较高,Fe(OH)2和Mn(OH)2的Ksp比较接近,会导致所需产品的离子共沉,一般不适合用调节pH法除去。
参考答案:
(1)SiO2(不溶性硅酸盐)
MnO2+MnS+2H2SO4=2MnSO4+S+2H2O
(2)将Fe2+氧化为Fe3+
(3)4.7
(4)NiS和ZnS
(5)F-与H+结合形成弱电解质HF,MgF2(s)?葑Mg2+(aq)+2F-(aq)平衡向右移动
(6)Mn2++2HC=MnCO3↓+CO2↑+H2O
(7)
一、命题思路
从近五年无机工艺流程题的对比分析,我们不难发现,近几年来工艺流程题的考查方式是较为相似的。以实际生产或生活背景为载体,将无机理论(氧化还原、离子反应、元素周期律、电化学知识)、元素化合物、化学计算等多块内容融为一体,综合性增强。
以化学真实情境为试题载体。试题的结构也相对稳定,一般如下:原料介绍→原料处理→物质转化及分离提纯→产品分析。大多数题目都是从矿石中提纯或转化得到最终产品。
矿物是地壳中各种地质作用的产物,所以地壳的化学成分限制了矿物的化学成分。O、Si、Al、Fe、Ca、Na、K、Mg这八种元素约占地壳总重量的98%,其中O占地壳重量的一半,Si占地壳重量的1/4多(如图2)。可以说地壳由O的阴离子组成,金属阳离子(Si、Al、K、Na、Ca等)充填其空隙中,故矿石中一般含有SiO2、Al2O3、FeO、Fe2O3等杂质。
纵观这五年的工艺流程题,试题情境的搭建,都紧密联系学生学习和生活生产实际,体现科学,技术,社会和环境发展的成果。整体来说,工艺流程的载体均以课本熟悉元素和课外陌生元素,联系生产实际而设计的整体框架。
二、除杂方法——调节溶液pH
一般来说,含有易溶于酸或碱成分的矿石,利用混合物中各组分酸碱性质的不同,先用酸或碱溶浸进行原料预处理后,再进行净化除杂。矿石中常含有SiO2、Al2O3、FeO、Fe2O3等杂质,SiO2为酸性氧化物,Al2O3为两性氧化物,FeO、Fe2O3为碱性氧化物,用碱或酸处理,从而将物质分离开。
对例题中表2的数据作图,如图3所示。图3中横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值,斜线表示不同金属离子形成氢氧化物沉淀的平衡线,斜线顶端的横坐标数值是开始(离子浓度为0.1 mol·L-1)产生氢氧化物沉淀的pH,而底端横坐标数值为沉淀完全(离子浓度≤1×10-5 mol·L-1,即可认为该离子沉淀完全)的pH。显然,一种离子开始沉淀(直线顶端)和另一离子沉淀完全(直线底端)的pH离得越近,用沉淀法对它们进行分离的难度就越大。
像Al3+、Fe3+,具有电荷数大、半径小,有较强极化力的阳离子,常常通过结合水电离出的OH-而水解的方法除去。但是,极化力较小、水解程度不大的Fe2+,一般不通过水解法除去,如Fe(OH)2和Zn(OH)2的 Ksp非常接近,无法达到分离的目的。工艺流程中,一般加入氧化剂将Fe2+氧化为Fe3+,再加入相应的除杂试剂碳酸盐或氢氧化物或金属氧化物等,主要目的是调节溶液pH且不引入新杂质,促进Fe3+水解转变为Fe(OH)3沉淀分离除去。
然而,个别同学还可能有一些困惑:Al3+、Fe3+怎么能在酸性溶液中形成氢氧化物沉淀呢? 会不会发生酸碱中和呢?由于这些金属氢氧化物的 Ksp较小,当满足Qc>Ksp时,金属离子开始沉淀甚至完全沉淀,溶液可能仍然处于酸性环境。
三、构建除杂思维模型
某矿石中主要成分为XO(二价金属氧化物),还含有SiO2、Al2O3、FeO、Fe2O3、YO(陌生二价金属氧化物)等杂质,构建除去硅、铝、铁氧化物的两种基本思维模型(如图4、5)。氧化剂可选择绿色氧化剂,如H2O2、O2等,也可选择不引入杂质、降低成本情况下合适的氧化剂,如KMnO4、MnO2、HNO3、NaClO3等。调节溶液pH的试剂可选择含有被提纯金属离子的碳酸盐、氢氧化物、金属氧化物中的一种,也可选择不引入杂质、降低成本情况下合适的碱,如NaOH、KOH、NH3·H2O等。再根据题目信息,利用沉淀法或还原法等除去Y。
成功没有捷径,但一定有方法。整体来看,对于解答此种类型题,工艺流程题的基本策略是首先要提取题干信息,了解生产的产品,再分析流程步骤,全方位了解流程,再根据试题设问及要求,从问题中提炼答题信息。有了简单易掌握的思维模型,同学们面对此类工艺流程题时,即使在高考中面对陌生知识或陌生情境,也能触类旁通,从容应对,正确作答。
責任编辑 李平安

