内镜黏膜下剥离术治疗≥40 mm隆起型结直肠肿瘤的疗效评价
翁烃 姚高妍
内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)在国内外被广泛用于治疗消化道病变,具有创伤小、并发症少、不影响生活质量等优点,现已成为内镜下微创治疗的主要方式。随着内镜技术的成熟,ESD 治疗的成功率进一步提高,部分肠道大病灶也可在ESD 下安全切除,但相关不良事件仍无法完全避免。随着结直肠病灶的增大,整块切除率、R0切除率随之下降,不良事件发生率增加[1]。ESD 治疗≥40 mm 的结直肠侧向发育型肿瘤(laterally spreading tumor,LST)已被研究证实是安全有效的[2],但隆起型肿瘤的相关研究较少。本研究回顾性收集并分析35 例接受ESD 或ESD-S 治疗的≥40 mm 的隆起型结直肠肿瘤患者的临床资料,并结合相关文献,探讨其有效性和安全性,以期为临床提供参考,现报道如下。
1 资料与方法
1.1 临床资料 选取2019 年12 月至2022 年9 月在宁波市医疗中心李惠利医院接受ESD 治疗的≥40 mm 结直肠肿瘤患者35 例,其中男性23 例、女性12 例,年龄(60.9±10.1)岁。其中25 例行ESD 治疗,10 例行ESD-S 治疗。纳入的病灶整体往腔内生长,主要指巴黎分型的Is、Ip、Isp 型,长径≥40 mm,排除LST、凹陷型等病灶。病变呈大致均匀分布于结直肠。两组患者在性别、年龄、病灶大小、部位、病理结果方面比较,差异无统计学意义(P>0.05)。见表1。本研究经医院医学伦理委员会批准,所有患者签署知情同意书。
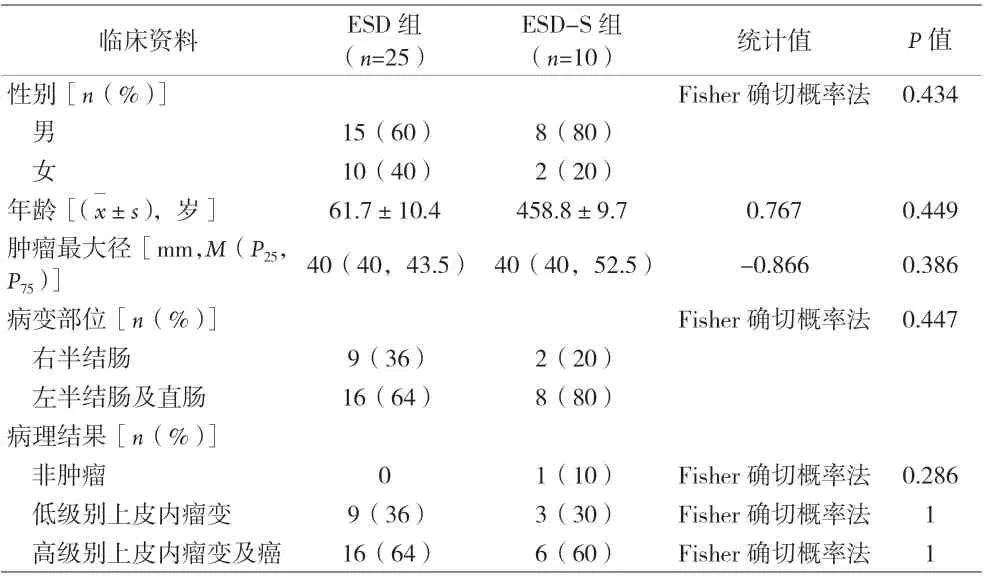
表1 两组患者临床资料比较
1.2 方法 患者在内镜治疗前,均由有经验的内镜医师完成1 次及以上的肠镜检查,用白光及内镜窄带成像术(narrow band imaging,NBI)观察表面,初步评估其类型、部位、大小、深度并记录,在认为可采用ESD 治疗后收住病房。在完善必要的辅助检查,排除内镜禁忌证签署知情同意书后行ESD 或ESD-S 治疗。治疗前再次用白光、NBI、靛胭脂或结晶紫染色评估,必要时借助超声肠镜进一步评估。ESD-S 治疗的方式与ESD 治疗大致相同。不同之处在于,切除病灶到其总大小的四分之一甚至更小的比例后,操作者转而使用圈套器将剩余组织完全分离。术后组织标本送往宁波市病理中心,依照WHO 标准,对标本的组织学分型、大小、切缘、深度等进行评估。病灶大小以ESD 标本展平固定后病理科医师借助标尺肉眼测量的长径表示。根据病理结果,对于腺瘤患者在治疗后1~2 年内复查肠镜,癌变患者在治疗后6 个月、1 年,之后每年复查1 次肠镜。
1.3 观察指标 病灶部位、大小、手术特征(整块切除或分片切除)、病理结果、不良事件(术中出血、术后出血、穿孔)以及禁食时间、术后住院时间和住院费用、术后复发情况。
1.4 统计学方法 采用SPSS 25.0 统计软件。计量资料符合正态分布以(±s)表示,采用t检验;不符合正态分布以[M(P25,P75)]表示,采用非参数检验(Mannwhitney 检验)进行组间比较。计数资料以[n(%)]表示,采用Fisher 确切概率法。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组的手术资料、不良事件、术后情况比较 ESD组和ESD-S 组的整块切除率分别为100%(25/25)和70%(7/10),差异有统计学意义(P=0.018);R0 切除率分别为96%(24/25)和60%(6/10),差异有统计学意义(P=0.017)。ESD 组的不良事件发生率高,其中术中出血率为4%(1/25)、迟发性出血率为4%(1/25)、穿孔率为4%(1/25),ESD-S 组上述并发症发生率均为0,但差异无统计学意义(P>0.05)。两组的术后禁食时间、术后住院时间、住院总费用比较,差异均无统计学意义(P>0.05)。见表2。
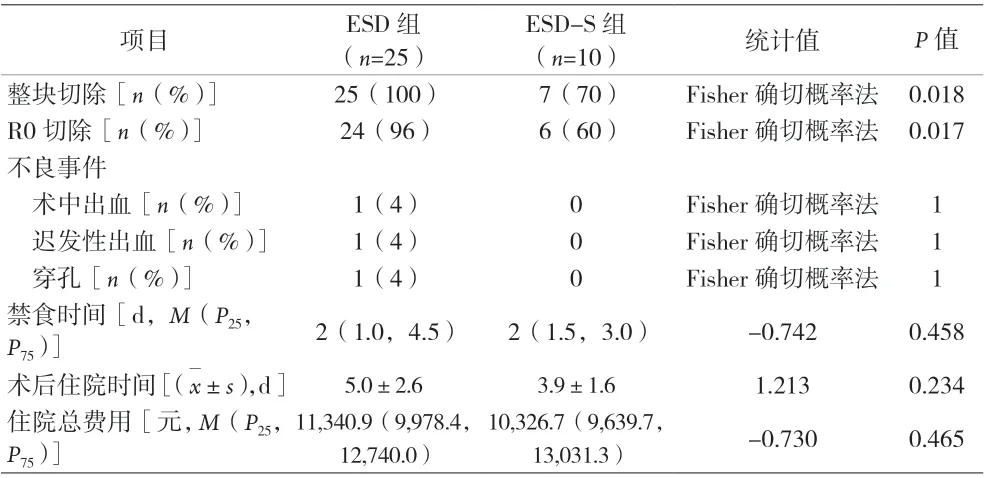
表2 两组的手术资料、不良事件、术后情况比较
2.2 随访情况 ESD 组9 例患者已到复查时间,其中5 例复查肠镜未见复发,4 例失访,另16 例患者因未到复查时间而暂缺随访结果。ESD-S 组6 例患者已到复查时间,其中5 例复查肠镜未见复发,1 例失访,另4例因未到复查时间而暂缺随访结果。
3 讨论
结直肠肿瘤包括结直肠癌和结直肠腺瘤。结直肠癌在全球有着很高的发病率和死亡率[3]。目前公认的结直肠癌发病途径包括腺瘤-腺癌途径、炎-癌途径和de novo(从无到有)途径,其中腺瘤-腺癌途径是最主要的途径。结直肠ESD 治疗的相关研究在世界范围内广泛开展,已被证明是安全有效的。FUCCIO 等[4]的Meta 分析发现亚洲国家肠ESD 的整块切除率和R0切除率显著高于非亚洲国家(93%对81.2%;85.6%对71.3%),且并发症发生率更低(穿孔:4.5%对8.6%;迟发性出血:2.4%对4.2%)。这与本项研究结果相符,本研究纳入的35 例患者,因直径较大,难度高于一般病灶的ESD 治疗,但ESD 整体(ESD+ESD-S)的整块切除率及R0 切除率依旧达到了91.4%和85.7%,术中出血率、迟发性出血率及穿孔率均为2.9%。
HIDEYUKI 等[5]研究发现病灶直径>40 mm 是迟发性出血的危险因素。HONG 等[6]研究发现病灶直径越大,穿孔率越高。对于ESD 治疗≥40 mm 的结直肠隆起型肿瘤,目前相关研究较少。SAKAMOTO 等[7]关于ESD 治疗直径≥20 mm 的隆起型结直肠肿瘤的研究报道,整块切除率、R0 切除率和治愈性切除率分别为88%、82%和59%,穿孔率和中止手术率分别为10%和4%。JUNG 等[8]通过研究接受ESD 治疗的220 例≥30 mm的结直肠肿瘤患者,发现隆起型肿瘤比LST有着更高的黏膜下浸润率(11.9%VS.2.6%)、更低的整块切除率(76.1%VS.92.8%)、更低的R0 切除率(64.2%VS.79.1%)、更高的术中出血率(22.4%VS.2.6%)、更高的迟发性出血率(6.0%VS.0.7%)。上述研究表明ESD治疗隆起型肿瘤的效果和安全性不如LST。FUKUCHI等[9]的研究认为对结直肠0-I 型肿瘤行ESD 治疗有一定的失败风险,因为结直肠0-I 型肿瘤是中断ESD 的独立危险因素。SAKAMOTO 等[7]认为对于大的隆起型肿瘤,若内镜明确考虑深浸润而无法行ESD 治疗,内镜医师不应再犹豫是否行ESD,而是建议患者行外科手术治疗。故对大的隆起型肿瘤行的ESD 治疗重点是需借助NBI、靛胭脂或结晶紫染色、超声内镜、腹部增强CT 等手段选择合适的患者。
TERASAKI 等的研究显示R0 切除率为91.8%对96.4%、出血率为11.5%对0、穿孔率为0 对7.1%,但差异没有统计学意义。基于上述研究,作者认为ESD 和ESD-S 有着相似的高切除率和低不良事件发生率,均被推荐用于较大的肿瘤的治疗。上述研究结果和笔者的研究结果存在一定出入,可能因本中心对于经典的ESD 治疗方式运用更多,从而导致更佳的整块切除率和R0 切除率。此外,对右侧结肠较大病灶的ESD 治疗要尤为慎重。在美国进行的一项纳入13,157 例患者的研究发现,左侧结肠的早期癌或右侧结肠<20 mm 的早期癌,内镜下切除与手术治疗的5 年生存率相同。但位于右侧结肠≥20 mm 的早期癌接受手术治疗时较内镜治疗的5 年生存率较更高(91.8%VS.74.2%),≥40 mm的5 年生存率差距更大(92.4%VS.60%)[10]。并且右侧结肠ESD 的因为肠壁较薄,容易受呼吸运动及心跳影响,操作难度更高,整块切除率及治愈性切除率较低,不良事件发生率较高[11]。
有国内研究显示,接受ESD治疗的≥20 mm隆起型肿瘤均位于左半结肠及直肠,其中5.6%为腺瘤,83.4%为早期癌,11.1%为中晚期癌[12]。这与本研究结果不同,本次纳入的35 例患者中,肿瘤在各个结直肠部位呈相对均匀分布,肠腺瘤占80%,肠腺癌仅占17.1%。推测研究差异可能因地域差距、样本量不同、纳入的长径不同以及病理报告亦有一定的主观性引起。
另外本研究也统计了ESD 治疗的术后禁食时间、术后住院时间及住院费用,ESD 和ESD-S 基本类似,但均远低于行结直肠癌外科手术的相关数据[13-14]。但是ESD 仅能用于治疗结直肠腺瘤及部分早期癌,因此选择适合的患者尤为重要。国内部分患者在肠镜检查发现较大的结直肠肿瘤后,可能直接前往普外科就诊而行外科手术,错失了本可以行ESD 治疗的机会,降低了生活质量,增加了治疗费用。基层医院消化科可能无法开展ESD 治疗或对ESD 治疗的认识不足,转诊患者至外科行手术。因此有必要加大内外科之间的合作,提升大型医院内镜中心和基层内镜中心的联系,从而保证每一个患者接受最合适的治疗方案。
综上所述,本研究因为样本量较少必定存在偏移,但能在一定程度上证明肠镜评估可行ESD 切除的结直肠≥40 mm 隆起型肿瘤,ESD 整体的R0 切除率高,不良事件发生率低,而且术后禁食时间及住院时间较短,住院费用较低。ESD-S 作为ESD 的改良术式,有操作难度相对较低的优势,但是可造成整块切除率及R0 切除率下降。因此,笔者建议结直肠肿瘤患者在经验丰富的内镜中心行肠镜评估,若认为可切除则先行内镜下治疗,并优先经典的ESD 治疗,必要时追加外科手术。

