消瘀泄浊饮对急性肾损伤小鼠自噬水平的影响*
胡佳雯 崔当鸽 周 宇 郑迷雪 项晓骏#
1 浙江中医药大学附属第一医院 浙江 杭州 310006
2 浙江大学医学院附属邵逸夫医院 浙江 杭州 310020
本研究通过采用缺血再灌注法诱导急性肾损伤(AKI)小鼠模型,以期探讨消瘀泄浊饮对AKI小鼠的保护作用和潜在机制。
1 材料与方法
1.1 实验动物:8周龄清洁级雄性C57BL/6小鼠30只。购于上海斯莱克实验动物有限责任公司,动物生产许可证号为SCXK(沪)2017-0005;饲养于杭州鹰旸生物科技有限公司动物中心,动物使用许可证号为SYXK(浙)2020-0024。饲养期间允许自由饮食饮水。
1.2 实验材料:分述如下。
1.2.1 药材:生黄芪15g,川牛膝、桃仁、地龙各6g,制大黄5g,车前草10g,配方药品由医院中药房提供。加水熬制浓缩到500ml,得到浓度为96mg/ml的消瘀泄浊饮。
1.2.2 试剂:小鼠超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮合成酶(NOS)、谷胱甘肽过氧化物酶(GSH-PX)、过氧化氢酶(CAT)、ELISA试剂盒(批号:MM-0389M1、MM-0388M1、MM-0453M1、MM-0758R1,购于酶免)。抗体:LC3A/B、BECLIN 1、SQSTM1/P62、PI3K P85 ALPHA、AKT2、PHOSPHO-MTOR(SER2448)、MTOR、β-ACTIN(批号:AF5402、AF5128、AF5384、AF6241、AF6264、AF3308、AF7803、AF7018,购于 AFFINITY)。山羊抗兔 IGG H&L(HRP)(批号AB97080,购于ABCAM)
1.2.3 设备:C16000型全自动生化检测仪,雅培公司生产;RM2016病理切片机,上海徕卡仪器有限公司生产;NIKON ECLIPSE E100型正置光学显微镜,日本尼康生产;UTP-313型电子天平,上海花潮生产;EPS300型电泳仪、VE186型转膜仪,天能生产。
1.3 实验方法:分述如下。
1.3.1 小鼠AKI模型建立:30只C57BL/6小鼠随机分为5组,术前禁水12小时。腹腔注射戊巴比妥钠麻醉(45mg/kg),备皮,剪开小鼠背部肋骨下缘皮肤,钝性分离输尿管与肾动脉、肾静脉,用夹子阻断双侧肾动脉血液运输,使肾脏供血受阻。夹持35分钟后去掉夹子,实现再灌注,假手术组仅进行钝性分离操作。AKI模型制备完成后,消瘀泄浊饮组小鼠分别进行不同浓度剂量的给药操作:生药量96mg/ml、192mg/ml和384mg/ml,连续14天灌胃。假手术组和AKI模型组分别给予等体积生理盐水连续灌胃14天。
1.3.2 体重、肾脏指数:测量各组小鼠体重并记录。行常规解剖摘取肾脏进行称重,计算肾脏指数。
1.3.3 生化指标:取血,收集血清于半自动生化检测仪中检测肌酐(CRE)、血尿素氮(BUN)、尿素(UREA)、血尿酸(UA)、总胆固醇(CHO)的含量。
1.3.4 氧化应激指标:参照试剂盒,ELISA法检测肾脏上清液中SOD、MDA、NOS、GSH-PX、CAT含量。
1.3.5 HE、PAS染色:取肾组织固定,制备石蜡切片。分别行HE和PAS染色,显微镜检拍照分析。
1.3.6 免疫组化:肾组织石蜡切片预处理后加入一抗P62和二抗孵育,进行显色、封片、镜检。
1.3.7 Western Blot检测:取肾组织样品,SDS-PAGE电泳,封闭反应后加一抗、二抗孵育,洗膜ECL化学发光仪显影,分析蛋白表达量。ECL化学发光仪显影,分析蛋白表达量。
2 结果与分析
2.1 消瘀泄浊饮对AKI小鼠体重、肾重和肾脏指数的影响:如图1。与假手术组相比,模型组肾脏指数显著升高(P<0.05);与模型组相比,消瘀泄浊饮中、高剂量组肾重和肾脏指数显著降低(P<0.05或P<0.01)。
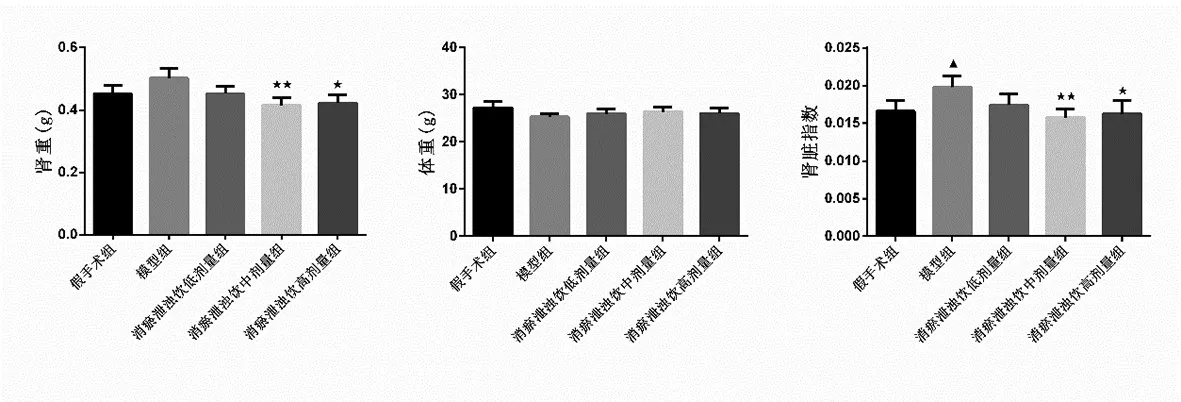
图1 小鼠体重、肾重变化情况(±s,n=6)
2.2 消瘀泄浊饮对AKI小鼠生化指标影响:见表1。与假手术组相比,模型组血清CRE、BUN、UREA、UA和CHO含量均显著上升(P<0.01);与模型组相比,消瘀泄浊饮低、中、高剂量组血清CRE、BUN、UREA、UA和CHO含量显著性降低(P<0.05或P<0.01)。
表1 小鼠血清中CRE、BUN、UREA、UA和CHO含量变化情况(±s,n=6)

表1 小鼠血清中CRE、BUN、UREA、UA和CHO含量变化情况(±s,n=6)
注:与假手术组比较,▲▲P<0.01;与模型组比较,★P<0.05,★★P<0.01。
组别假手术组模型组消瘀泄浊饮低剂量组消瘀泄浊饮中剂量组消瘀泄浊饮高剂量组CHO(G/DL)3.57±0.44 18.63±2.18▲▲8.88±0.96★★11.70±0.79★★8.90±1.01★★CRE(UMOL/L)15.98±2.00 49.57±4.76▲▲29.56±2.62★★28.41±2.58★★31.10±3.70★★BUN(MMOL/L)3.75±0.56 19.94±2.00▲▲11.90±1.50★★9.69±0.48★★7.94±0.57★★UREA(MMOL/L)5.15±0.69 19.93±2.40▲▲16.54±1.42★13.85±1.35★★12.05±1.12★★UA(UMOL/L)85.66±9.97 136.92±10.50▲▲106.81±11.03★★111.28± 5.38★★99.86± 9.61★★
2.3 消瘀泄浊饮对AKI小鼠肾组织氧化应激的影响:与假手术组相比,模型组血清中SOD、GSH-PX和 CAT含量显著性降低,NOS和MDA含量显著上升(P<0.01);与模型组相比,消瘀泄浊饮低、中、高剂量组血清中SOD、GSH-PX和CAT含量显著性上升,NOS和MDA含量显著降低(P<0.05或P<0.01)。见图2。
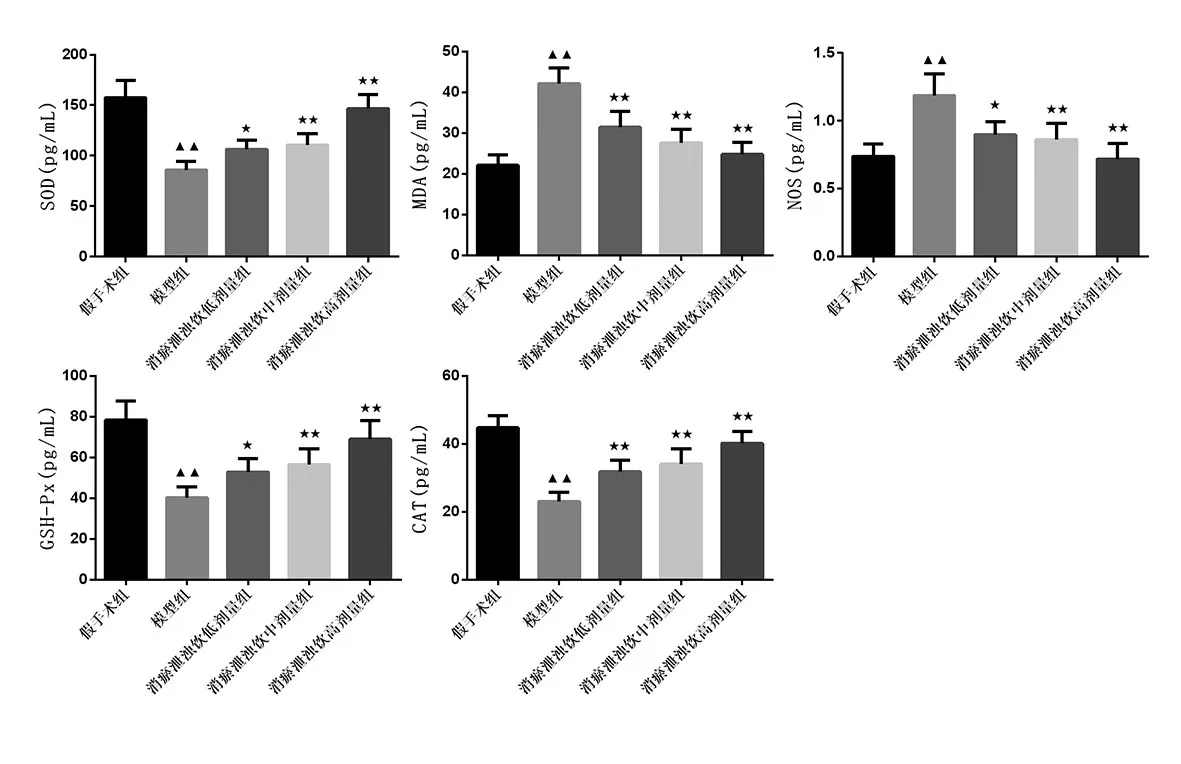
图2 小鼠血清中SOD、MDA、NOS、GSH-PX和CAT含量变化情况(±s,n=6)
2.4 HE染色结果分析:见图3,与假手术组比,模型组出现肾小管扩张,肾间质炎性细胞出现大量浸润,与模型组相比,消瘀泄浊饮干预后,肾小管扩张情况得到了改善,并且其中的炎性细胞浸润也相应减少。
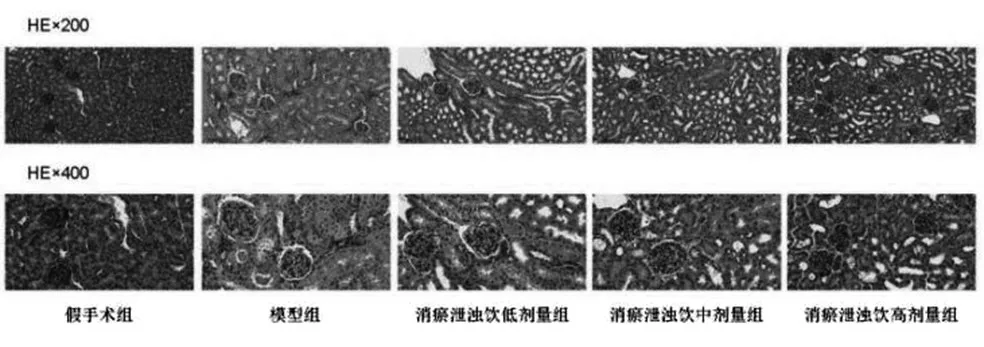
图3 小鼠肾组织病理学改变(HE染色,200、400倍)
2.5 PAS染色结果分析:见图4,对比假手术组,模型组出现大量的红色基质;对比模型组,可看到用药后红色基质明显减少,表明消瘀泄浊饮对于肾损伤有一定的修复作用。
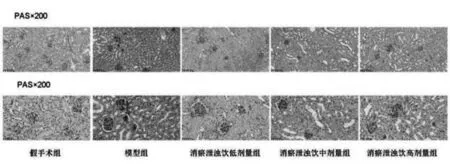
图4 小鼠肾组织病理学改变情况(PAS染色,200、400倍)
2.6 消瘀泄浊饮对AKI小鼠肾组织自噬相关蛋白P62的影响:见图5。模型组小鼠肾组织P62蛋白表达量显著上升;与模型组相比,消瘀泄浊饮低、中、高剂量组小鼠肾组织P62蛋白表达显著降低(P<0.05或P<0.01)。
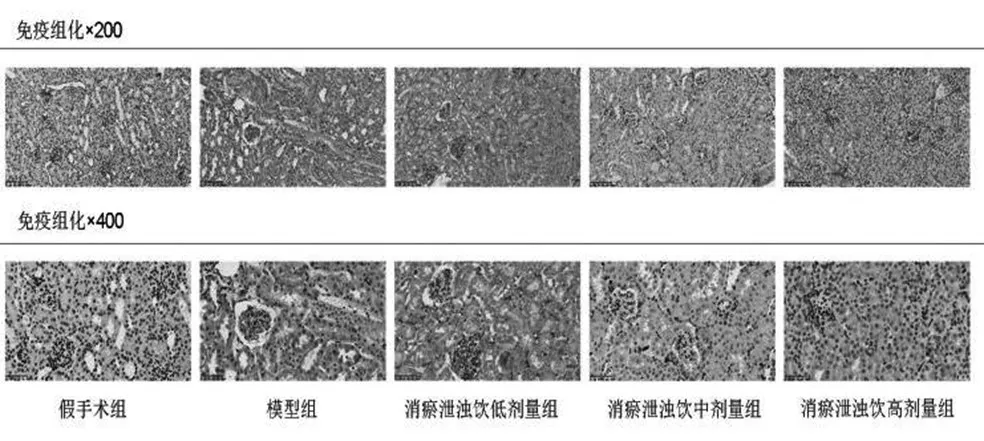
图5 小鼠肾组织中自噬相关蛋白P62的表达(免疫组化,200、400倍)
2.7 消瘀泄浊饮对AKI小鼠肾组织自噬相关蛋白及PI3K/AKT/MTOR通路的影响:见图6。与假手术组比,模型组小鼠肾组织中LC3Ⅱ/Ⅰ、BECLIN1的蛋白表达水平降低,P62、P-PI3K/PI3K、P-AKT/AKT、P-MTOR/MTOR的蛋白表达水平升高。与模型组相比,消瘀泄浊饮低、中、高剂量组小鼠肾组织中LC3Ⅱ/Ⅰ、BECLIN1的蛋白表达水平均显著升高,P62、P-PI3K/PI3K、P-AKT/AKT、P-MTOR/MTOR的蛋白表达水平均显著降低(P<0.05或P<0.01)。
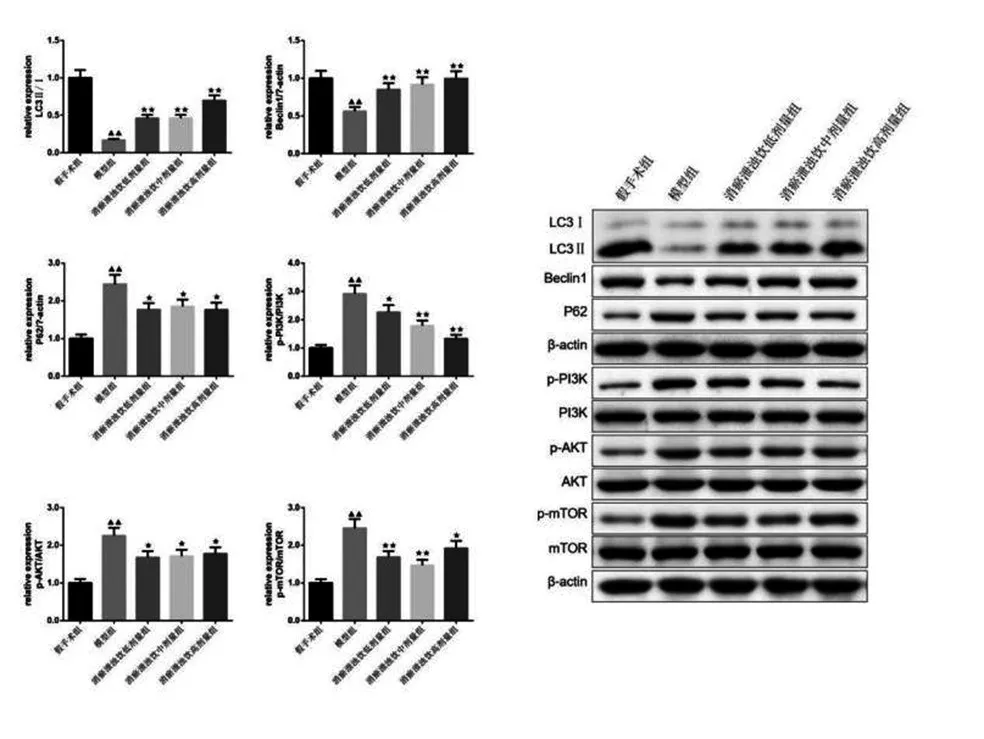
图6 小鼠肾组织中P62、P-PI3K/PI3K、P-AKT/AKT、PMTOR/MTOR蛋白表达情况(±s,n=3)
3 讨论
肾脏是维持人体生命活动的重要代谢器官,而AKI会直接影响正常肾功能,使得肾小球滤过率减低,肾小管出现扩张、系膜增生等症状,给肾脏带来严重的负担[1]。鲁科达[2,3]等利用5/6肾切除同时低蛋白饮食的方式建立慢性肾衰竭小鼠模型,发现消瘀泄浊饮能够保护慢性肾衰竭小鼠肾功能;采用单侧输尿管结扎模型,研究发现消瘀泄浊饮能够有效延缓肾间质纤维化程度,因此我们推断消瘀泄浊饮可能在治疗AKI过程中亦具有较好的效果。
本研究利用C57BL/6小鼠,通过夹闭肾动脉造成肾缺血再灌注损伤构建AKI模型开展实验。结果显示用药组肾小管扩张及炎性细胞浸润显著改善,且高剂量更显著。活性氧(ROS)会在组织缺血再灌注的过程中大量产生,可造成较为严重的氧化应激反应。MDA是不饱和脂质氧化反应的终产物,可正向影响氧化应激,而SOD与之相反。结果显示,用药后SOD、GSH-PX和CAT的含量上升,NOS和MDA的含量降低,表明消瘀泄浊饮可以改善I/R造成的肾组织氧化应激损伤。
AKI模型中,近端小管的自噬能力降低或缺失将直接影响肾小管的功能。Lawrence J.[4]研究表明,肾脏疾病进展中PI3K/AKT具有至关重要的作用,参与糖尿病肾病肾功能损伤,且PI3K/AKT也是抑制自噬的主要信号通路。本次研究发现,肾缺血再灌注损伤会造成抑制自噬相关蛋白表达水平显著升高,促进自噬相关蛋白表达水平显著降低,表明AKI会造成机体自噬能力的降低。而用药后结果相反,表明给药治疗能够促进肾组织自噬,这与刘浩等利用缺血再灌注小鼠所得出的实验结论一致。
综上所述,本研究认为消瘀泄浊饮对缺血再灌注导致的AKI模型小鼠肾损伤有一定的改善作用。其作用机制可能是通过上调LC3Ⅱ/Ⅰ、BECLIN1的蛋白表达,下调P62、P-PI3K/PI3K、P-AKT/AKT、P-MTOR/MTOR的蛋白表达,作用PI3KAKT/MTOR通路来改善自噬作用,使细胞活力增强,加速新陈代谢,进而起到修复受损肾组织的作用。

