miR-122-3p靶向VEGFA基因对胰腺癌细胞恶性生物学行为影响的分子机制
宋剑锋,白明辉,刘少朋
(1.前海人寿广州总医院 肝胆外科,广东 广州 511300;2.郑州大学附属洛阳中心医院 肝胆外科,河南 洛阳 471000)
近年来,分子靶向治疗在胰腺癌中的应用是一个研究热点[1],但肿瘤耐药仍是影响其治疗效果的重要因素之一。血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)可表达于肿瘤组织和正常组织[2-3],研究表明,VEGFA在胰腺癌中异常高表达,且可通过MAPK/ERK信号通路调控胰腺癌侵袭及转移[4-5]。miR-122-3p是miR-122家族成员之一[6],且在胃癌、肺癌等多种肿瘤中呈低表达[7-8]。本研究团队前期通过生物学预测软件发现VEGFA基因可能是miR-122-3p潜在的靶基因之一。因此,本研究提出miR-122-3p靶向调控VEGFA基因可能参与胰腺癌进展的假设,进一步探究其分子作用机制,以期为胰腺癌的分子靶向治疗提供新的生物学依据。
1 材料与方法
1.1 细胞与材料各实验细胞株均购自中科院上海细胞库,胎牛血清、RPMI-1640培养基、DMEM培养基、噻唑蓝(methyl thiazolyl tetrazolium,MTT)液、胰酶购自赛默飞世尔科技中国有限公司,Trizol RNA提取试剂盒、定量反转录聚合酶链反应(quantitative reverse transcriptase-mediated polymerase chain reaction,qRT-PCR)试剂盒(QP115)、反转录试剂盒购自艾美捷科技有限公司,LipofectamineTM2000购自北京索莱宝科技有限公司。荧光定量PCR引物:β-actin上游引物为5’-TACCTCCCAAGTCCTGTATGAG-3’,下游引物为5’-TGAGCAGCATCAAACTGTGTAG-3’;miR-122-3p上游引物为5’-AACAGCACAAACUACUACCUCA-3’,下游引物为5’-UAUUUAGUGUGAUAAUGGCGUU-3’;VEGFA上游引物为5’-ATGCCGGTTCCAACCAGAA-3’,下游引物为5’-GTGGAGGAGCGAGCTGAA-3’。miR-122-3p、miR-con、pcDNA、pcDNA-VEGFA、突变型VEGFA(mutant type VEGFA,MUT-VEGFA)、野生型VEGFA(wild type VEGFA,WT-VEGFA)的构建及测序由苏州态和生物科技有限公司提供。兔抗人基质金属肽酶-2(matrix metallopeptidase-2,MMP-2)、细胞外调节蛋白激酶1(extracellular regulated protein kinase 1,ERK1)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体及辣根过氧化物酶标记的羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗购于上海普迈生物科技有限公司,自动酶标仪购自上海寰熙医疗器械有限公司(型号SM800),双荧光素酶报告基因检测试剂盒购自上海碧云天生物技术有限公司(型号RG027),吉姆萨染色液购自达科为生物技术股份有限公司。
1.2 细胞转染与分组将miR-122-3p相对表达量最低的AsPC-1细胞接种于6板孔,至细胞融合度达70%~80%,按照LipofectamineTM2000说明书进行转染,qRT-PCR法测定转染效率。实验分组如下:NC组(细胞不作处理)、miR-con组(转染对照miR-con)、miR-122-3p mimic组(转染miR-122-3p模拟物)、miR-122-3p+pcDNA组(共转染miR-122-3p和空载体pcDNA)和miR-122-3p+pcDNA-VEGFA组(共转染miR-122-3p和pcDNA-VEGFA)。
1.3 qRT-PCR采用Trizol法分别提取各组细胞总RNA,测定其浓度及纯度,将mRNA反转录为cDNA,并行PCR扩增,Bio-Rad CFX96 PCR仪测定miR-122-3p、VEGFA及β-actinmRNA表达水平。设置5个复孔。相对表达量以2-ΔΔCT表示,其中ΔCT为miR-122-3p或VEGFA CT值与β-actin CT值的差值。
1.4 MTT法将各组细胞分别接种于24孔板(5×104个·mL-1),并分别培养24、48、72 h,弃去上清液后加入无血清RPMI-1640培养液(每孔200 μL),并加入MTT液(每孔20 μL),避光培养6 h,加入二甲基亚砜(每孔100 μL),震荡15 min。待结晶溶解后使用自动酶标仪测定每孔490 nm处吸光度(A490),并绘制细胞生长曲线。
1.5 平板克隆实验将各组细胞分别接种于6孔板并进行培养,采用磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗后加入40 g·L-1多聚甲醛(每孔1 mL),固定20 min后用1 g·L-1结晶紫染液染色15 min,漂洗并晾干。倒置显微镜下随机选取5个视野计数细胞,Image J软件统计细胞克隆数。
1.6 细胞划痕实验将各组细胞分别接种于细胞培养板并进行培养(含体积分数5% CO2的恒温培养箱),用20 μL枪头垂直划过细胞,48 h后拍照,Image J软件测定细胞划痕愈合情况,计算细胞迁移能力。
1.7 Transwell实验Matrigel胶预处理Transwell小室,胰酶消化各组细胞后进行细胞重悬,上部加入20 μL细胞悬液,下部加入60 μL胎牛血清培养基(体积分数为30%),培养24 h后以PBS冲洗3次,40 g·L-1多聚甲醛固定后用吉姆萨染色液染色,显微镜下计数细胞。
1.8 蛋白质印迹实验分别提取各组细胞总蛋白并调整浓度,行聚丙烯酰胺凝胶电泳后转至聚偏二氟乙烯膜,Western封闭液封闭2 h,PBS清洗3次,分别加入相应一抗,4 ℃下孵育过夜,PBS再次冲洗后加入羊抗兔IgG二抗,37 ℃下孵育2 h,电化学发光液显影后于暗室拍照。Bandscan 5.0软件行灰度分析,设目的蛋白相对表达量为目的蛋白条带灰度值与GAPDH蛋白条带灰度值的比值。
1.9 双荧光素酶报告基因法分别构建WT-VEGFA及MUT-VEGFA的3’UTR荧光素酶基因载体,采用LipofectamineTM2000将miR-122-3p minic和对照miR-con分别与MUT-EVEGFA及WT-VEGFA共转染AsPC-1细胞,培养48 h后用双荧光素酶报告基因检测试剂盒测定各组AsPC-1细胞荧光素酶活性。

2 结果
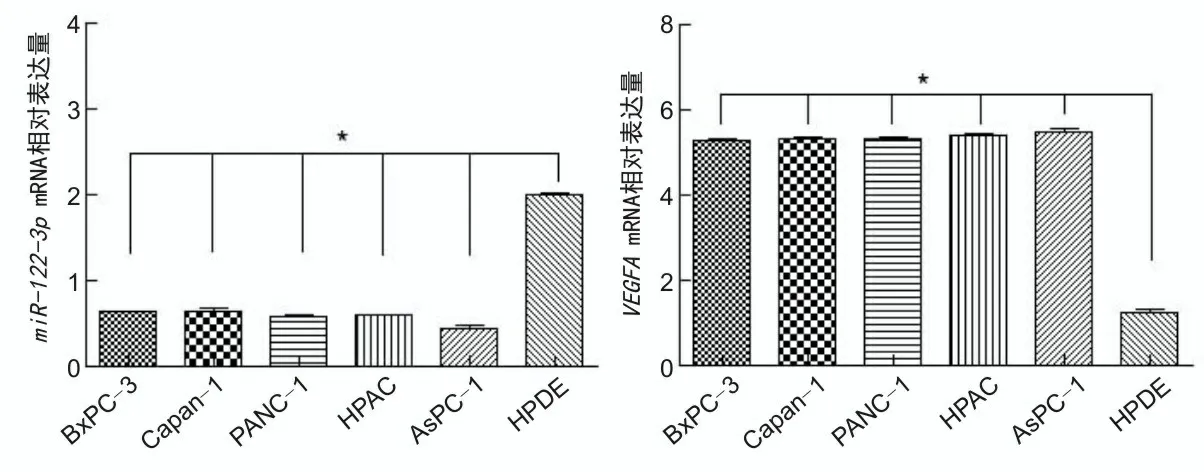
2.1 miR-122-3p及VEGFA表达miR-122-3pmRNA在胰腺癌细胞株BxPC-3、Capan-1、PANC-1、HPAC、AsPC-1中相对表达量分别为0.64±0.02、0.63±0.07、0.59±0.04、0.60±0.01、0.47±0.13,均低于HPDE细胞株(2.02±0.06),差异有统计学意义(P<0.05);VEGFAmRNA在上述胰腺癌细胞中相对表达量分别为5.23±0.19、5.34±0.02、5.30±0.14、5.27±0.27、5.54±0.15,均高于HPDE株细胞(1.09±0.26),差异有统计学意义(P<0.05)。见图1。
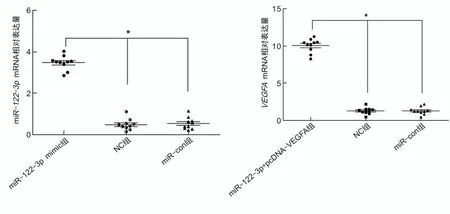
2.2 细胞转染效率测定miR-122-3p mimic组AsPC-1细胞中miR-122-3p相对表达量(3.49±0.18)高于NC组(0.52±0.21)及miR-con组(0.55±0.13),差异有统计学意义(P<0.05);miR-122-3p+pcDNA-VEGFA组AsPC-1细胞中VEGFA相对表达量(10.44±0.51)高于NC组(1.09±0.23)及miR-122-3p+pcDNA组(1.07±0.17),差异有统计学意义(P<0.05),提示转染成功。见图2。
*P<0.05。
★P<0.05。
2.3 过表达miR-122-3p抑制胰腺癌细胞增殖及克隆形成不同时间点(24、48、72 h)miR-122-3p mimic组AsPC-1细胞活力分别为1.35±0.16、2.78±0.44、3.40±0.71,分别低于NC组的2.02±0.25、5.44±0.18、7.54±0.33及miR-con组的2.00±0.19、5.38±0.11、7.47±0.50,差异有统计学意义(P<0.05),NC组与miR-con组细胞活力差异无统计学意义(P>0.05),见图3。miR-122-3p mimic组细胞克隆数为20.33±3.31,低于NC组(78.11±8.20)及miR-con组(76.49±7.91),差异有统计学意义(P<0.05),见图4。
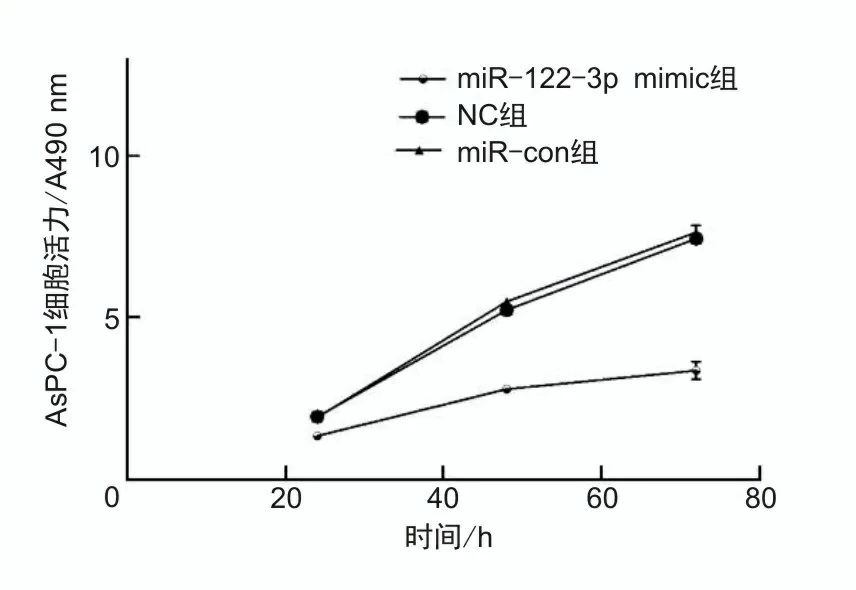
图3 过表达miR-122-3p对胰腺癌AsPC-1细胞增殖的影响
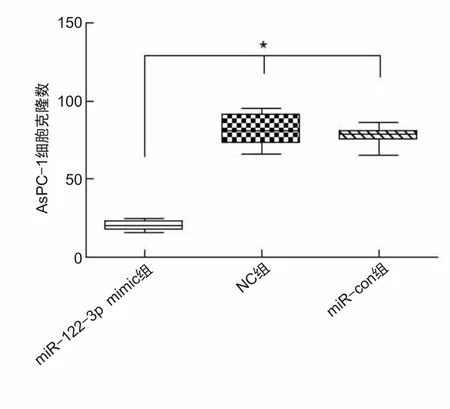
*P<0.05。
2.4 过表达miR-122-3p抑制肝癌细胞迁移及侵袭miR-122-3p mimic组细胞迁移率低于NC组(t=-13.121,P<0.001)及miR-con组(t=-12.242,P<0.001),见表1。miR-122-3p mimic组迁移相关蛋白MMP-2相对表达量低于NC组(t=-7.599,P<0.001)及miR-con组(t=-19.785,P<0.001),见表1和图5。miR-122-3p mimic组穿膜细胞数低于NC组(t=-41.716,P<0.001)及miR-con组(t=-51.817,P<0.001),见表1和图6。
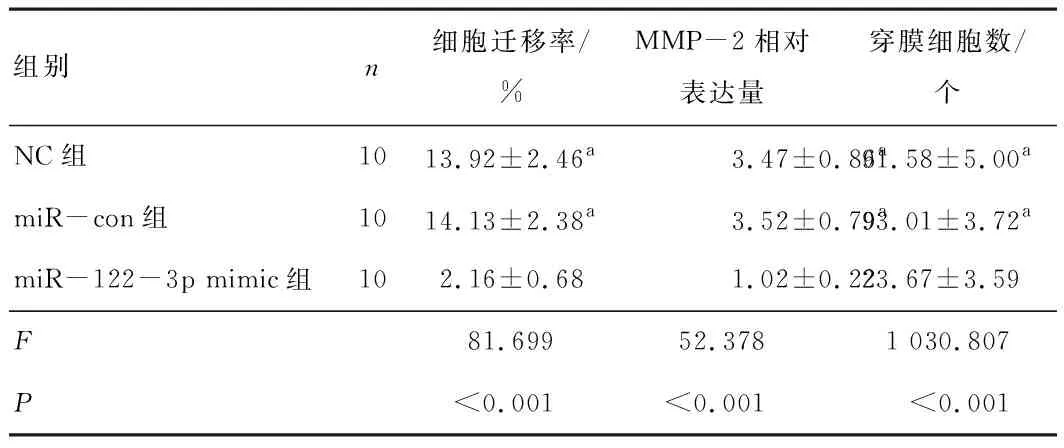
表1 转染后不同组别细胞迁移率、MMP-2相对表达量及穿膜细胞数比较
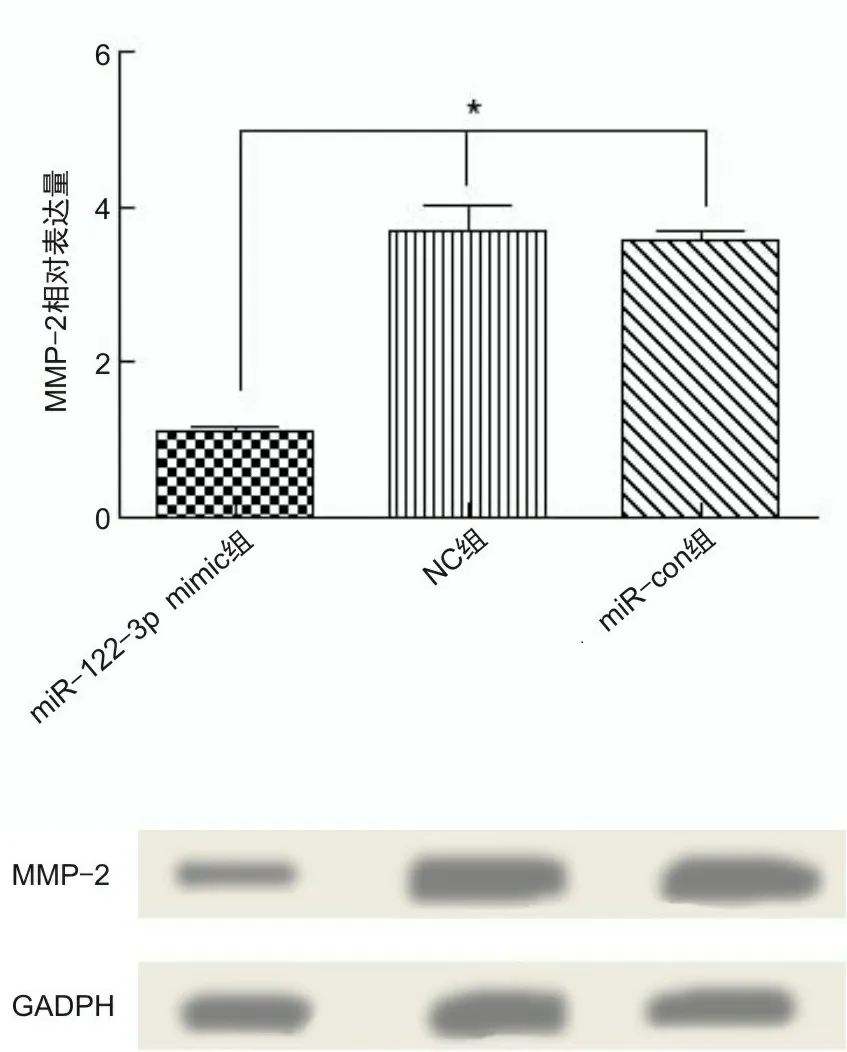
*P<0.05。
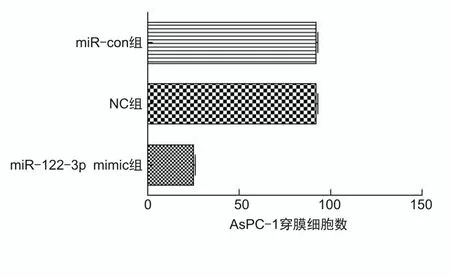
图6 过表达miR-122-3p抑制AsPC-1细胞侵袭
2.5 miR-122-3p靶向调控VEGFA表达miR-122-3p与WT-VEGFA共转染AsPC-1细胞后,miR-122-3p mimic组细胞荧光素酶活性低于NC组及miR-con组(0.51±0.13比2.11±0.24、2.08±0.46;t1=-17.552,P1<0.05;t2=-9.279,P2<0.05);与MUT-VEGFA共转染后,miR-122-3p mimic组与NC组及miR-con组细胞荧光素酶活性差异无统计学意义(1.10±0.22比1.12±0.20、1.09±0.89;t1=-1.243,P1>0.05;t2=-1.936,P2>0.05)。
2.6 过表达VEGFA可逆转miR-122-3p对胰腺癌细胞恶性生物学行为的抑制作用miR-122-3p+pcDNA-VEGFA组AsPC-1细胞在不同时间点细胞活力均高于miR-122-3p+pcDNA组,细胞迁移率、穿膜细胞数均高于miR-122-3p+pcDNA组[细胞迁移率(11.20±1.93)%比(2.35±0.53)%,t=10.609,P<0.001;穿模细胞数(84.39±2.92)个比(22.15±2.50)个,t=49.435,P<0.001],见图7A、7B、7C。细胞内MMP-2、VEGFA、ERK1、MAPK蛋白表达水平增高,miR-122-3p mimic组细胞内上述蛋白表达低于miR-con组(P<0.001),见图8A、8B。
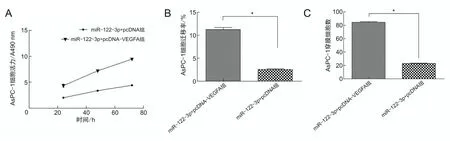
A为AsPC-1细胞活力;B为AsPC-1细胞迁移率;C为AsPC-1穿膜细胞数;*P<0.05。
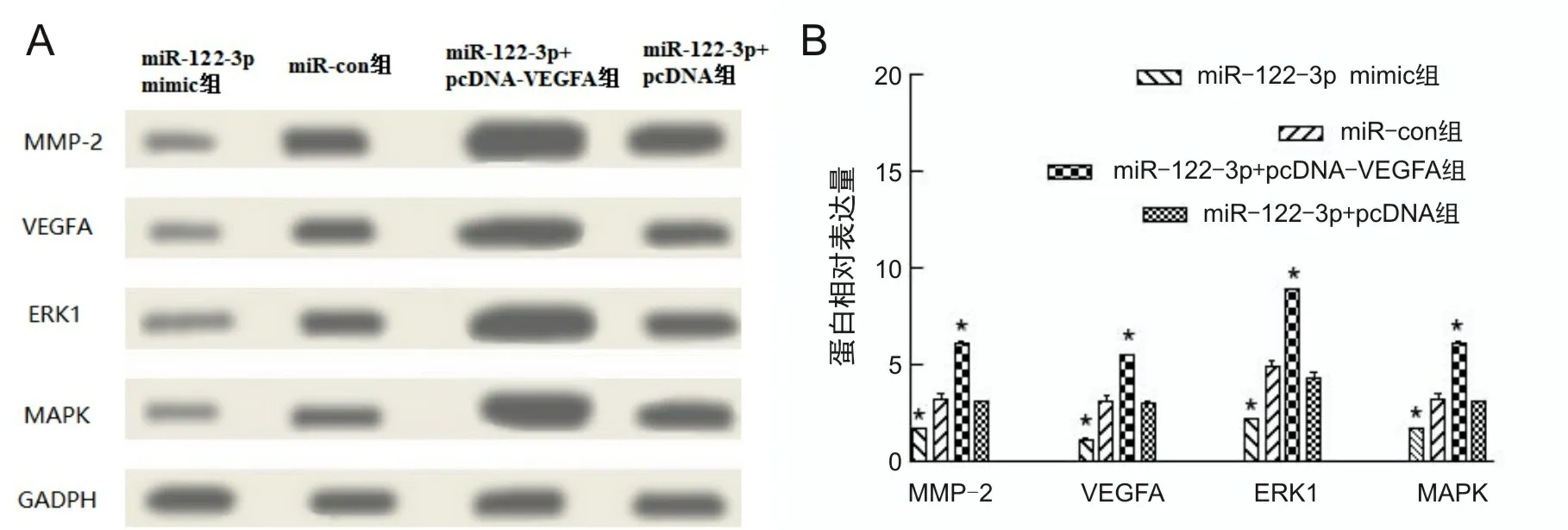
A为电泳条带图;B为条形图;*P<0.05。
3 讨论
miRNA是一类高度保守的非编码小RNA,由20~24 nt组成,广泛存在于真核细胞中[9-10]。作为一种重要的调控因子,miRNA广泛参与多种肿瘤相关基因转录后的调控,在肿瘤的发生、发展过程中发挥重要的生物学作用[11-12],因此受到研究者的广泛关注。研究显示,miR-122-3p参与多种疾病的进展,如Zhao等[13]研究显示miR-122-3p参与股骨头坏死的发展进程,Wang等[14]研究显示miR-122-3p可通过靶向A549抑制肿瘤细胞增殖并诱导其凋亡,Yang等[15]研究显示miR-122-3p可作为药物性肝损伤潜在的毒理学生物标志物,但目前关于miR-122-3p在胰腺癌中作用的相关研究仍较少。
本研究结果显示,miR-122-3p在胰腺癌细胞BxPC-3、Capan-1、PANC-1、HPAC、AsPC-1中表达下调,VEGFA表达上调,初步表明miR-122-3p在胰腺癌中存在差异表达。进一步构建过表达miR-122-3p的胰腺癌AsPC-1细胞,检测结果显示miR-122-3p mimic组细胞增殖、克隆及迁移、侵袭能力均低于NC组及miR-con组,同时MMP-2表达水平也降低,提示过表达miR-122-3p会抑制胰腺癌细胞的恶性生物学行为,并可抑制参与肿瘤进展的MMP-2蛋白的表达。双荧光素酶报告基因检测和蛋白质印迹实验显示,VEGFA与miR-122-3p存在靶向作用关系。为进一步验证此结果,本研究构建过表达VEGFA的miR-122-3p+pcDNA-VEGFA组细胞,细胞实验结果显示miR-122-3p+pcDNA-VEGFA组AsPC-1细胞增殖、克隆、迁移及侵袭等恶性生物学行为均高于miR-122-3p+pcDNA组,这表明过表达VEGFA可逆转miR-122-3p对胰腺癌恶性生物学行为的抑制作用。蛋白质印迹实验结果显示,miR-122-3p+pcDNA-VEGFA组细胞内MMP-2、VEGFA、ERK1、MAPK蛋白表达水平增高,miR-122-3p mimic组细胞内上述蛋白表达水平降低。MMP-2、VEGFA、ERK1、MAPK均是MAPK/ERK信号通路中的重要蛋白,参与胰腺癌的发生发展进程[16-19]。因此,结合上述研究结果,推测miR-122-3p靶向VEGFA抑制胰腺癌细胞的恶行生物学行为可能与抑制MAPK/ERK信号通路的活化有关,但其需要进一步深入研究证实。
综上所述,本研究初步表明miR-122-3p在胰腺癌细胞中低表达,过表达miR-122-3p可抑制胰腺癌细胞的恶性生物学行为,作用机制可能与靶向VEGFA有关,这为寻求胰腺癌新的分子靶点提供了一定参考。

