游离钙和氧合指数联合快速序贯器官衰竭评分在识别成人脓毒症中的诊断效能
胡俊贤, 王蒙蒙, 董 妍, 庄苏园, 张 炜, 杨志洲, 任 艺, 孙兆瑞, 韩小琴, 聂时南
脓毒症(sepsis)每年全球新发病例约3000万,病死率可达20%,早期识别脓毒症是治疗的关键。2016年提出的快速序贯器官衰竭评分(quick sequential organ failure assessment,qSOFA)旨在根据患者临床体征快速识别脓毒症[1],然而该方法敏感度较低导致假阴性患者的比例较大,相当一部分患者延误最佳治疗时机。单纯使用qSOFA在识别成人脓毒症患者中诊断效能不足[2]。2018年提出的“1小时集束化治疗方案”强调了动脉血气分析在脓毒症患者中的诊疗地位,可快速评估患者氧合功能及游离钙(iron calcium, iCa)水平[3]。氧合指数(PaO2/FiO2)作为脓毒症相关序贯器官衰竭评分(sequential organ failure assessment,SOFA)项目之一,已用于识别脓毒症患者。iCa是血钙发挥生物活性的主要形式,当感染性疾病患者进展为脓毒症时,炎症因子可介导大量钙离子内流,从而诱发低钙血症的发生,低钙血症是脓毒症患者发生不良预后的独立危险因素[4]。本研究旨在联合iCa、PaO2/FiO2及qSOFA构建联合模型,研究联合模型在识别成人脓毒症中的诊断效能,为临床快速识别成人脓毒症提供参考。
1 资料与方法
1.1研究对象 回顾性分析2019年10月至2021年3月就诊于东部战区总医院急诊抢救室的147例脓毒症患者及158例非脓毒症感染性疾病患者。纳入标准:脓毒症组①符合脓毒症3.0诊断标准,②患者年龄18~75岁;非脓毒症组①入院主要诊断为感染性疾病,②患者年龄18~75岁。排除标准:①合并慢性肾功能不全,②急性胰腺炎,③合并严重脏器功能不全,④血液系统疾病,⑤恶性肿瘤,⑥头颅疾病病史遗留意识不清,⑦临床资料不全。本研究符合东部战区总医院伦理委员会审批标准(伦理批号:2021DZSKT-YBB-014)。
1.2脓毒症3.0诊断标准 存在感染或疑似感染,SOFA较基线上升≥2分;低钙血症:iCa<1.15 mmol/L。
1.3研究方法 采用回顾性研究方法,收集两组患者临床资料[包括年龄、性别、原发感染部位、入院时生命体征、iCa、血清钙(total calcium,tCa)、PaO2/FiO2、SOFA、qSOFA、降钙素原(procalcitonin,PCT)、C-反应蛋白(C-reactive protein,CRP)、血乳酸(lactic acid,Lac)、白细胞介素-6(interleukin-6, IL-6)等;对原数据集(n=305)患者的血钙水平与炎症指标及SOFA等临床资料进行相关性分析。采用倾向性评分匹配(propensity score matching,PSM)对脓毒症与非脓毒症患者按照年龄、性别、感染部位进行1∶1匹配得到训练集(n=186),比较PSM前后脓毒症与非脓毒症患者的临床资料。将训练集中两组间差异有统计学意义的指标经筛选后纳入Logistic回归,得到感染性疾病患者发生脓毒症的独立危险因素并联合建模,通过受试者工作特征曲线(receive operating characteristic curve,ROC)及曲线下面积(area under curve,AUC),比较各指标及其联合模型识别脓毒症患者的诊断效能。最后将原数据集(n=305)作为验证集对联合筛查模型的诊断效能进行验证。

2 结果
2.1临床资料比较 PSM前脓毒症组(n=147)和非脓毒症组(n=158)年龄、原发疾病感染部位差异均有统计学意义(P<0.001),将两组患者按年龄、性别、原发疾病感染部位进行1∶1 PSM,得到脓毒症组(n=93)和非脓毒症组(n=93),匹配后两组患者年龄、性别及原发疾病感染部位的差异无统计学意义(P>0.05),具有可比性。PSM前后脓毒症组与非脓毒症组qSOFA评分、iCa、PaO2/FiO2及低钙血症发生率等临床资料差异均有统计学意义(P<0.001)。见表1。
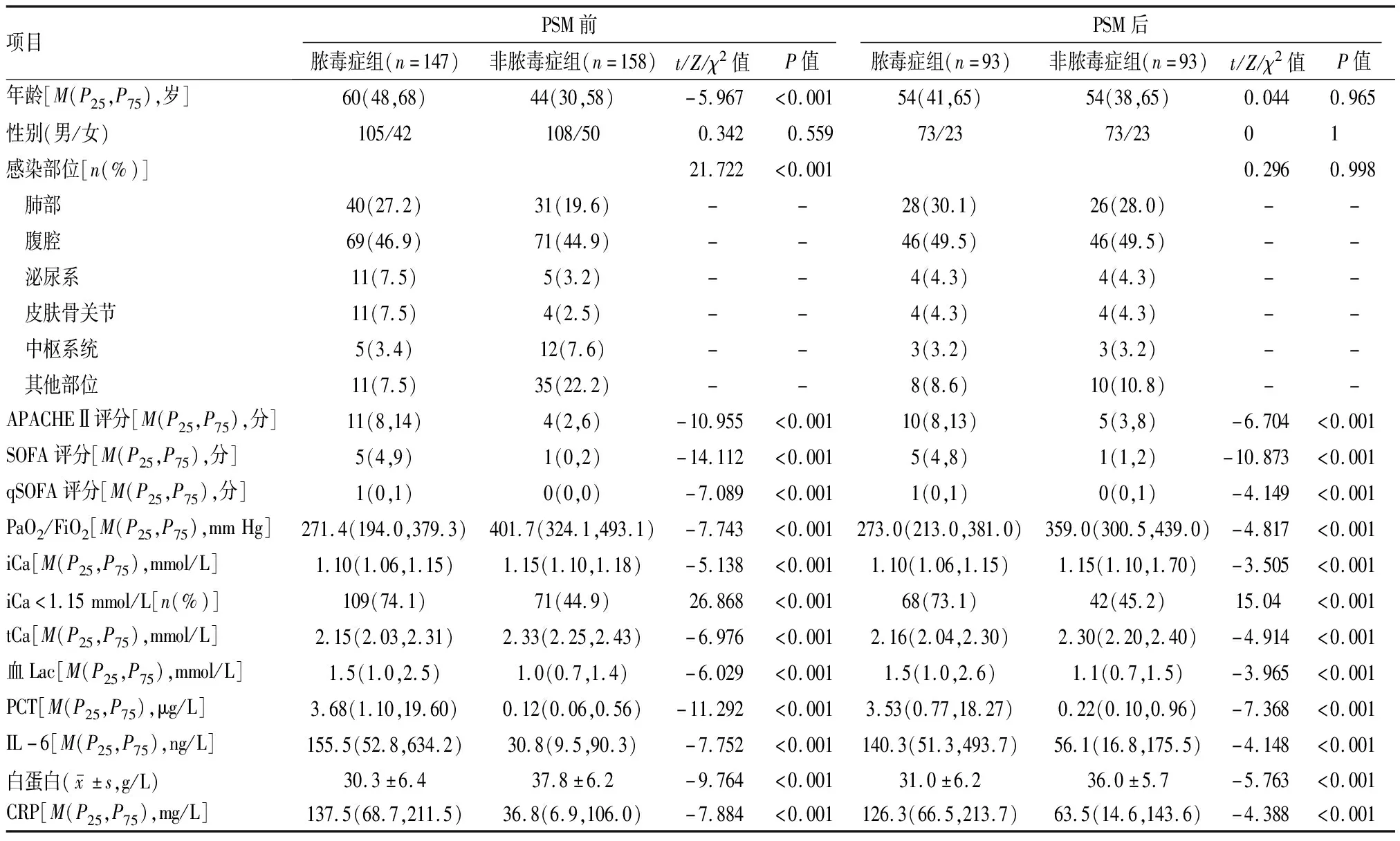
表1 PSM前后脓毒症组与非脓毒症组患者的临床资料比较
2.2血钙水平的相关性分析 将305例感染性疾病患者的血钙水平与PCT、IL-6、CRP、SOFA等临床资料进行Spearman秩相关分析,结果显示,iCa和tCa与SOFA、APACHEⅡ评分、PCT、IL-6、CRP均呈负相关(P<0.05);iCa与qSOFA评分无相关(P=0.262);tCa与白蛋白具有高度相关性(r=0.732,P<0.001)。见表2。
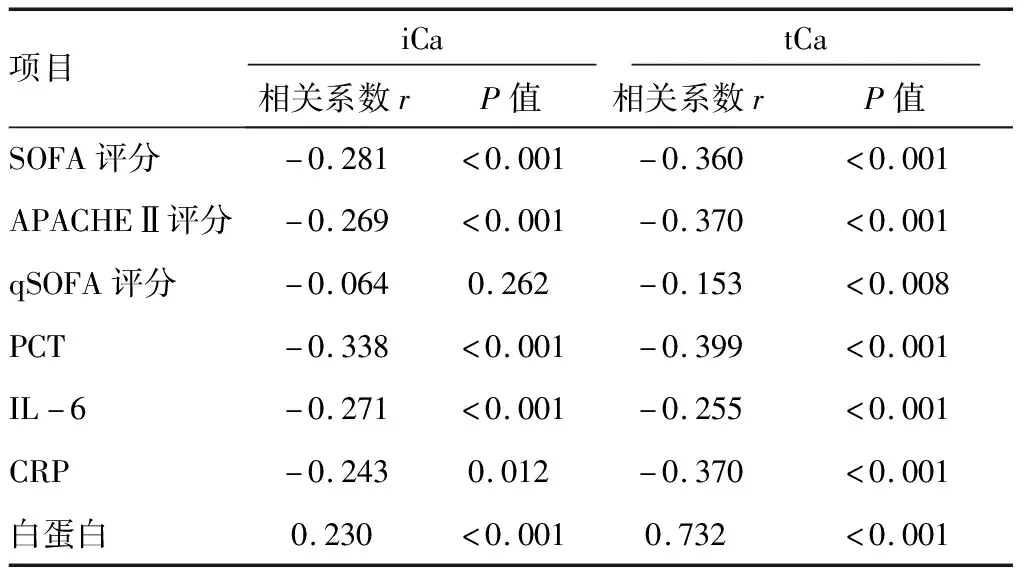
表2 305例感染性疾病患者血钙水平与相关临床指标的相关性分析
2.3感染性疾病患者发生脓毒症的危险因素分析 以感染性疾病患者是否发生脓毒症为结局变量,将qSOFA分值、新发低钙血症(iCa<1.15 mmol/L;赋值:发生=1,未发生=0)、PaO2/FiO2(赋值:PaO2/FiO2>400=0,300≤PaO2/FiO2<400=1,PaO2/FiO2<300=2)、血乳酸、iCa作为自变量,将单因素分析有统计学意义的自变量经筛选后代入多因素Logistic回归分析,方法选择向前偏似然法,结果显示,新发低钙血症(iCa<1.15 mmol/L)、PaO2/FiO2及qSOFA分值与感染性疾病患者发生脓毒症有回归关系,其中新发低钙血症是独立危险因素(P<0.05)。见表3。
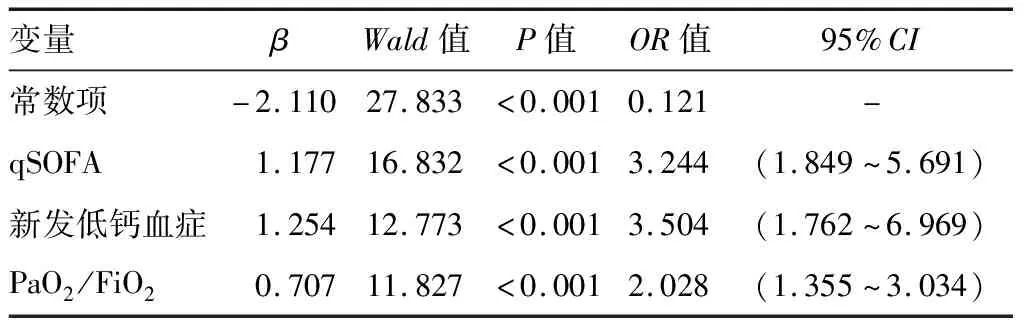
表3 感染性疾病患者发生脓毒症的多因素Logistic回归分析
2.4构建联合模型及诊断效能分析在训练集(n=186)中,将qSOFA分值(X1)、新发低钙血症(X2)及PaO2/FiO2(X3)为自变量进行多因素Logistic回归,得到联合筛查模型的表达式为logit(P)=-2.11+1.177X1+1.254X2+0.707X3,生成qSOFA、新发低钙血症、PaO2/FiO2及三者联合模型诊断脓毒症患者的ROC。结果显示,联合模型识别脓毒症的诊断效能优于qSOFA、新发低钙血症和PaO2/FiO2单独诊断(Z=3.461、Z=4.234和Z=3.529,P<0.001)。见表4、图1。

表4 联合筛查模型及原始协变量识别PSM后感染性疾病患者发生脓毒症的诊断效能比较
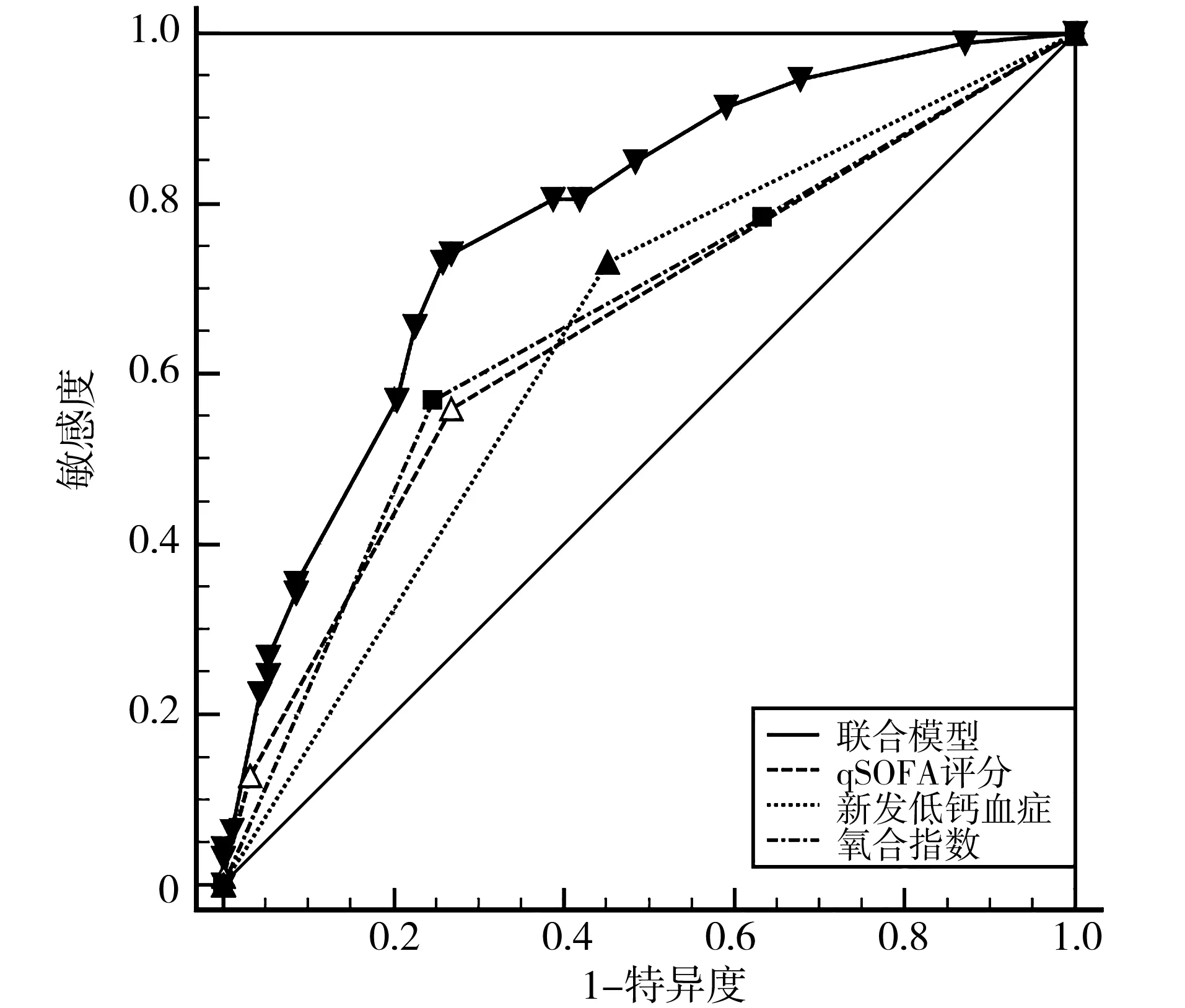
图1 联合筛查模型及协变量诊断训练集(n=186)中成人脓毒症患者的ROC曲线
2.5验证联合模型 选择原数据集(n=305)作为验证集代入联合模型,结果显示,联合模型的敏感度为77.55%,特异度为77.85%,阳性似然比为3.50,阴性似然比为0.29,AUC大于qSOFA评分、新发低钙血症和PaO2/FiO2(Z=5.067、Z=7.768和Z=4.752,P<0.001),见表5、图2。对联合模型与SOFA评分进行McNemar检验结果显示,P=0.904,说明联合模型与SOFA评分诊断的差异无统计学意义、一致性检验Kappa值为0.554,P<0.001,说明联合模型与SOFA评分具有较好的一致性。
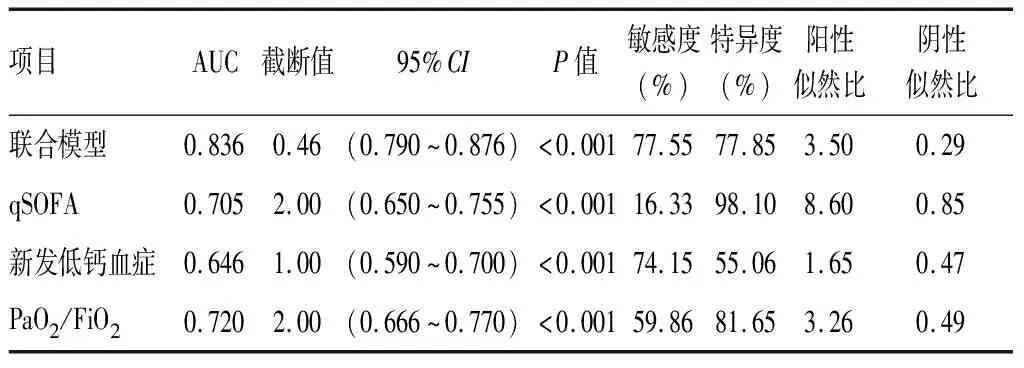
表5 联合筛查模型验证305例感染性疾病患者发生脓毒症
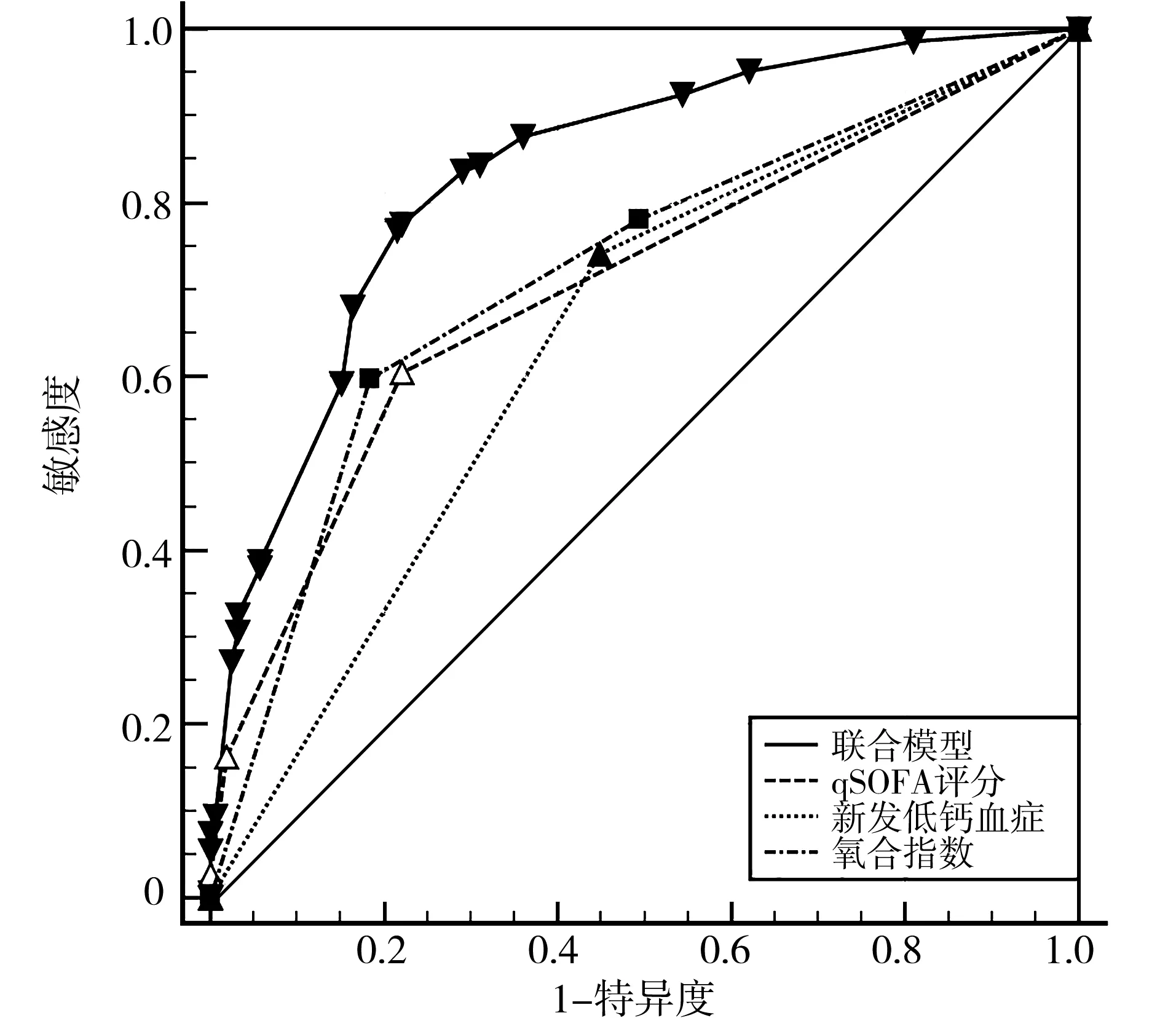
图2 联合筛查模型及协变量诊断验证集(n=305)中成人脓毒症患者的ROC曲线
3 讨论
近年来脓毒症已成为急危重症科室患者死亡的主要原因之一,早期识别对改善脓毒症患者的预后具有重要意义。由于动脉血气分析可以快速评估患者氧合功能、电解质及灌注水平,本研究通过对动脉血气分析参数进行回归分析,发现新发低钙血症、PaO2/FiO2与感染性疾病患者发生脓毒症有回归关系,并与qSOFA联合构建模型,研究联合模型在识别成人脓毒症中的诊断效能。
iCa约占血总钙的45%,是血钙发挥生理功能的主要形式,非扩散钙约占血总钙的40%,主要与血浆白蛋白结合,因此白蛋白水平同样影响患者血钙水平,Pekar等[5]认为,应将iCa作为患者血钙水平的评估指标。研究表明,脓毒症相关低钙血症的发生率可达70%,目前研究[6-7]认为,炎症反应介导细胞膜通透性改变导致细胞外大量钙离子内流是主要的病理机制,低钙血症是脓毒症患者发生不良预后的危险因素。一项纳入153例脓毒性休克患者的单中心回顾性研究发现,与存活组(n=100)相比,死亡组(n=53)患者的tCa水平更低[mmol/L,1.62±0.26 vs.1.98±0.27,P<0.01][8]。另一项纳入119例脓毒症患者的单中心回顾性研究[4]发现,与血钙水平正常的脓毒症患者(n=50)相比,发生低钙血症的脓毒症患者(n=69)28 d病死率更高(48.00% vs.78.26%,χ2=10.45,P<0.01),血钙水平可作为脓毒症患者预后评估的指标(AUC=0.70,95%CI0.602~0.798)。对病毒感染致脓毒症的患者进行临床研究,同样出现类似现象。Wu等[9]对125例发生脓毒症的COVID-19患者进行单中心回顾性研究发现,低钙血症是COVID-19患者长期住院的独立危险因素。Sun等[10]回顾性分析241例COVID-19患者发现,tCa与发生脓毒症的COVID-19患者病情及预后相关,iCa<2.0 mmol/L的COVID-19患者多器官功能障碍发生率及28 d病死率更高。本研究回顾性分析305例感染性疾病患者,采用PSM减少年龄、性别及感染部位等混杂因素对血钙水平的影响,结果显示,与非脓毒症患者相比,脓毒症患者iCa及tCa更低,同时血钙水平与PCT、IL-6、CRP、SOFA评分等临床指标呈负相关,说明随着炎症反应的加重,感染性疾病患者血钙水平呈下降趋势,与相关研究[11]结果一致,由于iCa水平会受到动脉血气分析仪器、试剂等因素的影响,本研究将iCa水平进行定性分析,通过多因素Logistic回归发现,低钙血症是感染性疾病患者发生脓毒症的独立危险因素(OR=3.504,95%CI1.762~6.969,P<0.001),提示新发低钙血症是判断感染性疾病患者病情严重程度的指标。
PaO2/FiO2是评估患者氧合功能的指标之一,常用于指导急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者的诊疗。肺是炎症因子最容易累及的器官之一,脓毒症时全身炎症反应可损伤肺泡,导致患者氧合能力下降,严重时可诱导ARDS,脓毒症合并严重ARDS患者的病死率高达60%[12]。本研究对感染性疾病患者PaO2/FiO2经等级资料转化后进行分析,结果显示,PaO2/FiO2与感染性疾病患者发生脓毒症有回归关系(OR=2.028,95%CI1.355~3.034,P<0.001),并将变量转化后PaO2/FiO2作为自变量构建联合模型,提高联合模型与SOFA的一致性,提高诊断效能。
qSOFA是根据收缩压、呼吸频率以及意识状态识别脓毒症患者的方法,由于无需抽血检验,目前广泛应用于院前及床旁评估可疑感染性疾病患者[1]。然而qSOFA在识别脓毒症患者中表现出低敏感度,导致假阴性患者的比例较高。为此,近年来相关研究将qSOFA评分联合相关生物标志物,如血乳酸[13]、降钙素原[2]、单核细胞分布宽度[14]等,通过构建联合模型以提高诊断效能,但该类临床研究通常未对联合模型进行验证,其临床模型的可重复性及外推性未能得到验证[15]。本研究通过PSM获得训练集,采用多因素Logistic回归,将新发低钙血症、PaO2/FiO2联合qSOFA构建临床模型,并将原数据集作为验证集,对联合模型的诊断效能进行内部验证。结果显示,联合模型在训练集和验证集中的AUC及敏感度等诊断效能均优于qSOFA评分,可显著减少脓毒症患者的假阴性率,提高诊断效能。
本研究存在一定的不足之处:首先本研究为单中心回顾性研究,同时非脓毒症感染性疾病患者的样本量较少,导致PSM后未能尽可能将脓毒症患者进行匹配,产生偏倚;其次本研究仅对临床模型进行内部验证,缺乏外推性。后续研究可通过增加样本量、选择外部数据集对联合模型的诊断效能进行检验分析。
综上所述,iCa、PaO2/FiO2和qSOFA分值均是临床工作中容易获得的指标,新发低钙血症、PaO2/FiO2低、qSOFA分值高与感染性疾病患者发生脓毒症有回归关系,其中新发低钙血症是独立危险因素,iCa、PaO2/FiO2联合qSOFA构成的临床模型对识别脓毒症患者的诊断效能优于qSOFA,对辅助识别成人脓毒症患者具有一定的参考价值。

