乔松素对心肌缺血再灌注后血管收缩功能的影响机制研究
张 弘, 刘宗军, 刘 颖, 郜俊清
(上海中医药大学附属普陀医院心血管内科,上海 200062)
近年来,我国心血管病危险因素流行趋势明显,据预测,未来10年中国心血管疾病患病率将持续增长,其中缺血性心脏病死亡率增长速度位列各种心脏病之首[1]。虽然近年来药物治疗和介入治疗蓬勃发展,但如何降低冠心病死亡率仍面临巨大挑战。认真审视目前对冠心病发病机制的认识,能进一步优化缺血性心脏病患者治疗策略,降低其死亡率。冠心病急性心肌梗死的再灌注治疗是现代医学发展的里程碑,它使被动、保守治疗转为主动、积极的血运重建,挽救了无数患者的生命。但是再灌注治疗并非完美无缺,其最主要的难题就是冠脉微循环障碍,或由此产生的无复流、慢复流、心肌顿抑、微血栓形成、再灌注损伤等问题。冠状动脉微循环完整性和充分组织灌注是再灌注成功的真正标准。一旦发生无复流现象等冠脉微循环障碍,再成功的经皮冠脉介入治疗也会失败,甚至是有害的[2-3]。因此,再灌注的临床实践告诉我们,不仅要重视心外膜冠状动脉血流,还应重视冠状动脉微循环的血流。
内皮素 (ET,endothelin)是强烈的收缩血管物质[4],包括3种异构体 ET-1、ET-2和ET-3。ET-1与高血压、动脉粥样硬化、急性心肌梗死、充血性心衰、缺血性脑梗死和蛛网膜下腔出血等病理状态下血管的异常收缩、对炎性刺激因子反应性增高等关系密切[5]。细胞外信号调节激酶1/2(ERK1/2,extracellular signal-regulated kinase type1/2)信号转导通路参与 ET-1介导的平滑肌收缩[6],ET-1通过血管平滑肌细胞(VSMC,vascular smooth muscle cell)表面上的2个G蛋白偶联受体(GPCR,G protein-coupled receptor)ETA和ETB发挥作用。目前 ETA受体尚无特异性激动剂,ETA和ETB在ERK1/2通路激活ET-1引发的收缩反应中具体作用如何,鲜见报道。
吡咯烷二硫代氨基甲酸酯(PDTC,pyrrolidine dithiocarbamate) 是一种可以通透细胞膜的NF-κB活化抑制剂,分子式为C5H9NS2·NH3,分子量164.29,其可在多种细胞中抑制 NF-κB 通路的激活。相关研究[7]显示,在1型糖尿病(DM,diabetes mellitus)大鼠主动脉病变的发生、发展过程中,Wnt/β-catenin 信号通路被激活。另有研究[8]显示,PDTC抑制NF-κB的活化后,能抑制 DM 的进程,此过程可能会通过GSK-3β这一关键点,对Wnt/β-catenin通路产生影响。
ATR包括血管紧张素Ⅱ1型受体(AT1R,angiotensin Ⅱ type 1 receptor)、血管紧张素Ⅱ2型受体(AT2R,angiotensin Ⅱ type 2 receptor)。Ang介导纤维化的功能主要与AT1R有关,AngII诱导的AT1R激活,介导了转化生长因子1TGF1、结缔组织生长因子CTGF和缺氧诱导因子HIF1等促纤维化通路。AT2R在胚胎时期的各种组织中表达丰富,出生后大多数组织器官AT2R减少或消失。而AT2R发挥的生物学活性多与AT1R相拮抗,且通常后者起主导作用[9]。
BAX(Bcl-2 associated X protein)是Bcl-2家族中研究最广泛的促凋亡蛋白[10]。BAX定位于细胞浆,自身可形成同源二聚体或与Bcl-2形成异源二聚体。许多细胞凋亡中有BAX表达升高。BAX促进凋亡的机理主要是:①线粒体渗透性转换、氧化磷酸化和ATP的合成功能被破坏;②细胞氧化还原作用改变;③线粒体中的凋亡相关分子Apaf-1释放出来,与细胞色素C相互作用,激活胱冬肽酶(caspase)信号转导途径。
文献[11]中详细分析了冠状动脉微血管功能障碍机制和功能评估。冠脉微循环障碍的病理机制目前尚无确定理论,但众多研究显示冠脉微循环障碍系多因素、多机制相互影响所致,包括微血管病变、血管内皮功能障碍、炎症反应、血液流变性异常等。冠脉微循环灌注障碍发生机理和参与机制目前还不完全清楚,虽然对此有许多解释,但还没有提出一种完善的机理。
我们的前期实验研究提示,在大鼠肠系膜上动脉的血管功能实验中,对于PE及高钾刺激所引起的血管收缩,乔松素有显著血管舒张作用。因此,采用大鼠肠系膜上动脉血管平滑肌细胞研究乔松素对血管收缩舒张相关功能相关受体的表达及对功能的影响,揭示乔松素对心肌缺血再灌注后血管收缩功能影响的潜在机制。
1 材料
1.1 细胞
VSMC细胞购自ATCC公司。
1.2 实验药物及试剂
D-Hank'S液由实验室配制;DMEM培养基、DMSO、抗生素(青链霉素)、胎牛血清均购自美国GIBCO公司;SYBR Green实时荧光定量试剂盒购自TAKARA公司;胰蛋白酶-EDTA消化液(0.25%)购自北京索莱宝科技有限公司;Annexin V-FITC细胞凋亡检测试剂盒、PDTC购自碧云天生物技术有限公司;兔抗大鼠ETB单克隆抗体、兔抗大鼠AT1R单克隆抗体、兔抗大鼠BAX单克隆抗体、兔抗大鼠NF-κB p65单克隆抗体、兔抗大鼠ERK单克隆抗体、HRP标记山羊抗兔IgG购自美国abcam公司;CBA 蛋白浓度测定试剂盒购自美国Pierce公司;细胞裂解液、PMSF、SDS-PAGE蛋白上样缓冲液购自中国索来宝公司。
1.3 仪器
酶标仪购自Thermo公司;PCR检测仪7900购自ABI公司;WB电泳仪购自Bio-RAD公司;高速冷冻离心机CR-GIII购自日本Hitachi公司;流式细胞仪Accuri C6购自BD公司。
1.4 形态学观察和分组
按1×108个/L将细胞接种于96及24孔培养板。培养24 h后,换无血清培养液培养24 h。实验分阴性对照组(加等量D-Hank'S液)、模型组(PDTC,终浓度20 μmoL/L)和不同质量浓度乔松素组(于模型条件培养液中分别加入50 mg/L、100 mg/L和200 mg/L的乔松素干预),各组设8个复孔,培养24 h后,光镜下观察细胞形态。
2 方法
2.1 MTT法测定细胞存活率
上述各组细胞观察大致形态后,每孔加20 μL MTT,继续孵育4 h,弃上清液,每孔加DMSO 150 μL,振荡10 min,使蓝紫色结晶充分溶解,酶标仪测定A570值,细胞存活率=实验组A490 /对照组A490,取平均值。
2.2 流式细胞凋亡检测
依据Annexin V-FITC细胞凋亡检测试剂盒说明书操作,计算阳性细胞凋亡率(%)。
2.3 细胞迁移测定
收集对数生长期细胞,用无血清培养基悬浮细胞,计数后,调整为1×105个/mL。在下室(即24孔板底部)加入600 μL含20%血清的培养基,上室加入150 μL细胞悬液,37 ℃、5%CO2条件下继续培养24 h。甲醇固定,结晶紫染色,晾干,显微镜下取5个随机视野计数,统计结果。
2.4 Real time PCR检测
按照Trizol试剂产品说明书提取细胞总RNA,ETB上游引物:ACCACGCACAATGCCTATGA,ETB下游引物:AGTCTCCGGTTGTGAAGCTG;AT1R上游引物:AGAGGACCACCCCTTCGAAT-A,AT1R下游引物:GAGCCTTCTCCACGATGA-CC;BAX上游引物:AGCCTCTGAAACTGGACA-CG,BAX下游引物:CCTCTTCCTCCTGGCTCTCT;NF-κB p65上游引物:CCGTAGTTCGCTGTACG-AGG,NF-κB p65下游引物:AACTCACGTCGGA-TGTCCAG;ERK1/2上游引物:GCTGAAGGCTGTAGGAGACAC,ERK1/2下游引物:GGAAGG-GGCAAAGGACTGATT;GAPDH上游引物:CC-TGCACCACCAACTGCTTA,GAPDH下游引物:CATCACGCCACAGCTTTCCA。
PCR的反应程序按如下条件进行设定。步骤1(预变性步骤):95 ℃进行30 s;步骤2(PCR反应步骤):95 ℃进行5 s,60 ℃进行40 s;步骤3:95 ℃进行15 s,60 ℃进行1 min,95 ℃进行15 s;40个循环,上机扩增检测,利用2-ΔΔCt计算相对表达量。
2.5 WB检测
参照文献[11]中常规方法进行。
2.6 ROS检测
依据活性氧(ROS)测试盒说明书操作。
2.7 统计学处理
每组实验重复3次,采用SPSS21.0软件进行统计学处理,所有数据以均值±标准差表示,组间采用单因素方差分析和t检验。P<0.05认为存在显著性差异;P<0.01认为存在极显著性差异。
3 结果
3.1 乔松素对PDTC诱导的大鼠主动脉平滑肌细胞存活率的影响
加药处理培养细胞24 h、48 h、72 h后测定结果如图1所示。由图1可以看出,与对照组相比,模型组PDTC能明显降低细胞存活率,不同质量浓度的乔松素(50 mg/L、100 mg/L、200 mg/L)均可明显抑制PDTC的作用,升高细胞存活率。
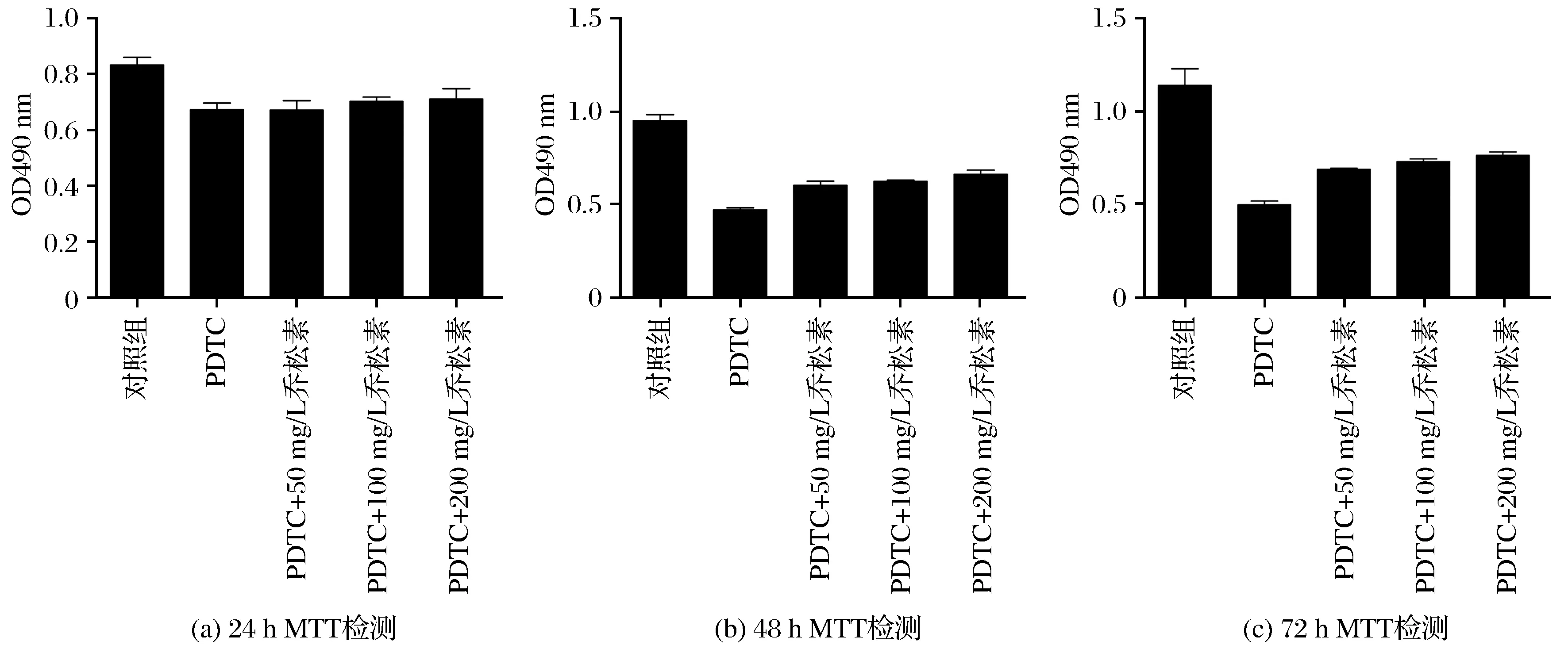
图1 乔松素对PDTC诱导的大鼠主动脉平滑肌细胞存活率的影响Fig.1 Influence of pinocembrin on survival rate of rat aortic VSMC triggered by PDTC
3.2 乔松素对PDTC诱导的大鼠主动脉平滑肌细胞凋亡的影响
乔松素对PDTC诱导的大鼠主动脉平滑肌细胞凋亡的影响如图2、图3所示。由图2、图3可以看出,与对照组相比,模型组PDTC、PDTC+50 mg/L乔松素组均能极显著诱导大鼠主动脉平滑肌细胞凋亡的发生(P<0.05),与模型组相比,PDTC+100 mg/L乔松素组、PDTC+200 mg/L乔松素组能显著降低细胞凋亡的发生(P<0.05);与模型组相比,PDTC+100 mg/L乔松素组和PDTC+200 mg/L乔松素组对细胞凋亡的抑制作用比PDTC+50 mg/L乔松素组更显著。
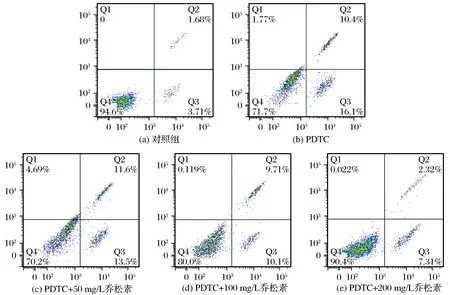
图2 Annexin V-FITC和碘化丙啶染色后的流式细胞仪检测效果Fig.2 Flow cytometry results after Annexin V-FITC/PI

注:*表示与对照组相比,P<0.05;**表示与对照组相比,P<0.01。图3 乔松素对PDTC诱导的大鼠主动脉平滑肌细胞凋亡的影响Fig.3 Influence of pinocembrin on apoptosis of rat aorticVSMC triggered by PDTC
3.3 乔松素对PDTC诱导的大鼠主动脉平滑肌细胞迁移的影响
分别对5个组别Transwell chamber选择5个视野在倒置显微镜下拍照且计数,如图4所示。通过计数计算每组样品细胞的迁移数,乔松素对PDTC诱导的大鼠主动脉平滑肌细胞迁移数的影响如图5 所示。由图5可以看出,与对照组相比,模型组和不同质量浓度的乔松素组(50 mg/L、100 mg/L、200 mg/L)细胞迁移数均明显降低;与模型组相比,不同质量浓度的乔松素组(50 mg/L、100 mg/L、200 mg/L)细胞迁移数随着乔松素质量浓度的升高而升高,且100 mg/L乔松素组细胞迁移数显著高于模型组,200 mg/L乔松素组细胞迁移数极显著高于模型组。

图4 乔松素对PDTC诱导的大鼠主动脉平滑肌细胞迁移的影响Fig.4 Influence of pinocembrin on migration of rat aortic VSMC triggered by PDTC
3.4 mRNA水平上血管内皮相关因子ETB、AT1R、BAX、NF-κB p65、ERK的表达
血管内皮相关因子在mRNA水平上的表达如图6所示。由图6可以看出,与对照组相比,模型组与不同质量浓度乔松素组(50 mg/L、100 mg/L、200 mg/L)中ETB、AT1R、BAX、NF-κB p65、ERK因子在mRNA水平上的表达量高;与模型组相比,不同质量浓度乔松素组(50 mg/L、100 mg/L、200 mg/L)中的ETB、AT1R、BAX、NF-κB p65、ERK因子在mRNA水平上的表达量低,其中200 mg/L乔松素组中ETB、AT1R、BAX、NF-κB p65、ERK因子表达量较其他乔松素组偏低。
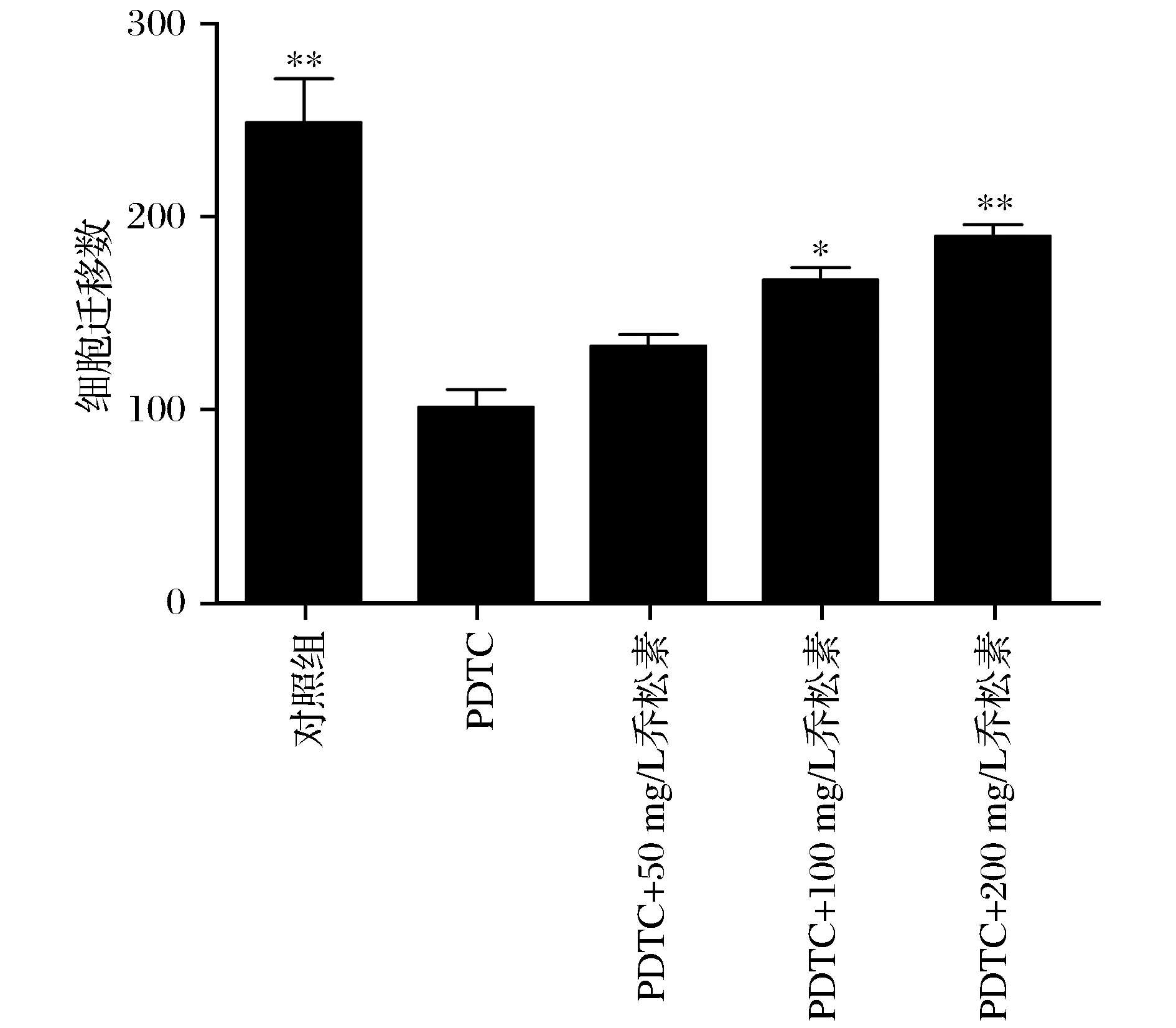
注:*表示与PDTC组相比,P<0.05;**表示与PDTC组相比,P<0.01。图5 乔松素影响PDTC诱导的大鼠主动脉平滑肌细胞迁移数柱状图Fig.5 Histogram of influence of pinocembrin on migrationrate of rat aortic VSMC triggered by PDTC

图6 血管内皮相关因子ETB、AT1R、BAX、NF-κB p65、ERK在mRNA水平上的表达Fig.6 Expression of ETB,AT1R,BAX,NF-κB p65 and ERK on mRNA level
3.5 血管内皮相关因子ETB、AT1R、BAX、NF-κB p65、ERK的表达
血管内皮相关因子在蛋白水平上的表达以及不同组别间的差异表达分别如图7、图8所示。由图7、图8可以看出,与对照组相比,模型组与不同质量浓度乔松素组(50 mg/L、100 mg/L、200 mg/L)中ETB、AT1R、BAX、NF-κB p65、ERK因子在蛋白水平上的表达量高;与模型组相比,中、高质量浓度乔松素组(100 mg/L、200 mg/L)中的ETB、AT1R、BAX、NF-κB p65、ERK因子在蛋白水平上的表达量低,其中200 mg/L乔松素组中ETB、AT1R、BAX、NF-κB p65、ERK因子表达量较其他乔松素组偏低。

图7 血管内皮相关因子ETB、AT1R、BAX、NF-κB p65、ERK在蛋白水平上的表达Fig.7 Expression of ETB,AT1R,BAX,NF-κB p65 andERK on protein level
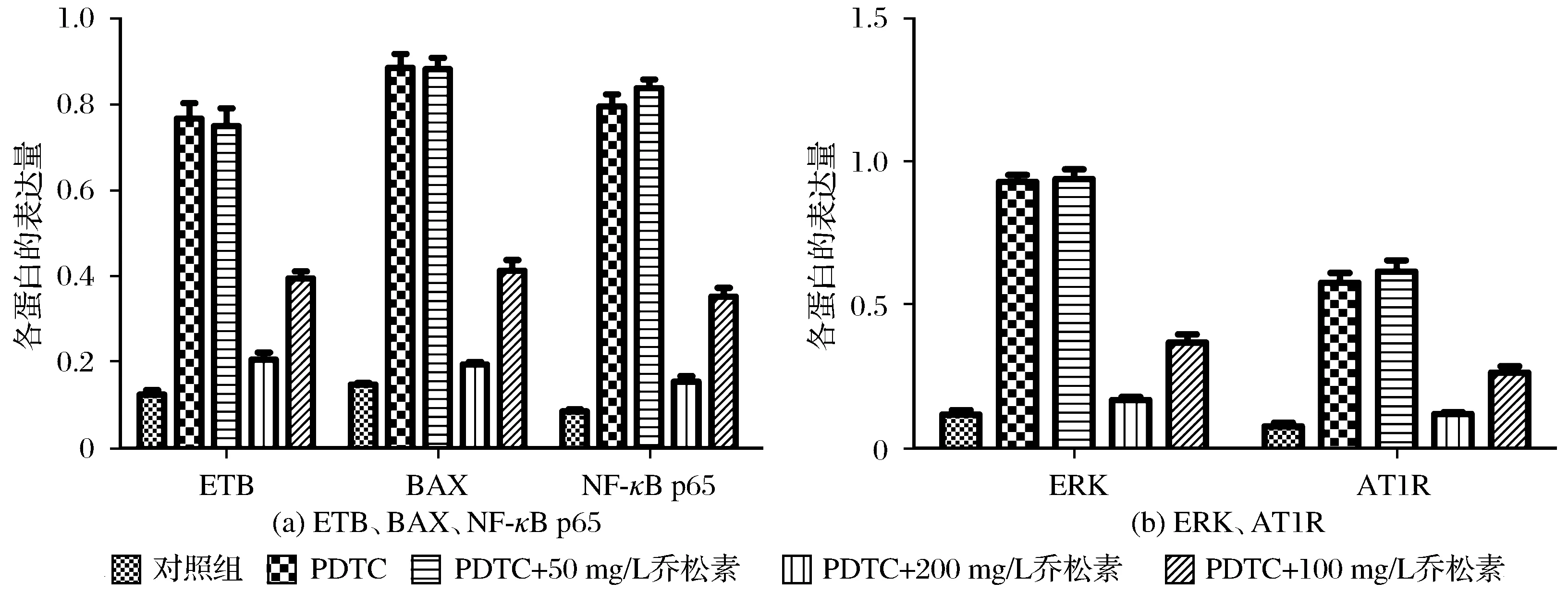
图8 血管内皮相关因子ETB、AT1R、BAX、NF-κB p65、ERK在蛋白水平上不同组别间的差异表达Fig.8 Differential expression of ETB,AT1R,BAX,NF-κB p65 and ERK on protein level in different groups
3.6 ROS在不同动物模型中的相对表达量
ROS在不同组别中的相对表达量如图9所示。由图9可知,与对照组相比,PDTC组和PDTC+乔松素组ROS表达量显著较高(P<0.05),其中200 mg/L乔松素组中ROS表达量较其他乔松素组偏低,说明乔松素质量浓度的增加有助于细胞的抗氧化。
4 讨论
乔松素是一种存在于植物和蜂胶中的含量较高的黄酮类天然化合物,乔松素一直被看作是一种抗氧化剂,同时也是抗炎和抗肿瘤剂[12-16],此外,其还具有抗菌活性[12-19]。乔松素也发挥着神经保护作用,如体外和体内实验模型证明乔松素通过降低BAX/Bcl-2比值抑制谷氨酸诱导的SH-SY5Y成神经细胞瘤细胞死亡[20]。此外,文献[15]中研究证实,乔松素还可以消除大脑皮质神经元和大鼠大脑因缺氧缺糖/复氧损伤造成的不良后果。乔松素在永久性脑缺血中提供了细胞保护作用[21]。乔松素对经MPP+处理的 SH-SY5Y细胞中起到线粒体相关抗凋亡作用[22]。目前,对乔松素的研究多数集中于大鼠脑缺血模型,但对于心肌缺血再灌注损伤的保护少有研究。文献[23]中实验证实,在大鼠急性缺血再灌注模型中,乔松素可降低心律失常的发生以及心梗面积,而该作用可能与增强Cx43磷酸化有关。在有关血管舒张方面,Li等[24-25]研究发现,乔松素可通过阻断AT1R及RhoA/ROCK通路,从而抑制Ang-II所引起的血管收缩,罗国刚等[26]研究发现ERK1/2信号转导通路参与大鼠肠系膜上动脉离体平滑肌细胞ETB受体上调过程。另外NF-κB 信号通路在心血管中的研究日益增多,Roghanidehkordi等[27]、Emadi 等[28]发现,NF-κB 信号通路在DM大鼠主动脉中处于被激活的状态。这种表达的异常是由NF-κB 抑制剂IκB通过不同机制调节的,IκB的磷酸化以及随后IκB的降解,都会引起 NF-κB p65进入细胞核[29],随后会引起大鼠血管功能的紊乱,增加促炎因子的表达,诱发大鼠主动脉炎症等病变。
乔松素的体外实验结果显示[30],其通过增加神经元的活性、降低乳酸脱氢酶的活性、抑制一氧化氮(NO,nitric oxide)和活性氧簇(ROS,reactive oxygen species)的产生、增加谷胱甘肽的水平、下调原代皮层神经元氧-葡萄糖剥夺/再氧化(OGD/R,oxygen-glucose deprivation/reoxygenation)中iNOS 的生成,发挥神经保护作用。乔松素也具有调节线粒体和细胞凋亡的功能。在谷氨酸诱导的SHSY5Y细胞系实验中,已证实乔松素降低了细胞色素C从线粒体转移到细胞质中并减少促凋亡蛋白Bcl-2相关X蛋白(BAX)的合成[31]。Wang等[32]将SH-SY5Y细胞暴露于25 μmol/L的Aβ25-35中24 h引起细胞活力丧失、凋亡增加和ROS的增加,用乔松素预处理细胞4 h显著降低生存活力损失、凋亡率和减少Aβ介导的ROS的产生,可能与乔松素抑制Aβ25-35诱导线粒体功能障碍(包括降低膜电位、降低Bcl-2/Bax 的比值等)有关。

注:**表示与对照组相比,P<0.001。图9 ROS在不同组别中的相对表达量Fig.9 Relative expression of ROS in different groups
我们的研究结果显示,乔松素高剂量组细胞凋亡率显著低于模型组与其他乔松素组(P<0.05);乔松素高剂量组细胞存活率与细胞迁移数显著高于模型组与其他乔松素组(P<0.05);乔松素高剂量组ETB、AT1R、BAX、NF-κB p65、ERK在mRNA水平和蛋白水平表达量方面显著低于模型组与其他乔松素组(P<0.05);模型组ROS表达量显著高于对照组及其他乔松素组(P<0.05)。
综上所述,一方面乔松素对大鼠主动脉平滑肌细胞具有一定的抗凋亡、促增殖和修复作用;另一方面通过mRNA水平和蛋白水平研究,可知乔松素可能通过抑制血管内皮收缩因子ETB、AT1R、BAX、NF-κB p65、ERK的表达,从而缓解PDTC对ERK1/2-RhoA-ROCK-NF-κB信号通路及细胞增殖的抑制,使得大鼠主动脉平滑肌细胞引起的血管收缩能力减弱,进而发挥修复血管平滑肌细胞及舒张血管的作用;再一方面,乔松素可以降低生存活力ROS的损失,发挥保护神经元的作用。研究为改善冠脉微循环治疗的新靶点提供了实验基础和理论依据。以上的研究结果证实,乔松素在体内和体外均有显著的治疗作用,具有很大的临床应用价值。

