大豆类胡萝卜素裂解双加氧酶GmCCD8固氮功能解析
邢馨竹, 杨占武, 孔佑宾, 李文龙, 杜汇, 李喜焕, 张彩英
(河北农业大学农学院,教育部华北作物种质资源研究与利用重点实验室,河北 保定 071001)
大豆(Glycine max)是我国种植面积最大的豆科作物,也是需氮较多的作物[1-2]。大豆可与土壤中的根瘤菌共生互作,在固氮酶的作用下进行根瘤固氮,将空气中游离态的氮转化为氨,一般根瘤固氮可提供植物所需氮素的50%~60%。共生固氮是一种无污染、可持续、廉价并高效地增施氮肥的方式[3],其过程是土壤中的根瘤菌通过豆科植物根毛或侧根杈口侵入其根部形成侵染线,进到根的皮层,刺激宿主皮层细胞分裂进而形成根瘤[4]。根瘤菌在侵染细胞内以类菌体形式存在,由根瘤菌泡囊包围,并随类菌体的增多积累聚β-羟基丁酸盐(poly-β-hydroxybutyrate,PHB)和多磷酸盐颗粒(polyphosphate particle,PP)等物质[5],豆科根瘤中PHB的积累程度与根瘤固氮和糖代谢能力息息相关[6]。豆科植物结瘤固氮能力与根瘤鲜重、大小及固氮酶活性等显著关联。
在植物中,类胡萝卜素主要存在于叶绿体和液泡中,可作为抗氧化剂防止光氧化损伤,在光合作用中发挥重要作用。类胡萝卜素可以被裂解为一些醇类、酚类等小分子,如独脚金内酯、维生素A、脱落酸(abscisic acid,ABA)以及一些有挥发性气味的芳香类化合物[7-8]。分解类胡萝卜素的类胡萝卜素双加氧酶可分为2类:9-顺式环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenases,NCEDs)和类胡萝卜素裂解双加氧酶(carotenoid cleavage dioxygenases, CCDs)。NCEDs和CCDs的功能在玉米、水稻、大豆等多种作物中已被报道[9],NCEDs主要与脱落酸形成有关,而CCDs主要参与一些色素类、酚类、萜类物质和独脚金内酯的合成。玉米中发现的类胡萝卜素双加氧酶VP14属于NCED类,其被证实与ABA合成有关[10];拟南芥中通过同源性比对发现4个CCDs(CCD1、4、7、8),并证明CCDs与NCEDs具有不同的酶活性和催化底物,说明它们具有不同的生物学功能[10-11]。
据报道,类胡萝卜素裂解双加氧酶CCD1参与了多种植物果实成熟过程,同时与植物生殖生长及根系形成有关[12-13];CCD1在树莓、玫瑰等植物成熟过程中参与挥发性芳香化合物形成[14];CCD4参与多种植物花和果实芳香类化合物合成和果实成熟过程,在花和其他生殖组织中高水平表达[15-18];CCD7和 CCD8 参与激素独脚金内酯(strigolactones,SLs)合成[19],其中CCD7被证实与水稻分蘖有关[20],拟南芥AtCCD7主要在根、茎、叶、花等的维管束中特异表达[21-22];CCD8可通过调控SLs影响马铃薯主枝侧枝和匍匐茎的形成[23];但CCDs对根瘤形成和生长的影响鲜见报道。
本研究通过分析根瘤不同发育时期的转录组数据发现,随着根瘤的生长发育,GmCCD8表达量递增,且接种根瘤菌28 d后达到最大值,暗示GmCCD8可能参与大豆根瘤的生长发育。为此,本研究通过基因克隆、实时定量、亚细胞定位、启动子表达分析、过表达和基因干扰等技术,进一步验证GmCCD8在大豆根瘤固氮中的生物学功能,以期为大豆根瘤固氮相关基因功能解析提供理论支撑,为大豆高效固氮分子育种奠定物质基础。
1 材料与方法
1.1 材料与菌种
大豆品种中黄15和野生型拟南芥(Columbia)由河北农业大学大豆课题组提供;大肠杆菌TOP10感受态细胞购自北京博迈德基因技术有限公司;发根农杆菌K599购自上海唯地生物技术有限公司;慢生根瘤菌Bradyrhizobium diazoefficiensUSDA110为中国科学院遗传与发育生物学研究所提供。
将整齐一致、颗粒饱满的大豆种子用氯气消毒10~12 h,置于铺有湿润滤纸的培养皿中28℃催芽3 d,待芽长至5 cm左右播种于装满蛭石的花盆中,每盆1粒,共60盆,生长条件为16 h光照、8 h黑暗,光照强度10 000 lx,温度28℃,湿度60%,生长期间所浇灌低氮营养液(2.5 mmol·L−1K2SO4、2 mmol·L−1MgSO4·7H2O、0.5 mmol·L−1KH2PO4、0.15 mol·L−1FeCl2、0.1mol·L−1NH4NO3、0.046 mmol·L−1H3BO3、0.004 2 mmol·L−1MnCl2·4H2O、0.000 8 mmol·L−1ZnSO4、0.000 5 mmol·L−1CuSO4、0.001 mmol·L−1MoO3、0.000 1 mmol·L−1CoCl2·6H2O)。将慢生根瘤菌 USDA110 在 YMB液体培养基(北京酷来博科技有限公司)中28℃培养2~3 d,待大豆第1片真叶展开时,用注射器吸取蒸馏水稀释的根瘤菌液(OD600=0.08)浇于大豆植株根部,每株30 mL。接种根瘤菌后10、17、28 d分别为根瘤发育初期、中期和成熟期,每个时期选取15株大豆植株上符合发育时期的大小一致的根瘤进行取样,样品于液氮速冻,−80℃保存备用。
1.2 试验方法
1.2.1GmCCD8的克隆 使用天根生化科技有限公司的RNA多糖多酚植物总RNA提取试剂盒提取28 d根瘤样品的RNA;使用反转录试剂盒(PrimeScript™ 1stStrand cDNA Synthesis Kit,TaKaRa)反转录cDNA;利用NCBI中的Primer Blast设计特异引物(表1)扩增GmCCD8ORF。扩增体系参照大连TaKaRa公司PrimeSTAR@Max DNA Polymerase说明书,采用推荐三步扩增法:98℃3 min;98 ℃ 10 s,58 ℃ 15 s,72 ℃ 30 s,34个循环;72℃5 min;12℃保温)。扩增后的PCR产物经琼脂糖凝胶电泳鉴定、回收、纯化、连接转化等过程将目的片段连接到测序载体,筛选到的阳性克隆送苏州金唯智有限公司进行测序分析。
1.2.2GmCCD8表达模式分析 提取10、17、28 d根瘤样品总RNA;使用大连TaKaRa公司的反转录试剂盒PrimeScript™RT reagent Kit with gDNA Eraser(Perfert Real Time)反转录cDNA,通过BIORAD CFX96 Real-Time PCR仪,采用2×SYBR@染料法进行qRT-PCR分析(引物见表1,以actin11为内参对照)。qRT-PCR体系为:SYBR 10µL,cDNA 1µL,前引物和后引物各1µL,H2O 7µL。反应程序为:95 ℃ 30 s;95 ℃ 15 s,58 ℃ 15 s,72 ℃15 s,30个循环;10℃保温。

表1 本研究所用引物Table 1 Primers used in this study
1.2.3 GmCCD8亚细胞定位 利用WoLF PSORT(http://wolfpsort.seq.cbrc.jp/)预测GmCCD8的亚细胞定位,利用限制性核酸内切酶XbaⅠ和BamHⅠ(TaKaRa)在37℃条件下分别双酶切326-GFP载体和GmCCD8PCR产物30 min,然后使用T4 DNA Ligase(TaKaRa)在 16 ℃连接 16 h,转化TOP10感受态细胞。筛选阳性克隆,凯杰生物质粒大提试剂盒提取质粒,−20℃保存。野生型拟南芥种植于光照培养室,生长条件为16 h光照、8 h黑暗,温度23℃,湿度70%,定期浇Hoagland营养液。取20片生长4周左右的拟南芥叶片,用刀片切割后转移到10 mL酶解液中,室温避光酶解3 h,用血球计数板在显微镜下计算原生质体数量,达到约105cell·100 µL−1;吸取10 µg 326-GFPGmCCD8质粒转化拟南芥原生质体,以35S-GFP为阳性对照,培养16 h后利用FV10i激光共聚焦显微镜(Olympus,日本)观察GFP发光情况。
1.2.4GmCCD8基因表达模式分析 将GmCCD8起始密码子上游2 000 bp序列克隆到PHY107载体,构建PGmCCD8-GUS融合表达载体,转化TOP10感受态细胞,提取阳性克隆质粒,转化发根农杆菌K599,诱导转GmCCD8启动子的毛状根:利用注射器针头划伤并侵染萌发3~4 d的大豆下胚轴,种植在蛭石中,14 d后利用GUS染色技术对划伤处生长的毛状根进行筛选。对染色成功的阳性毛状根接种根瘤菌,分别取接菌后10、17、28 d的根和根瘤进行GUS染色,观察GmCCD8启动子驱动基因的表达情况。
1.2.5GmCCD8生物学功能分析 将GmCCD8ORF利用限制性核酸内切酶XbaⅠ和BamHⅠ双酶切30 min,T4 DNA Ligase连接16 h,克隆到带有GUS报告基因的PCAMBIA1304过表达载体;将GmCCD8220 bp特异片段分别用KpnⅠ和SpeⅠ、SacⅠ和BamHⅠ酶切,并连接构建到带有GUS报告基因的PTCK303 RNAi载体。利用发根农杆菌K599介导的毛状根转化法获得转GmCCD8过表达(overexpression,OX)和RNAi干扰的复合阳性植株(方法同1.2.4)。利用GUS染色技术对划伤处生长的毛状根染色,筛选染色成功的阳性毛状根进行根瘤菌接种,28 d后鉴定表型,野生型根作为阴性对照。采用乙炔还原法[24]测定固氮酶活性。每处理选取30株带有根瘤的阳性根分别放于10 mL真空管中,用注射器抽出2 mL空气,再打进制备好的乙炔气体2 mL,将该真空管放入28℃摇床,3~4 h后抽取1 mL气体,用气相色谱仪检测固氮酶活性。色谱条件为:色谱柱为毛细管柱,载气速度1 mL·min−1,进样量5 µL,进样口温度130℃,检测器温度230℃,柱温80℃。制备完乙烯气体之后,分别摘取真空管中的所有根瘤,将根瘤称重后,根据气相色谱结果计算固氮酶活性[24]。
1.2.6GmCCD8RNAi根瘤透射电镜分析 将接菌28 d的野生型和RNAi根瘤取下,用刀片切取观察部位,将样品浸入混合固定液中进行前固定,放置4℃冰箱2 h左右;用PBS冲洗3次,10 min后进行脱水、置换,用丙酮和812包埋剂包埋,聚合后切片干燥,用2%醋酸铀饱和酒精溶液染色,随后用HT7800透射电镜(Hitachi,日本)进行扫描,观察野生型和RNAi根瘤的内部结构[25]。
2 结果与分析
2.1 GmCCD8的序列分析
以接种根瘤菌28 d的大豆根瘤cDNA为模板,利用GmCCD8ORF特异引物扩增目的序列,得到与目的序列大小相似的扩增片段,经测序发现该基因序列长度为1 692 bp,与Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)已公布的Glyma.06G085800序列相同。该基因组序列全长3 888 bp,包含5个内含子和6个外显子;cDNA长度为2 046 bp,除1 692 bp的ORF外,还包含134 bp的5’非翻译区(5’-UTR)和220 bp的3’非翻译区(3’-UTR),编码563个氨基酸。
2.2 不同发育时期根瘤GmCCD8表达分析
对不同发育时期根瘤的GmCCD8进行qRTPCR分析,结果表明,随着根瘤的生长发育GmCCD8表达量持续上升,且接种后28 d的表达量与根瘤生长初期和中期相比极显著提高,此时根瘤已成熟,并具有旺盛的固氮能力。因此,推测GmCCD8的高效表达与根瘤的生长发育及固氮能力相关(图1)。
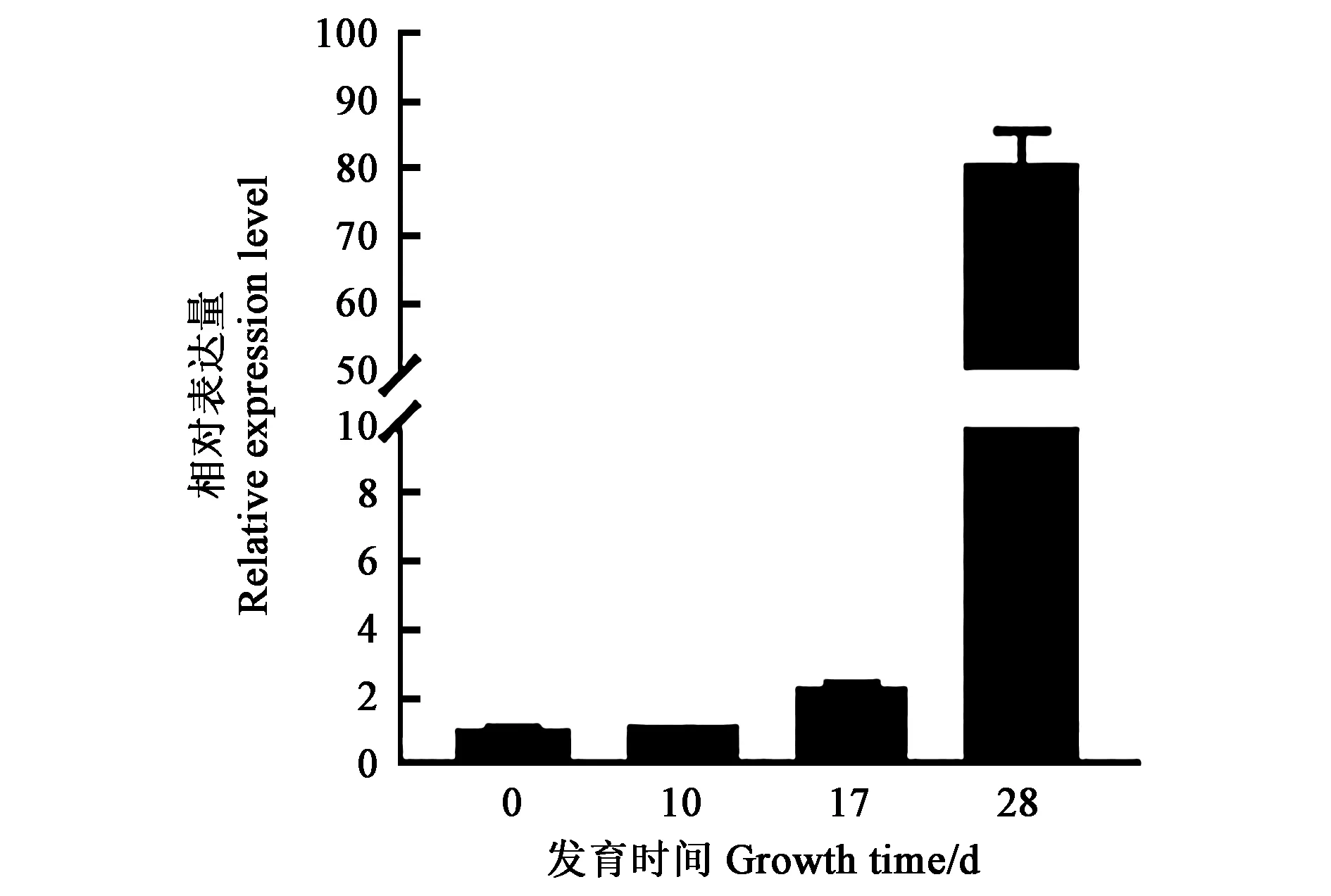
图1 GmCCD8根瘤表达量Fig.1 Relative expression of GmCCD8 in nodules
2.3 GmCCD8亚细胞定位分析
WoLF PSORT预测GmCCD8定位于细胞质。为了对其进一步验证,本研究利用构建的亚细胞定位载体326-GFP-GmCCD8和35S-GFP阳性对照载体转化拟南芥原生质体,培养室培养16 h后观察GFP荧光信号,结果显示GmCCD8定位于细胞质(图2),与预测结果相同,说明GmCCD8在细胞质中发挥作用。
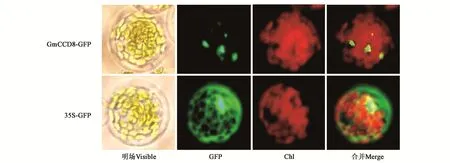
图2 GmCCD8在拟南芥原生质体中亚细胞定位Fig.2 Subcellular localization of GmCCD8 in Arabidopsis protoplasts
2.4 GmCCD8表达模式分析
转基因毛状根中的GUS染色结果显示,GmCCD8在根和根瘤中均有表达,且随着根瘤的生长发育GUS染色逐渐加深,成熟期着色最深(图3),与实时定量结果一致,进一步暗示GmCCD8参与根瘤的生长发育,并且主要在根瘤成熟期发挥作用。

图3 转GmCCD8启动子的阳性根瘤不同发育时期GUS染色Fig.3 Histochemical GUS staining of nodules with GmCCD8 promoter in different developmental stages
2.5 GmCCD8在根瘤中的生物学功能分析
将构建好的PCAMGIA1304-GmCCD8过表达载体、PTCK303-GmCCD8RNAi载体转化发根农杆菌并侵染毛状根,通过GUS染色筛选阳性毛根,分析其GmCCD8表达量、根瘤鲜重和固氮酶活,结果显示,GmCCD8在过表达阳性毛根(OX)的表达量比对照组提升2.3倍,根瘤鲜重提升36%,固氮酶活活性提高33%;与对照组相比,GmCCD8在RNAi阳性毛根(RNAi)的表达量下降了2.5倍,随着GmCCD8表达量的下降,根瘤鲜重与固氮酶活分别降低40%和30%(图4)。根瘤鲜重和固氮酶活是根瘤固氮能力的重要指标,由此推测GmCCD8在根瘤发育和固氮中具有重要的作用。

图4 GmCCD8转基因复合植株根瘤表型及指标分析Fig.4 Index and phenotypic of nodules in GmCCD8 transgenic composite plants
2.6 GmCCD8干扰根瘤透射电镜分析
为了进一步验证GmCCD8在根瘤发育中的作用,本研究对根瘤内部结构进行了观察。透射电镜观察结果显示,野生型根瘤具有正常生长的共生体,根瘤内部的根瘤菌在泡囊中分裂增殖,泡囊不断伸长随之根瘤也不断加大,并且积累了大量聚β-羟基丁酸盐(PHB);然而GmCCD8干扰后,根瘤内泡囊受损或整体变成长椭圆形且边缘不规则化,泡囊内类菌体减少且PHB积累降低(图5)。说明GmCCD8严重影响根瘤内部结构和根瘤菌与大豆根瘤的共生互作,推断GmCCD8对根瘤发育具有重要作用。
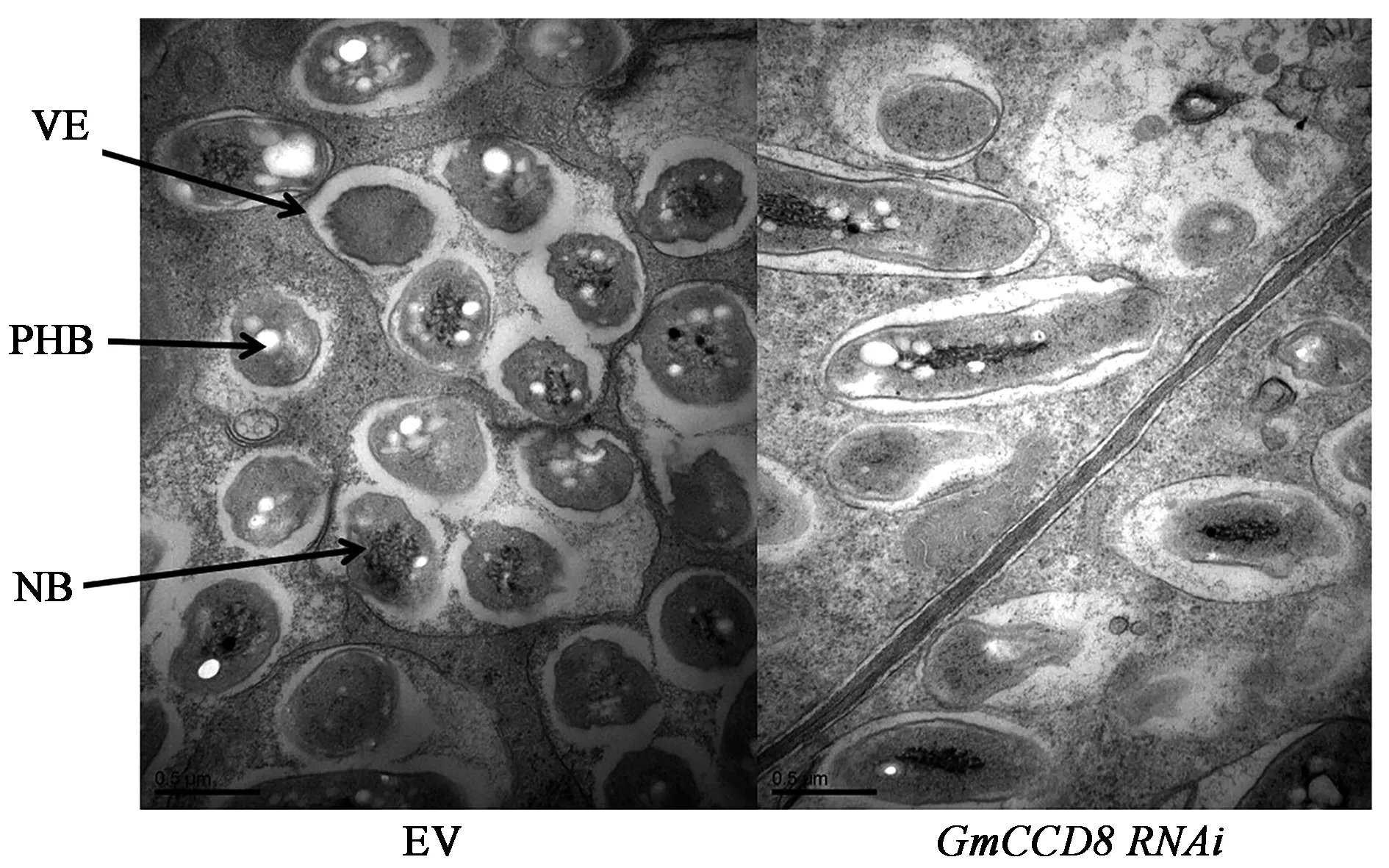
图5 GmCCD8 RNAi 28 d根瘤显微结构Fig.5 Nodule ultrastructure of GmCCD8 RNAi at 28 d
3 讨论
诸多研究证明,类胡萝卜素双加氧酶在植物生长过程中发挥着重要作用,不同的CCDs表达部位不同,说明它们的功能不同。Kim等[26]研究发现,GmCCD8在根瘤中表达量较高,并且在瘤成熟期时表达量最高。本研究在根瘤不同发育时期对GmCCD8进行了qRT-PCR分析,结果显示,随着根瘤的生长,其表达量逐渐增加,在生长28 d的成熟根瘤中表达量与其他时期相比显著提高,GmCCD8启动子-GUS表达模式研究表明,随着根瘤的生长,GUS在毛状根和根瘤中的着色逐渐加深。上述结果说明,GmCCD8在根瘤生长中发挥着重要作用。
独脚金内酯(SLs)及其衍生物作为新型内源性植物激素可调控植物根系发育过程,如主根伸长、侧根形成、不定根及根毛生长等[21]。目前明确的SLs合成途径为:all-trans-β-类胡萝卜素在类胡萝卜素异构酶催化作用下生成9-cis-β-类胡萝卜素,随后9-cis-β-类胡萝卜素在CCD7裂解作用下生成 9-cis-β-apo-10’-胡萝卜醛,继而在CCD8的作用下生成己内酯,己内酯在己内酯氧化酶作用下生成5-脱氧独脚金醇,再经过一系列酶促反应转变为独脚金内酯[21,27]。近期研究表明,SLs在根瘤的生长发育中也发挥着很重要的作用[28]。GR24是SL的人工合成类似物,在苜蓿中通过外施GR24,首次发现SLs参与根瘤菌与豆科植物共生结瘤过程,能够促进根瘤的形成[29];豌豆CCD8突变体rms1根瘤数较野生型降低40%,同时通过对CCD8突变体rms1外施GR24可增加其结瘤数[30];苜蓿根瘤感染区中同时检测到SLs生物合成基因MtD27、MtCCD7和MtCCD8的表达[31];在番茄中,CCD8被敲除后,列当醇和茄酚含量下降,与野生型相比主根长度变短,侧根减少,列当醇是番茄根中分泌的独脚金内酯,其含量下降说明CCD8基因的表达量影响了独脚金内酯的含量及根系的生长[32];百脉根LjCCD7基因沉默后,根瘤数目比野生型减少20%[33]。
本研究利用毛根转化法获得GmCCD8过表达和RNAi转基因根瘤,GmCCD8过表达后根瘤鲜重和固氮酶活性与对照相比分别提高36%和33%,而GmCCD8干扰后根瘤鲜重与固氮酶活性分别下降40%和30%,与前人结果一致,表明GmCCD8参与大豆根瘤的生长发育及生物固氮。
前人研究表明,根瘤中糖酵解生成的丙酮酸在进入TCA循环的同时也形成PHB,在土壤低氧环境中TCA循环会受到NADH/NAD+氧化还原状态的限制,PHB合成会减缓这些氧化还原产物的限制来维持TCA循环,大豆固氮所需的能量主要由TCA循环提供,所以PHB的含量直接影响了根瘤的固氮能力[5,34]。本研究对GmCCD8RNAi阳性根瘤的透射电镜观察结果分析,GmCCD8的沉默影响了PHB的含量及类菌体与泡囊的形成,由此推测,GmCCD8会影响根瘤菌与根瘤的互作从而影响根瘤的固氮能力。

