瞬时受体电位通道蛋白5对糖尿病性心肌病炎症的调节作用
崔艺璇,周 翔,刘 宽,马学玉,肖焱波,祁艳艳,李干鹏
(云南民族大学民族医药学院,民族药资源化学国家民委教育部重点实验室,云南 昆明 650500)
心肌炎(myocarditis)是由于心肌损伤后,免疫炎症细胞浸润心肌造成的炎症疾病。心肌炎中约30%可能会进展为扩张性心肌病,占所有非缺血性糖尿病性心肌病(diabetic cardiomyopathy,DCM)成人患者中的9%~16%[1],其中12%~17%的患者会由心肌炎导致心力衰竭[2]。由心肌细胞和免疫细胞产生各种细胞因子形成的抗炎机制对维持心肌功能和研究相关信号通路具有重要的作用。DCM已被证实为糖尿病独立的并发症,是无法用高血压性心脏病、冠状动脉粥样硬化性心脏病及其他心脏病变来解释的心肌疾病,亦是引起糖尿病患者心力衰竭和死亡的高风险因素之一。临床上主要表现为左心室功能障碍、心肌间质纤维化和心肌细胞肥大,其发病率呈现逐年增高的趋势[3]。DCM发病机制复杂,涉及高糖所致的心肌细胞毒性反应和微血管病变、心肌细胞线粒体损伤、心肌脂代谢异常、心肌炎症反应与细胞凋亡、肾素血管紧张素系统活化以及交感神经与钙输送异常等多个方面[4]。
临床研究发现,经降糖药物治疗后虽然可降低糖尿病病人心衰并发症的发病风险,却无法显著地降低DCM的预后,必须同时给以血管紧张素转化酶抑制剂、利尿剂及β-受体阻滞剂等以缓解心功能不全所引发的症状[5]。持续高血糖状态可导致机体产生过多的促炎因子如核转录因子-κB (nuclear factor-κB,NF-κB)及白介素-6 (interleukin-6,IL-6)等的产生。且在炎症反应时,心肌细胞周围基质发生重构[6],心肌收缩力显著性下降,同时心肌细胞凋亡大量发生,继而发生代偿性的增生以及心肌肥大。通过对心肌炎症反应调节的研究,可在一定程度上促进既有降糖作用又能改善心功能不全的DCM新型有效治疗药物的发掘。
经典瞬时受体电位(canonical transient receptor potential,TRP)通道是一组钙通透性通道,含有6个跨膜结构(S1-S6),包含C1-C7等7个成员,参与多种细胞功能的调节[7]。虽然TRPC5在DCM发生发展过程中的作用至今还少有报道,但在心衰病人的心脏组织中均发现有TRPC5在mRNA及蛋白水平的表达增高[8]。本课题组前期研究显示,高糖喂养条件下,TRPC5-/-小鼠空腹胰岛素水平显著性高于C57BL/6J小鼠[9],且在TRPC5基因被抑制后可显著降低2型糖尿病小鼠血糖水平。鉴于炎症反应在糖尿病发生发展中的重要作用[10],本文旨在系统阐述TRPC5对DCM发生发展过程中心肌细胞炎症反应的调控作用,以期为探寻DCM防治的新靶点提供理论依据。
1 材料与方法
1.1 实验动物C57BL/6J种鼠购于湖南楚商动物养殖中心许可证号SCXK(湘)2019-0004。TRPC5-/-小鼠由中国科学院昆明植物研究所提供种鼠,许可证号:SCXK(京)2014-000,实验动物在清洁级动物房内繁殖和饲养,环境温度25 ℃,相对湿度0.40~0.60,光照/黑暗各12 h循环。
1.2 药物与试剂EDTA-胰蛋白酶消化液(批号:SH30042.01)、石蜡(批号:H1053)、RIPA Lysis Buffer(批号:CW2333S)、二甲基亚砜(批号:D8370-100)、β-actin鼠单克隆抗体以及山羊抗小鼠IgG(批号:SC-133118)、ECL化学发光显色剂(批号:CW0049M)、多聚甲醛(批号:P1110)、High Glucose、Low Glucose培养基(批号:10-040-CV)、胎牛血清(批号:FSP500)均购自北京康为世纪生物科技有限公司;肌酸激酶试剂盒(批号:H032-1-1)、心肌肌钙蛋白I(cTn-I)测试盒(批号:H149-2)、肌红蛋白(Mb)测试盒(批号:H150)、肌酸激酶同工酶试剂盒(批号:H197)均购自南京建成有限公司生物工程研究所。IL-2小鼠单克隆抗体(F-5)(批号:SC-133118)、IL-6小鼠单克隆抗体(10E5)(批号:SC-57315)、IL-1β小鼠单克隆抗体(B122)(批号:SC-12742)均购自艾美捷科技有限公司。
1.3 仪器荧光显微镜(DMI3000B,Leica)、微量加样器(Eppendorf)、蛋白印迹体系(Bio-RAD)、恒温金属浴HB系列(Wealtee)、化学发光成像仪(ChemiDOCXS+,Bio-RAD)、PCR仪(BIOER)、高压蒸汽灭菌锅(LP-CPS500)、-80 ℃冰箱(Thermo)、恒温水浴锅(成都泰盟科技有限公司)
1.4 实验分组及造模实验采用5周龄雄性C57BL/6J小鼠10只,体质量(18~22)g;5周龄雄性TRPC5-/-小鼠10只,体质量(18~22)g。随机分为对照组和高糖组(n=5),对照组正常饮水进食,高糖组给予质量浓度为100 g·L-1的糖水和高糖饲料8周。8周后,高糖组连续腹腔注射链尿佐菌素(STZ)1周,建立2型糖尿病(T2DM)模型。血糖检测结果高于16.7 mmol·L-1,且停止高糖饲养之后,监测血糖保持在高水平(>16.7 mmol·L-1)不降低则认为造模成功。
1.5 生物信息学分析运用生物信息学方法对TRPC5基因进行分析,在DAVID网站通过蛋白互作构建找到核心基因,运用omicshare对其进行GO功能富集和KEGG信号通路富集,将生物学过程、细胞组成、分子功能和信号通路进行注释,对关联基因构建蛋白质互作网络图(protein-protein interaction,PPI)。
1.6 生化指标检测取小鼠心脏组织,通过病理切片进行HE以及Masson染色,观察组织变化,并记录拍照;提取心脏组织RNA进行逆转录,运用QPCR检测小鼠心肌中IL-6、INF-α、IL-1β、IL-10、IL-18以及TRPC5的表达情况并进行统计;取小鼠血清,酶联免疫吸附实验(ELISA)检测血清中IL-1β、IL-2、IL-6、IFN-γ、肌酸激酶、肌酸激酶同工酶、肌红蛋白和肌钙蛋白的含量;并通过Western bolt检测相关蛋白的表达。
1.7 小鼠原代细胞指标检测原代培养TRPC5-/-和C57BL/6J乳鼠的心肌细胞,使用免疫荧光法进行鉴定。巨噬细胞来源于C57BL/6J小鼠,通过高糖培养模拟糖尿病体内环境,与高糖环境培养的心肌细胞交换培养基后继续培养48 h,用RT-PCR检测原代小鼠心肌细胞以及小鼠巨噬细胞中各种炎症因子及TRPC5表达水平。

2 结果
2.1 生物信息学
2.1.1PPI蛋白网络构建 利用Gene Cards数据库对目标基因TRPC5进行搜索,通过STRING网站对TRPC5基因相关联的基因所编码的蛋白进行互作分析构建PPI,将从STRING中得到的蛋白进行网络数据互作。
利用DAVID数据库在基因本体(gene ontology,GO)中进行功能富集,并注释其参与的生物学过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF),通过KEGG信号通路富集对差异基因进行分析。对多个关联基因构建蛋白质互作网络,除去孤立无互作的蛋白,构建出30个基因组成的PPI网络。分析结果提示TRPC5与炎症基因蛋白IL-2、IL-6、IL-10以及IL-18等都有相关性(Fig 1)。

Fig 1 PPI protein network related to TRPC5
2.1.2GO功能和KEGG信号通路富集分析 提取核心基因,运用GO功能及KEGG信号通路富集对这些基因进行分析。其中,GO功能富集结果提示核心基因在生物学过程中的主要富集在细胞过程(cellular process)、生物调节(biological regulation)、信号传输(signaling)、免疫系统过程(immune system process)等17个生物学过程中。在细胞组成中主要富集在细胞(cell)、膜(membrane)、胞外区(extracellular region)等8个部分。分子功能主要富集在转运体活动(transporter activity)、信号换能器活动(signal transducer activity)等5个活动(Fig 2)。由此可见TRPC5除作为钙离子通道进行生物信号传导外,还参与了生物调节和免疫系统过程。
KEGG信号通路主要富集在MAPK信号通路(MAPK signaling pathway)、cGMP-PKG信号通路(cGMP-PK G signaling pathway)、Toll样受体信号通路(Toll-like receptor signaling pathway)、NF-κB信号通路(NF-κB signaling pathway)等二十个信号通路(Fig 2)。可推断TRPC5基因参与了生物免疫过程,或与炎症过程密切相关。

Fig 2 GO function enrichment map of TRPC5 gene Through biological process,cell composition and molecular function wereanalyzed for correlation.

Fig 3 KEGG function enrichment map of TRPC5 gene
2.2 生化指标检测结果
2.2.1小鼠基因型检测 提取小鼠心脏组织RNA,用琼脂糖凝胶电泳检测TRPC各亚型表达情况,结果显示TRPC5基因在TRPC5-/-小鼠心脏组织中不表达(Fig 4)。
2.2.2小鼠体质量及血糖变化 对比各组小鼠血糖及体质量(Fig 5),高糖组比对照组体质量减轻,血糖水平明显升高(P<0.05)。虽然两种小鼠间血糖差异无显著性,但与对照组相比,C57BL/6J小鼠高糖组比TRPC5-/-高糖组体质量减轻更多,血糖也升高更多,证明TRPC5基因敲除后可在一定程度上抑制糖尿病造成的体质量减轻症状。
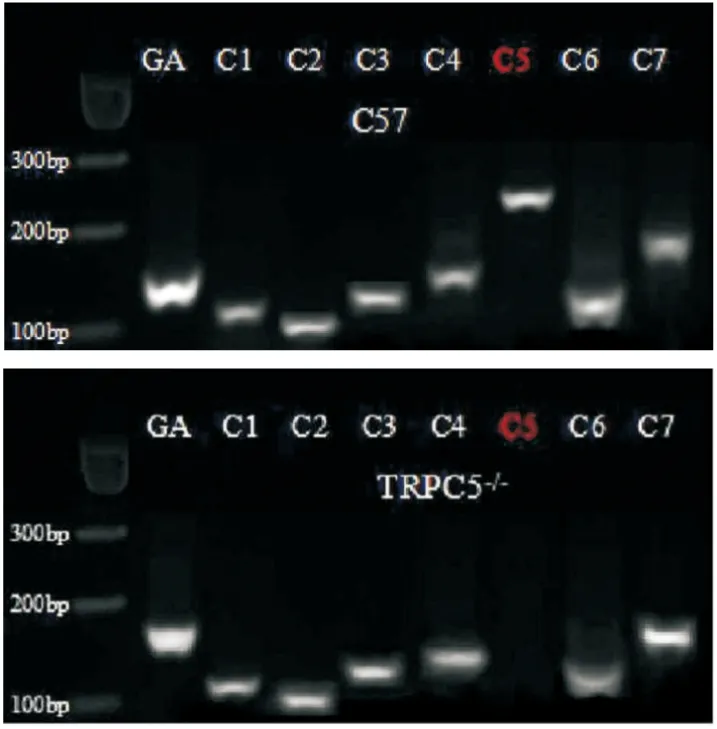
Fig 4 Expression of TRPC subtypes in mouse heart tissue,GAPDH as internal reference control

Fig 5 Body weight and blood glucose n=5)1:TRPC5-/- CON;2:TRPC5-/- HG;3:C57BL/6J CON;4:C57BL/6J HG;*P<0.05,**P<0.01 vs TRPC5-/- CON;##P<0.01 vs C57BL/6J CON;$$P<0.01 vs TRPC5-/- HG.
2.2.3心肌切片染色结果 从HE染色结果(Fig 6)可看出,对比正常组,C57BL/6J小鼠和TRPC5-/-小鼠高糖组心肌组织细胞排列更加松散,病变区域更多。从Masson染色(Fig 7)可看出,与对照组相比,模型组的心肌组织胶原纤维浸润更多,心肌炎症程度更严重。此外,TRPC5-/-小鼠高糖组比C57BL/6J小鼠高糖组胶原纤维浸润相对减少,提示抑制TRPC5基因能在一定程度上减缓糖尿病性心肌病的心肌炎症损伤。

Fig 6 HE staining of paraffin sections of mouse myocardium (100×)A:C57BL/6J normal;B:C57BL/6J high glucose;C:TRPC5-/- normal;D:TRPC5-/- high glucose.

Fig 7 Masson staining of paraffin sections of mouse myocardium (100×)A:C57BL/6J normal;B:C57BL/6J high glucose;C:TRPC5-/- normal;D:TRPC5-/- high glucose.
2.2.4炎症细胞因子RT-PCR检测结果 与对照组相比,模型组中相关炎症因子IL-1β、IL-6、IL-10、IL-18以及INF-α的表达均明显升高(P<0.05或0.01)。空白组中TRPC5-/-小鼠IL-6和IL-10都与C57小鼠无差异,在此基础上,TRPC5-/-模型组小鼠IL-1β、IL-6、IL-10及IL-18表达均低于C57BL/6J模型组小鼠(P<0.05,Fig 8)。提示TRPC5基因敲除后,一定程度上抑制了糖尿病病理条件下心肌组织炎症反应。
2.2.5小鼠血清ELISA检测 检测结果显示,与对照组相比,两种模型组小鼠血清中相关炎症因子IL-1β、IL-6、IL-2的含量均升高(P<0.05或0.01),与RT-PCR结果相呼应。空白组中TRPC5-/-小鼠IL-2和IL-6都与C57小鼠差异无显著性,而模型组中,TRPC5-/-小鼠的炎症因子IL-1β、IL-6、IL-2含量均低于C57BL/6J小鼠(P<0.05或0.01,Fig 9 A,B)。
小鼠血清测定结果显示,模型组小鼠血清中的CK、CK-MB、MB以及cTn-I含量均高于对照组小鼠(P<0.05),即高糖造模后小鼠的心肌损伤严重。空白组中以上检测指标在两种小鼠中差异均无显著性,此基础上C57BL/6J模型组小鼠的CK、CK-MB和MB含量高于TRPC5-/-模型组(P<0.05,Fig 9 C,D),提示抑制TRPC5基因可明显改善心肌损伤程度。
2.2.6小鼠心肌Western blot实验 取各组小鼠心脏组织提取蛋白进行Western blot实验,从统计结果Fig 10可看出,C57BL/6J小鼠心肌组织中表达TRPC5蛋白,且造模后表达明显升高(P<0.001)。同时,造模后IL-1β、IL-6表达升高(P<0.05),但TRPC5-/-小鼠高糖组中,IL-1β升高不明显,提示抑制TRPC5基因的表达能一定程度抑制炎症的发展。
2.3 小鼠原代细胞实验
2.3.1乳鼠原代心肌细胞鉴定结果 乳鼠的原代心肌细胞的特异性标志物 α-sarcomeric antibody 通过一抗和二抗特异性结合后呈现绿色荧光(Fig 11a、d),心肌细胞的细胞核与染料 DAPI 结合后呈现蓝色荧光(Fig 11b、e),各组经重叠后鉴定为乳鼠原代心肌细胞(Fig 11)。

Fig 8 Expression of various inflammatory factors and TRPC5 in mouse myocardium n=3)1:TRPC5-/- CON;2:TRPC5-/- HG;3:C57BL/6J CON;4:C57BL/6J HG;*P<0.05,**P<0.01 vs TRPC5-/- CON;##P<0.01 vs C57BL/6J CON;$P<0.05,$$P<0.01 vs TRPC5-/- HG.

Fig 9 Detection of myocardial enzymes and inflammatory factors in serum of mice n=5)(A-B)Serum levels of IL-1β,IL-6,IL-2 and IFN-γ respectively.(C-D)Serum levels of CK,CK-MB,MB,and cTn-I,respectively.1:TRPC5-/- CON;2:TRPC5-/- HG;3:C57BL/6J CON;4:C57BL/6J HG;*P<0.05,**P<0.01 vs TRPC5-/- CON;#P<0.05,##P<0.01 vs C57BL/6J CON;$P<0.05,$$P<0.01 vs TRPC5-/- HG.
2.3.2小鼠心肌细胞RT-PCR结果 高糖培养原代心肌细胞与巨噬细胞的培养基并进行交换,继续培养后检测各组炎症因子以及TRPC5的表达,统计数据并进行对比。
实验结果显示,与对照组相比,TRPC5-/-小鼠高糖组IL-10、IL-18及INF-α 3种炎症因子表达几乎无变化。而C57BL/6J高糖交换组IL-10、IL-18以及INF-α显著升高,且IL-1β与IL-6升高也较TRPC5-/-高糖交换组更为明显。表明TRPC5基因抑制后能够一定程度降低心肌细胞炎症因子的表达,即减轻炎症反应。
巨噬细胞得到心肌细胞高糖组的细胞液后,炎症因子的表达均显著升高,提示高糖刺激后的心肌细胞释放于细胞培养液中的某些细胞因子能使巨噬细胞的炎症反应升高(Fig 12)。

Fig 10 WB test results in mice n=5)(A-B)TRPC5,IL-1β,IL-2 and IL-6 protein expression respectively.1:TRPC5-/- CON;2:TRPC5-/- HG;3:C57BL/6J CON;4:C57BL/6J HG;*P<0.05 vs TRPC5-/- CON;#P<0.05,##P<0.01 vs C57BL/6J CON.

Fig 11 Results of using α-sarcomeric antibody to identify primary cardiomyocytes of neonatal rats in C57BL/6J (a,b,c)and TRPC5-/- mice (d,e,f)
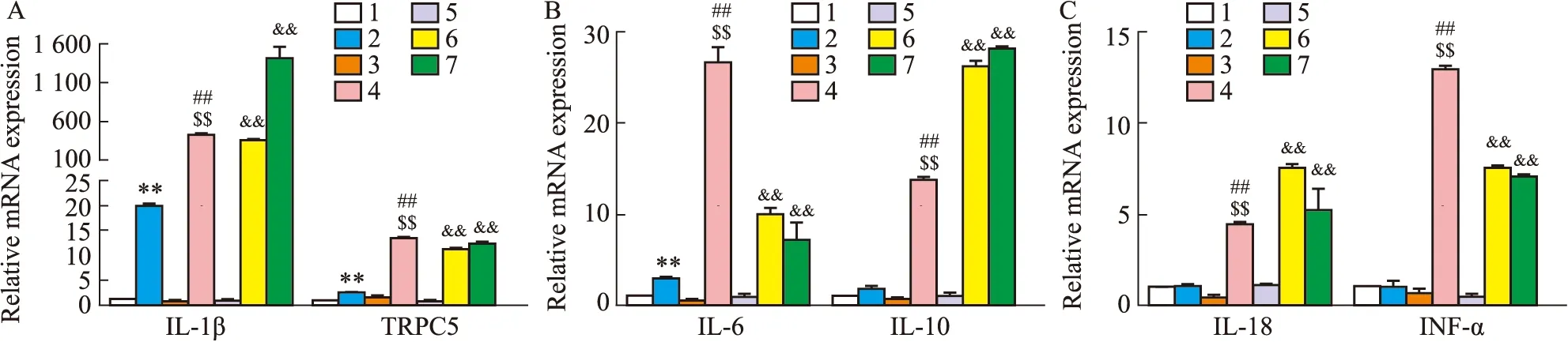
Fig 12 Expression detection of mouse primary cardiomyocytes and mouse macrophages after exchanging culture medium n=3)A:IL-1β,TRPC5 gene expression;B:IL-6,IL-10 gene expression;C:IL-18,INF-α gene expression.1:TRPC5-/- CON;2 TRPC5-/- HG+EX;3:C57BL/6J CON;4:C57BL/6J HG+EX;5:macrophage CON;6:macrophage HG+EX TRPC5-/- HG;7:macrophage HG+EX C57BL/6J HG;**P<0.01 vs TRPC5-/- CON;##P<0.01 vs C57BL/6J CON;$$P<0.01 vs TRPC5-/- HG+EX;&&P<0.01 vs macrophage CON.
2.4 结论生物信息学对核心基因所具有调控作用的生物学过程、细胞组成、分子功能和信号通路进行注释,使用关联基因构建出其蛋白质互作网络,明确了TRPC5相关的生物学过程以及相关的重要基因,发现TRPC5参与了免疫学过程,与炎症相关基因以及通路具有关联性。
TRPC5基因敲除后,小鼠在相同的造模条件下,体重以及血糖的变化较正常小鼠更少,且因糖尿病性心肌病造成的心肌损伤及免疫细胞浸润都有所减少,明确了TRPC5通道与心肌细胞的炎症的相关性,即敲除后可以改善心肌细胞炎症反应,减少心肌组织损伤。
通过小鼠血清检测以及炎症相关的蛋白和基因表达检测,发现TRPC5基因敲除后可减少在糖尿病状态下小鼠血清中的炎症因子以及肌酸激酶等的分泌量,改善小鼠心肌组织的基因表达升高状况和心肌损伤程度,另外心肌细胞经过高糖刺激后所释放的某种细胞因子可能使巨噬细胞的炎症表达升高。
3 讨论
在心肌炎症中,心肌细胞以及免疫细胞产生各种细胞因子形成的抗炎机制对维持心肌功能和研究心肌炎发病通路具有重要的作用[11-12]。心肌炎(myocarditis)是由于多种原因造成的心肌损伤后,免疫炎症细胞浸润至心肌组织,从而造成的炎症疾病。伴随着炎症细胞的浸润和炎症因子TNF-α、IL-2、IL-6、IL-12、IFN-γ等的表达量升高[13],心肌组织的持续炎症反应导致了心肌组织损伤和心肌细胞的凋亡坏死,部分患者最终可演变为扩张性心肌病和慢性心脏损伤,具有较高的发病率和致死率[14]。炎症反应的增加是DCM的重要发病机制之一,大量炎症因子的释放可诱导细胞凋亡和心肌间质纤维化,影响心功能。作为糖尿病并发症的心肌炎研究具有重要意义。
有研究证明,多种TRP亚型的表达在1型及2型糖尿病病人及动物的组织中(如肾脏、血管及炎症细胞)均发生明显的改变[15],这些结果提示TRPC在糖尿病及其并发症的发生发展中起着一定的作用。近年来研究亦发现,心肌细胞自噬对在糖尿病性心肌病(DCM)病变进程有重要的作用[16]。而自噬与炎症密切关联,自噬对炎症反应的双向调节功能在促炎和抗炎反应中都发挥重要作用[17]。在前期TRPC5对心肌细胞自噬调控研究的基础上,本论文在整体动物及细胞水平对TRPC5基因通过干预心肌细胞炎症反应,进而参与DCM发生发展过程的作用进行了全面探讨。
在生物信息学方面,分析了TRPC5相关的生物学过程及重要基因,提示TRPC5确实参与免疫学过程,也与炎症相关基因具有关联性。动物实验部分,发现TRPC5基因敲除后,糖尿病造成的炎症反应及心肌损伤都有所减轻,明确了TRPC5通道与心肌细胞的炎症调控有关,证实其敲除后可以减轻心肌细胞炎症反应;同时发现高血糖后炎症细胞内TRPC5表达的增高,提示TRPC5可能通过调节炎症反应来调节糖尿病的发生与发展。在细胞实验部分,对上述推论进行了验证。后续研究中将继续对TRPC5基因调控糖尿病性心肌病的相关机制进行进一步研究,以期助力于开发新的治疗糖尿病性心肌病的靶点及药物。