酸枣仁冻干粉对大鼠睡眠觉醒状态及能量代谢率的干预作用研究
徐文祥,阮养春,卞宏生,王艳艳,于 爽,李廷利,黄莉莉
(黑龙江中医药大学药学院,黑龙江 哈尔滨 150040)
睡眠是人体重要的生理活动,也是人体恢复精力所必需的条件。近年来,随着互联网的普及,电子产品的使用占据了人们大量的睡眠时间,年轻人睡眠不足的情况越发严重。睡眠不足可引起机体反应下降,记忆力减退。长时间睡眠不足会导致高血压、糖尿病、冠心病等疾病,甚至可以增加死亡率[1]。睡眠不足引起的能量代谢紊乱是诱导肥胖产生的重要因素。2004年,哥伦比亚大学开展了一项睡眠时间调查研究,该研究项目随机抽取18 000名受试者,受试者年龄均在32~59岁之间。经过研究发现,与每天睡7 h的人相比,睡6 h的人肥胖的几率要高23%,睡5 h的人肥胖的几率要高50%,睡眠时间少于4 h的人肥胖的几率要高73%[2]。由此可见,睡眠不足引起的肥胖正受到广泛的关注,更多的学者投入其中,旨在阐明睡眠不足与能量代谢的交互影响及相关机制。
掩蔽(masking)是光照中最普遍的参数。正性掩蔽为白天活动的物种在白天接受光照时,其活动性增强。夜间活动的物种在夜间接受黑暗时其活动性增强,该结论已被广泛认可[3-4]。实验室前期研究发现:24 h持续黑暗可以很好的影响大鼠的睡眠-觉醒节律,对于探讨大鼠的睡眠-觉醒状态及能量代谢率的变化提供了一个方便可靠的造模方法。
酸枣仁系鼠李科植被酸枣的干燥成熟种子,性平,味酸甘,广泛分布于我国东北、西北、华北及南方等地。酸枣果肉中含有丰富的维生素 C 及多种人体所需氨基酸[5],为国家卫生部颁布的首批药食两用品。研究表明,酸枣仁具有抗焦虑、镇静催眠、抗抑郁、抗惊厥等作用[6]。长期的临床应用与大量的实验研究均证明,酸枣仁具有改善睡眠的功效[7]。但是,迄今为止,关于酸枣仁对睡眠-觉醒状态中大鼠的睡眠觉醒状态变化及能量代谢率的相关研究未见报道,相关机制并不明确。
针对以上问题,本实验采用皮层脑电描记联合实验动物监测系统,观察酸枣仁对持续黑暗条件下,大鼠睡眠觉醒状态及能量代谢率的影响。同时,利用酶联免疫试剂盒,检测在酸枣仁的干预作用下,参与下丘脑内能量调控的瘦素(lepin,LEP)、阿黑皮素原(proopiomelanocortin,POMC)、阿神经肽Y(neuropeptide Y,NPY)的含量变化。以此阐明酸枣仁对睡眠觉醒状态紊乱及能量代谢异常的调控作用,为酸枣仁的应用提供科学依据。
1 材料与方法
1.1 动物SPF级SD雄性大鼠36只,体质量220~260 g,实验动物许可证号:SCXK(黑)2013-004,由黑龙江中医药大学实验动物中心提供。常规饲养于SPF级动物饲养室中,室温22~26 ℃,湿度40~70%,12 h明暗交替光照。动物可自由获取水和食物。
1.2 药品及试剂炒酸枣仁冻干粉(经HPLC测定炒酸枣仁总黄酮含量为0.913 8%,总皂苷含量为3.503%。取炒酸枣仁粗粉230 g(由生酸枣仁置炒锅内在130 ℃炒制4 min制得),加入8倍量的蒸馏水煎煮,过滤药液并用旋转蒸发仪浓缩至含生药量2 kg·L-1,浓缩液进行冷冻干燥得23 g冻干粉末(生药量10 g·g-1)。由山西大学秦雪梅教授鉴定并提供,由黑龙江中医药大学中药药理教研室制备。)。水合氯醛(天津市巴斯夫化工有限公司,批号:津Q/HG 3-371-2001);义齿基托树脂(上海新世纪齿科材料有限公司,批号:20141105);义齿基托聚合物(哈尔滨市齿科器材厂有限公司,批号:130829);LEP酶联免疫试剂盒、POMC酶联免疫试剂盒、NPY酶联免疫试剂盒(南京建成生物工程研究所,批号:04/2017)。
1.3 仪器与设备实验动物监测系统:型号CLAMS,美国COLUMBUS公司(系统是由活动评价模组及睡眠探测分析模组构成,组成系统的睡眠高通量筛选功能),大鼠脑立体定位仪(51600型,美国Stoelting公司),十六通道生理记录仪(MP150,美国Biopac公司,SleepSign动物睡眠分析软件),多功能微孔板检测仪(SynergyMx,美国BioTek公司),分析天平(MS204S,美国Mettler Toledo公司),低温高速离心机[3-18R(3006004),美国TOMOS公司]。
1.4 动物分组及模型复制将SD大鼠在实验室饲养环境条件下饲养7 d,适应环境,自由饮食饮水。7 d后,将实验动物随机分为两组,睡眠-觉醒状态能量代谢组、机制研究组,每组18只。第一组进行脑皮层电极埋置手术,实验前将SD大鼠禁食24 h,正常饮水。SD大鼠腹腔注射10%水合氯醛进行麻醉,麻醉后置于大鼠脑立体定位仪上,夹住双耳固定,剃除大鼠脑部毛发并剪开皮肤,暴露出颅骨,用酸蚀剂酸蚀颅骨骨膜,露出白色颅骨,期间用生理盐水不断冲洗血渍,并用棉球进行相应止血,擦干血渍后可见清晰的颅骨缝隙纹路,在人字缝前1 mm及冠状缝前1 mm与颅骨中线右侧旁开1 mm交点处钻孔,露出硬脑膜,埋置脑电电极(electroencephalogram,EEG),颅骨中点左侧旁开2 mm钻孔,露出硬脑膜,埋置固定螺丝。在颈部肌肉下埋置肌电电极(electroyography,EMG),将EEG,EMG电极导线连接于微型插座,缠绕导线,涂抹义齿基托聚合物和义齿基托树脂使微型插座固定于大鼠脑部,待义齿基托树脂风干固定后将大鼠随机分为12 h明暗交替组(L/D:12 h/12 h,LD)、持续黑暗组(DD:24 h,DD)和给药组(medication administration Team,MAT),每组6只。置于相应条件的能量代谢笼中,恢复7 d。恢复后于8 d早7:00进行EEG,EMG的描记,连续描记24 h。
机制研究组大鼠随机分为LD组、DD组和MAT组(24 h持续黑暗),每组6只。置于相应条件的能量代谢笼中,单笼饲养7 d,适应环境。于8 d早7:00进行给药处理。
1.5 给药方法取制得的酸枣仁冻干粉5.6 g定容至10 mL,每天按大鼠体质量10 mL·kg-1灌胃一次,剂量为56 g·kg-1·d-1(生药量)。(经本实验室前期预实验研究表明,该给药量及给药天数可以有效拮抗焦虑)。睡眠-觉醒状态能量代谢组中,MAT组每日早7:00灌胃给药,连续给药7 d,LD组与DD组给予相同体积的蒸馏水。机制研究组中MAT组每日早7:00灌胃给药,连续给药7 d,LD组与DD组给予相同体积的蒸馏水。
1.6 指标检测
1.6.1大脑皮层脑电描记与分析联合CLAMS系统判断大鼠睡眠-觉醒状态 睡眠-觉醒状态能量代谢组大鼠大脑皮层脑电埋置手术结束后,在不同实验条件下的能量代谢笼中恢复7 d,恢复后于8 d早7:00开始描记,连续描记24 h。应用SleepSign分析软件,每30 s一帧采集数据,对大鼠睡眠-觉醒时间图谱进行分析,记录大鼠在不同光照条件下的睡眠时相及睡眠时间,同时依据CMAMS监测系统的睡眠检测分析模组、活动评估模组、根据大鼠脑电图及肌电图将大鼠睡眠-觉醒周期分为三种时相,即觉醒(waken,W)、非快速动眼睡眠(non-rapid eye movement sleep,NREM)及快速动眼睡眠(rapid eye movement sleep,REM)。
1.6.2CLAMS系统监测大鼠能量代谢率 在大鼠进行脑电描记实验时,同时利用CLAMS系统的睡眠检测分析模组、活动评估模组、摄食检测评估模组、间接测热装置对大鼠进行监测,监测时间为早7:00至次日早7:00,连续记录24 h。监测大鼠的自主活动次数、摄食量、产热量。系统设定每10 s采集一次数据,采集参数为:1 sample/10 s。
1.6.3酶联免疫法检测下丘脑中POMC、LEP、NPY含量变化 机制研究组灌胃给药7 d后,于8 d早7:00进行麻醉处理,麻醉后将大鼠断头取脑,小心剥离出大鼠下丘脑部位,在经过分析天平精密称定后,加入9倍量的生理盐水,置于冰水浴中充分匀浆,设定离心转速3 000 r·min-1,离心10 min后取上清液,置于冰箱冷藏室保存。取出冷藏的试剂盒,在室温下放置30 min充分复温平衡,根据试剂盒说明进行相关操作。应用微孔检测仪在450 nm处测定其OD值,并依此计算出标准曲线的回归方程,最终确定样品中POMC、LEP、NPY含量。

2 结果
2.1 大脑皮层脑电描记与分析联合CLAMS系统判断睡眠觉醒状态及能量代谢率的影响
2.1.1大脑皮层脑电描记大鼠睡眠-觉醒状态(24 h)中W、NREM、REM百分比的变化 结果见Tab 1。与LD组比较,DD组白天W增多(P<0.01),NREM减少(P<0.01),REM减少(P<0.01)。夜晚W差异无显著性,NREM减少(P<0.01),REM差异无显著性。与DD组比较,MAT组白天W减少(P<0.05),NREM增多(P<0.05),REM增多(P<0.05)。夜晚W差异无显著性,NREM差异无显著性,REM增多(P<0.05)。

Tab 1 Percentage change of W,NREM,REM under conditions of LD,DD,MAT in sleep-arousal cycle (24 h)in
2.1.2CLAMS系统监测大鼠睡眠-觉醒状态(24 h)中睡眠和觉醒时间百分比的变化 结果见Fig 1。与LD组比较,DD组白天觉醒时间增多(P<0.01),白天睡眠时间减少(P<0.01),夜晚觉醒时间差异无显著性,夜晚睡眠时间差异无显著性。全天觉醒时间增多(P<0.01),全天睡眠时间减少(P<0.01)。与DD组比较,MAT组白天觉醒时间减少(P<0.05),白天睡眠时间增多(P<0.05),夜晚觉醒时间差异无显著性,夜晚睡眠时间差异无显著性,全天总觉醒时间减少(P<0.05),全天总睡眠时间增多(P<0.05)。
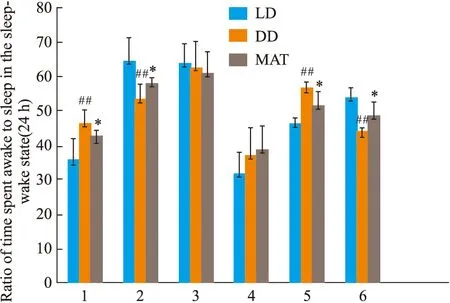
Fig 1 Percentage change in wakefulness and sleep duration under conditions of LD,DD,MAT in rats during wakefulness-sleep cycle (24 h)1:daytime waking time;2:daytime sleep time;3:night waking time;4:night sleep time;5:all day waking time;6:all day sleep time. ##P<0.01 vs LD Group;*P<0.05 vs DD Group
2.1.3大鼠睡眠-觉醒状态(24 h)中能量代谢率的变化 结果见Fig 2-5。与LD组比较,DD组白天自主活动次数增多(P<0.01),白天摄食量差异无显著性、白天产热量差异无显著性。夜晚自主活动次数差异无显著性、夜晚摄食量增多(P<0.05)、夜晚产热量减少(P<0.05)。全天自主活动次数增多(P<0.01)、全天总摄食量增多(P<0.05)、全天产热量减少(P<0.05),实验动物体质量显著增加(P<0.05)。与DD组比较,MAT组实验动物白天自主活动次数减少(P<0.05)、摄食量差异无显著性、产热量增多(P<0.05)。夜晚自主活动次数差异无显著性、摄食量减少(P<0.05)、产热量增多(P<0.05)。全天总自主活动次数减少(P<0.05)、总摄食量减少(P<0.05)、产热量增多(P<0.05),动物体质量增加量减少(P<0.05)。
2.2 酸枣仁冻干粉对DD条件下大鼠下丘脑能量调节系统中的LEP、POMC、NPY影响结果见Fig 6。与LD组比较,DD组下丘脑内LEP含量降低(P<0.01),POMC含量降低(P<0.01),NPY含量升高(P<0.05)。与DD组比较,MAT组下丘脑内LEP含量升高(P<0.01),POMC含量升高(P<0.01),NPY降低(P<0.01)。
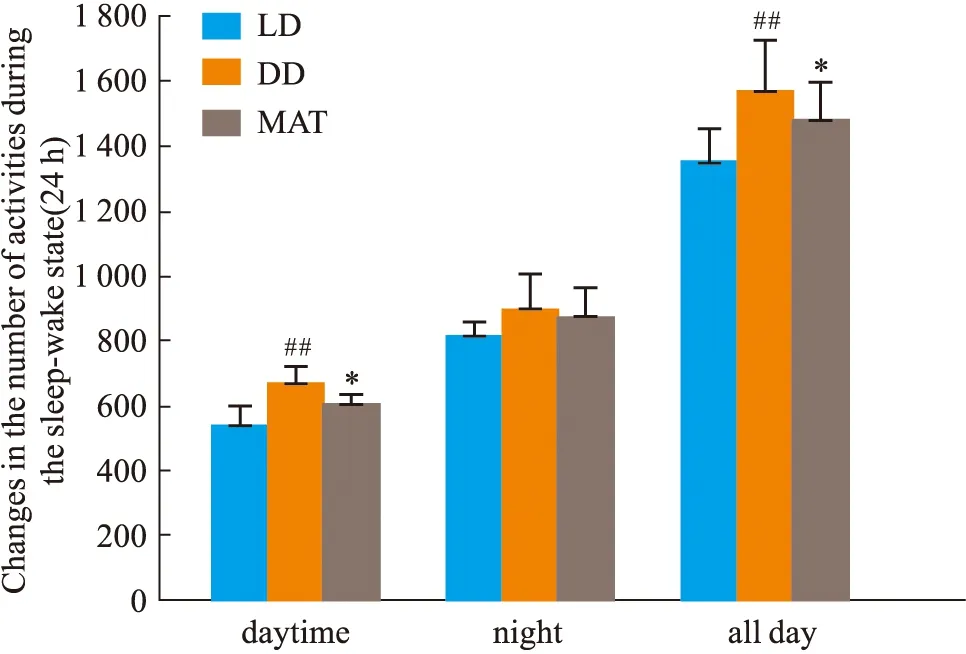
Fig 2 Changes of autonomic activity in wake-sleep ##P<0.01 vs LD Group;*P<0.05 vs DD Group
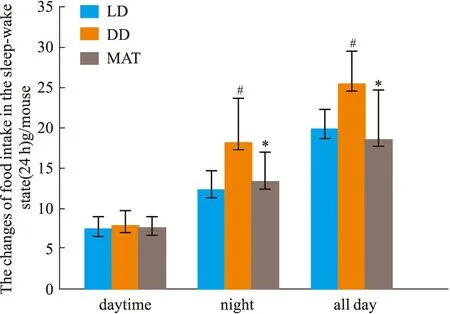
Fig 3 Changes of food intake in sleep-wake #P<0.05 vs LD Group;*P<0.05 vs DD Group
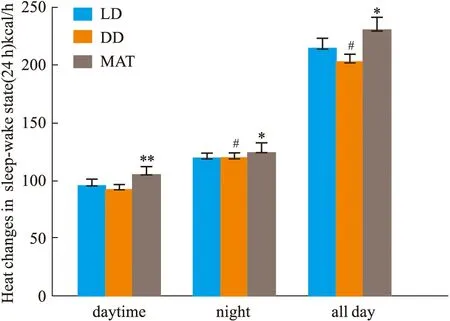
Fig 4 Changes of middle- calories during sleep-wake cycle (24 h)in #P<0.05 vs LD Group;**P<0.01,*P<0.05 vs DD Group
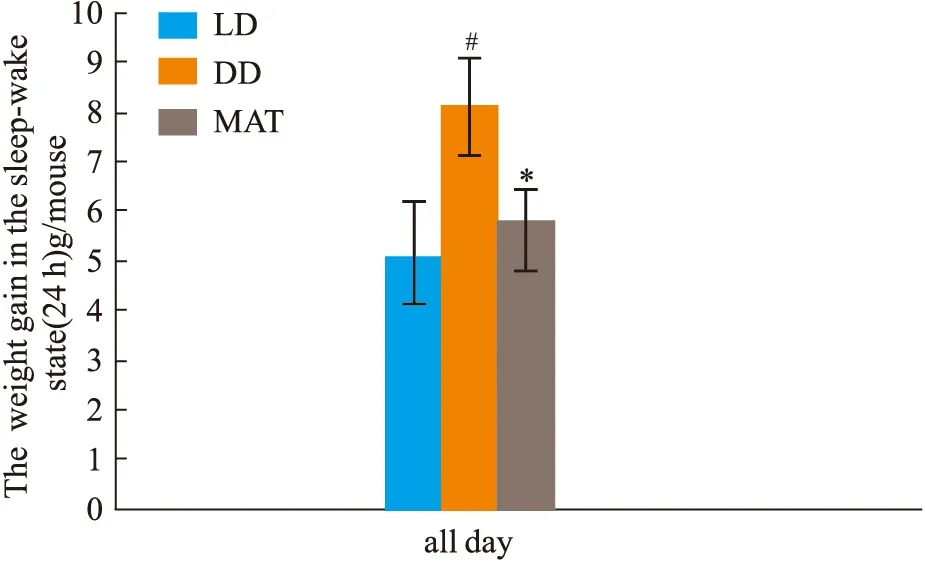
Fig 5 Changes of body weight gain during sleep-wake cycle (24 h)in #P<0.05 vs LD Group;*P<0.05 vs DD Group Fig 6 Effect of freeze-dried powder of jujube kernel on LEP, #P<0.05,##P<0.01 vs LD Group;**P<0.01 DD Group
3 讨论
昼夜节律系统也叫做生物钟系统,是自然界中生物日夜活动的基本规律。昼夜节律周期由生物的基因决定,每一个生物节律周期基本等于24 h,动物的睡眠、觉醒、狩猎、繁衍等活动都具有显著的昼夜节律特征[8]。国内外相关调查及实验研究均表明,缺乏睡眠导致的昼夜节律紊乱会使机体能量代谢出现异常,这也是诱导肥胖形成的重要因素[9]。
下丘脑是机体的能量代谢控制中心,下丘脑中含有多种抑食因子及增食因子,它们相互干预,互相调控使机体处于能量稳定状态,瘦素及阿黑皮素原都是重要的抑食因子。瘦素主要与位于下丘脑弓状核的瘦素受体结合,通过激活阿黑皮素原(POMC),达到抑制神经肽 Y的作用[10]。瘦素由白色脂肪细胞分泌,是一种多肽类激素[11]。可以调控中枢神经系统对糖脂代谢、能量代谢的平衡。
阿黑皮素原是一类神经肽,经水解后形成多种肽,包括促黑激素、促肾上腺皮质激素、β-内啡肽等,在垂体、弓状核、胰腺、皮肤、睾丸等均发现其表达[11-12]。瘦素可以影响阿黑皮素原在弓状核的表达,当瘦素浓度低时,阿黑皮素原表达减少,升高瘦素浓度,阿黑皮素原表达随之增加,在血液中两者浓度成正比关系。实验表明,在给大鼠注射瘦素时,阿黑皮素原表达增加,动物表现出摄食量的下降,表明瘦素部分依赖于阿黑皮素原的变化从而发挥其生物学作用[13]。
神经肽Y是一种由36 个氨基酸组成的生物活性多肽,其在下丘脑的浓度很高,主要分布于下丘脑弓状核神经元。目前已知神经肽Y是最强的中枢食欲促进因子,可促进食欲、增加进食,促进摄入高糖、高脂的食物,神经肽Y的增加是肥胖产生的重要因素。神经肽Y是瘦素作用的介质,研究发现脑室内注射瘦素可以显著降低神经肽Y mRNA的表达,表明瘦素与神经肽Y存在负向调节机制[14]。
现代药理学表明,酸枣仁具有镇静催眠、抗焦虑、抗抑郁等作用。长期实验研究和大量的临床实践均表明,酸枣仁具有改善睡眠的作用。但是,到目前为止,尚未见到有关酸枣仁对睡眠-觉醒状态中能量代谢率影响的研究。
基于上述问题,本课题开展了酸枣仁对持续黑暗条件下睡眠-觉醒状态及能量代谢率的影响和其变化机制的研究,并讨论。
3.1 正常光照条件下大鼠在24 h周期中能量代谢率的改变本实验采用SD雄性大鼠为研究对象,首先进行脑部电极及肌肉电极埋置手术,后置于LD条件中进行单笼饲养。同时利用脑电描记系统联合CLAMS系统,对大鼠睡眠-觉醒时间,自主活动次数,摄食量,产热量进行实时监测。结果表明与白天相比,夜晚大鼠的机体活性明显增强,其表现在夜晚觉醒时间延长、活动次数、摄食量、产热量均增加,该实验结果与相关文献报道一致[15]。由此可以看出,啮齿类动物属于夜型性动物,其昼夜节律与人类相反,夜晚的能量代谢率高于白天。
3.2 持续黑暗条件下大鼠在24 h周期中能量代谢率的变化将实验大鼠置于24 h持续黑暗条件下,经过研究发现,与LD组大鼠相比,DD组大鼠觉醒时间、活动次数、摄食量、体质量均显著增加,睡眠时间、产热量则明显下降。该结果表明24 h持续黑暗条件会对大鼠的昼夜节律产生影响,使大鼠睡眠时间减少,从而导致大鼠机体能量代谢的紊乱,诱导肥胖的产生。在当今社会中,随着城市化的发展,人们正处于这种过度光照的环境下,尤其是年轻人每天长时间接受光照,甚至处于全天光照的环境中。该现象与实验中24 h持续黑暗条件相类似,会使人体处于昼夜节律紊乱的状态,从而导致人体能量代谢紊乱,诱导肥胖的产生[16-17]。
3.3 酸枣仁冻干粉对大鼠在24 h周期中能量代谢率干预作用的探究对处于持续黑暗条件下的大鼠给予酸枣仁冻干粉干预后,大鼠觉醒时间、活动次数、摄食量、体质量均显著减少,睡眠时间、产热量有明显增加。该结果表明酸枣仁冻干粉可以延长大鼠睡眠时间,从而改善大鼠能量代谢异常形成的肥胖。
3.4 酸枣仁冻干粉对大鼠在24 h周期中能量代谢率干预作用机制的探究LEP、POMC和NPY是下丘脑中参与能量调控的重要因子。LEP对POMC有正向调控作用,LEP对NPY存在负向调控作用,当缺乏睡眠时,大鼠LEP分泌减少,抑食因子POMC含量下降,食欲促进因子NPY含量随之升高,大鼠食物摄入量增加,导致体质量的增加。当给予酸枣仁冻干粉干预后,睡眠时间增加,大鼠LEP分泌增加,POMC含量增加,NPY含量下降,大鼠食物摄入量减少,体质量随之下降。由此得出结论,酸枣仁通过改善大鼠睡眠状态调节下丘脑内LEP、POMC、NPY含量,起到纠正机体能量代谢紊乱的作用。
基于上述,我们通过实验发现,酸枣仁通过升高大鼠下丘脑内LEP和POMC含量,降低NPY含量使得大鼠的白天觉醒时间减少,睡眠时间增多,自主活动次数减少、产热量增多。夜晚摄食量减少、产热量增多,最终导致实验动物体质量增加量的减少。从而纠正因持续黑暗条件导致的大鼠睡眠觉醒状态紊乱及能量代谢率的异常。此外,本实验应用冻干粉进行研究,低温冻干对药物中的挥发性成分损失很小,能排除药物中95%以上的水分,利于药物保存,且加水后能迅速完全溶解。与水煎液,浸膏等相比,应用低温冻干将所需药物一批次做完,其含量统一,且含量达到一定浓度,保证本次实验药效稳定性。