红景天苷激活HIF-1α信号通路促进成骨细胞增殖的机制
金昱彤,祁 琳,牛芯蕊,王继达,于 爽,李佳颖,边育红,王 越
(1.天津中医药大学中西医结合学院,天津 301617;2.武警特色医学中心药剂科,天津 300162)
成骨细胞调控的骨形成环节与破骨细胞调控的骨吸收环节发挥协同作用,共同维持着骨稳态,与骨流失相关的骨骼疾病,如骨质疏松,是由于成骨细胞的功能受损,进而骨稳态失衡造成[1]。成骨细胞骨形成功能的低下可加速骨吸收作用,导致骨稳态失衡,降低骨密度,增加骨脆性,从而引发骨质疏松[2]。因此,使用有效的药物促进成骨细胞增殖并提高骨形成能力是治疗骨质疏松病的关键。
中药红景天系景天科大花红景天的干燥根茎,具有益气活血的功效。其中,红景天苷(salidroside,SAL)是红景天中的主要有效活性成分,有低毒性和低副作用的特性。近年来,因其具有抗缺氧、抗骨质疏松、神经保护及抗癌等药理学作用而受到广泛关注[3-4]。在抗骨质疏松研究方面,SAL能够促进成骨细胞增殖,同时抑制成骨细胞的氧化损伤及骨吸收因子的释放从而减少骨量的丢失[5]。最新研究表明,SAL通过激活Wnt/BMP 信号通路促进成骨细胞分化,从而起到抗骨质疏松的作用[6]。
缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)与促进骨形成、血管新生,改善骨折愈合有着密切关系[7]。血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素样蛋白4(angiopoietin-like protein 4,ANGPTL4)及白介素6 (interleukin 6,IL-6)均为HIF-1α的下游靶基因,具有促进成骨细胞增殖和骨血管生成的作用[8-10]。我们在前期研究中发现,SAL可通过HIF-1α/VEGF信号通路促进骨折愈合,促进小鼠骨形成功能[11]。本研究以小鼠原代细胞(mouse primary osteoblasts,MOB)为研究对象,进一步探究SAL促进成骨细胞增殖的作用机制。
1 材料与方法
1.1 药物与试剂红景天苷(纯度≥98%,N11O9X71936)购于上海源叶生物有限公司;YC-1(81560)购于Cayman Chemica公司;胰酶(T1320)、Ⅰ型胶原酶(C8140)、ALP染色试剂盒(G1481)均购于Solarbio公司;α-MEM培养基(SH30265.01)购于Hyclone公司;胎牛血清(S711-001S)购于Lonsera公司;青链霉素(15140-122)购于Gibco公司;BCA蛋白定量试剂盒(CW00145)、HiFi Script cDNA Synthesis Kit(CW2569M)均购于康为世纪生物科技有限公司;HIF-1α抗体(ab2185,1 ∶1 000)、GAPDH抗体(ab181602,1 ∶10 000)均购于Abcam公司;TransStart TopGreen qPCR SuperMix(AQ601-03)购于北京全式金生物技术有限公司;HIF-1α、VEGF、ANGPTL4 、IL-6mRNA引物均购于北京鼎国昌盛生物技术有限责任公司;VEGF(YX-220513M)、ANGPTL4(YX-011407M)、IL-6(YX-091206M)ELISA试剂盒购于天津伊特生命科学研发有限公司
1.2 主要仪器超净工作台,Heal Force公司;CO2培养箱、酶标仪Thermo公司;倒置显微镜,NIKON公司。
1.3 实验动物新生48 h内的C57/BL6乳鼠10只,购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。
2 方法
2.1 原代成骨细胞的提取将新生乳鼠用酒精浸泡消毒后,在超净工作台内剥离出颅盖骨,置于含青链霉素的PBS中,剔除组织后剪碎并置于新的培养瓶中。采用胰酶-Ⅰ型胶原酶联合消化剪碎的骨片,收集胶原酶消化液离心后收集细胞沉淀,在37 ℃、5% CO2培养箱中培养,差速贴壁法纯化提取的MOB,取2~5代细胞进行后续实验。
2.2 原代成骨细胞的鉴定将第2代原代成骨细胞PBS漂洗两次后,用4%细胞固定液固定30 min,配制ALP染色溶液并依次加入,在37 ℃恒温孵育箱避光孵育60 min,PBS漂洗后显微镜下观察。
2.3 MTT检测细胞增殖情况使用MTT法检测细胞增殖情况,调整MOB细胞浓度后接种于96孔板中,每个浓度SAL设置5个复孔。分别培养24、48和72 h,酶标仪检测490 nm波长各孔OD值。
2.4 Western blot检测用Western blot法检测在加入1~1 000 nmol·L-1SAL后细胞中关键蛋白HIF-1α的表达变化,按说明书比例配制含PMSF的RIPA裂解液,冰上裂解后按BCA蛋白定量试剂盒说明书测定样品浓度。随后进行SDS-PAGE电泳、转膜,封闭孵育后显影,用ImageJ分析条带,使用GraphPad Prism8作图。

Tab 1 List of primers
2.5 RT-PCR检测使用TRIzol提取法提取Control组和SAL干预组(1、10、100、1 000 nmol·L-1)细胞总RNA,检测浓度后进行逆转录反应。随后使用SYBR qPCR SuperMix进行荧光定量PCR,实验每组设置3个复孔,采用相对定量法分析,运用2-ΔΔCT的方法进行数据统计。
2.6 ELISA检测收集Control组及SAL干预组(1、10、100、1 000 nmol·L-1)的细胞上清液,按照ELISA试剂盒说明书步骤制备标准曲线,依次加入样品,每个样品设置3个复孔,使用酶标仪检测OD值,检测上清液中VEGF、ANGPTL4及IL-6的水平情况。
2.7 药物干预与分组取正常培养的2-5代MOB,分Control组,SAL干预组(1、10 、100、1 000 nmol·L-1),SAL干预组给予SAL处理48 h,Control组采用α-MEM完全培养基对照,加入HIF-1α阻断剂YC-1(10 μmol·L-1),预处理1 h。

3 结果
3.1 原代成骨细胞的培养将提取后的MOB于24 h、72 h和5 d在镜下观察,可见提取后24 h的成骨细胞贴壁生长、胞核呈卵圆形,72 h时形态呈现为梭形,且细胞之间接触增多、胞体向外伸展,5 d后细胞形态多呈三角样、纺锤样,待长满培养瓶进行传代培养。
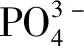
3.3 SAL对小鼠原代成骨细胞增殖的影响使用不同浓度(1、10、100、1 000 nmol·L-1)的SAL分别作用MOB 24、48和72 h后,采用MTT法检测在3个时间节点时SAL对MOB增殖的影响。结果如Fig 3所示,与Control组相比,24、48和72 h时SAL干预组均促进MOB的增殖,其中48 h开始增殖效果明显,以100 nmol·L-1的SAL增殖效果最佳(P<0.01)。因此,后续实验SAL浓度选择1~1 000 nmol·L-1,并选用48 h为药物作用时间。
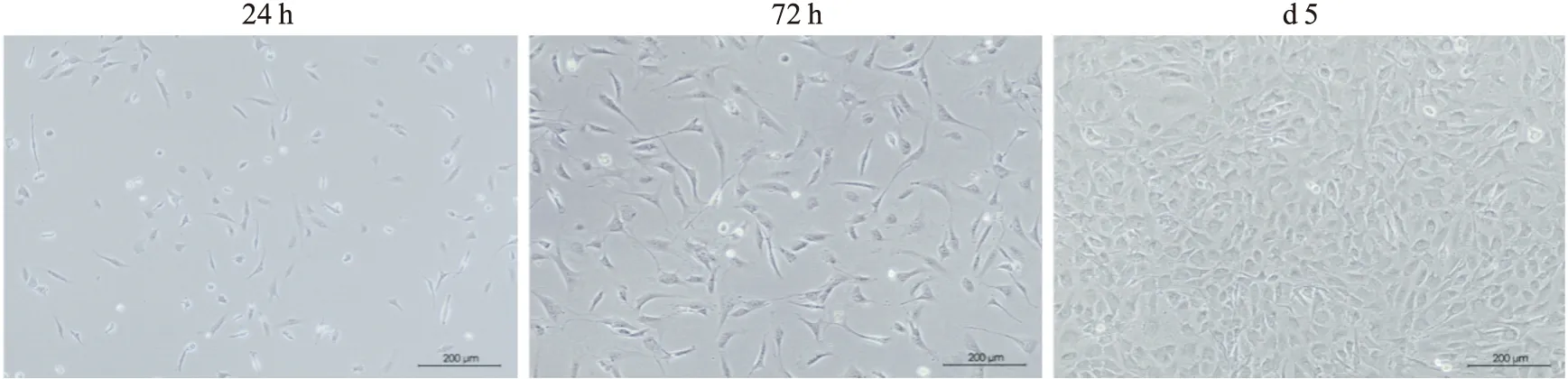
Fig 1 Adherent primary osteoblasts in different growth stages
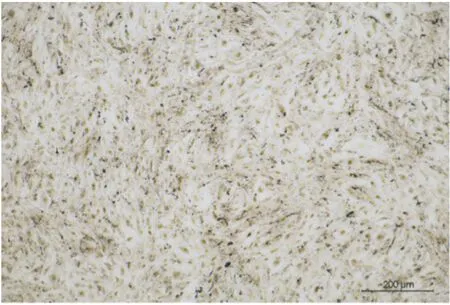
Fig 2 Alkaline phosphatase staining of second passage of MOB(100×)
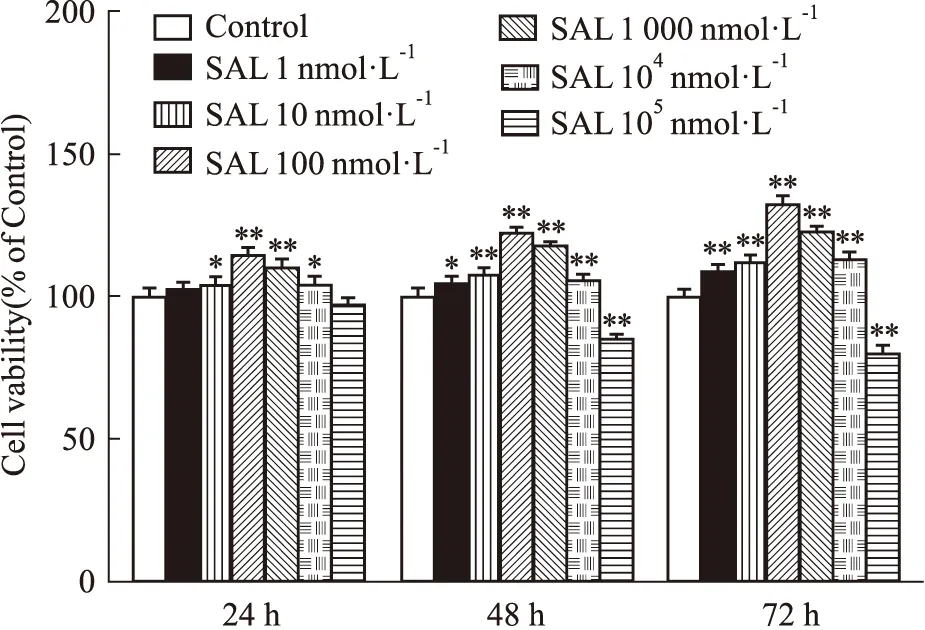
Fig 3 Effects of SAL on proliferation of MOB
3.4 SAL对原代成骨细胞HIF-1α通路相关基因表达的影响为考察SAL对MOB中HIF-1α信号通路的影响,采用RT-PCR法检测HIF-1α及通路中相关基因VEGF、ANGPTL4及IL-6表达水平的变化。结果如Fig 4所示,在加入SAL干预MOB后,与Control组相比,SAL干预组HIF-1α、VEGF、ANGPTL4及IL-6 mRNA表达均有不同程度上调,其中100 nmol·L-1的SAL干预组最明显(P<0.01)。实验结果提示,SAL可能经HIF-1α/VEGF、ANGPTL4、IL-6信号通路调控成骨细胞。
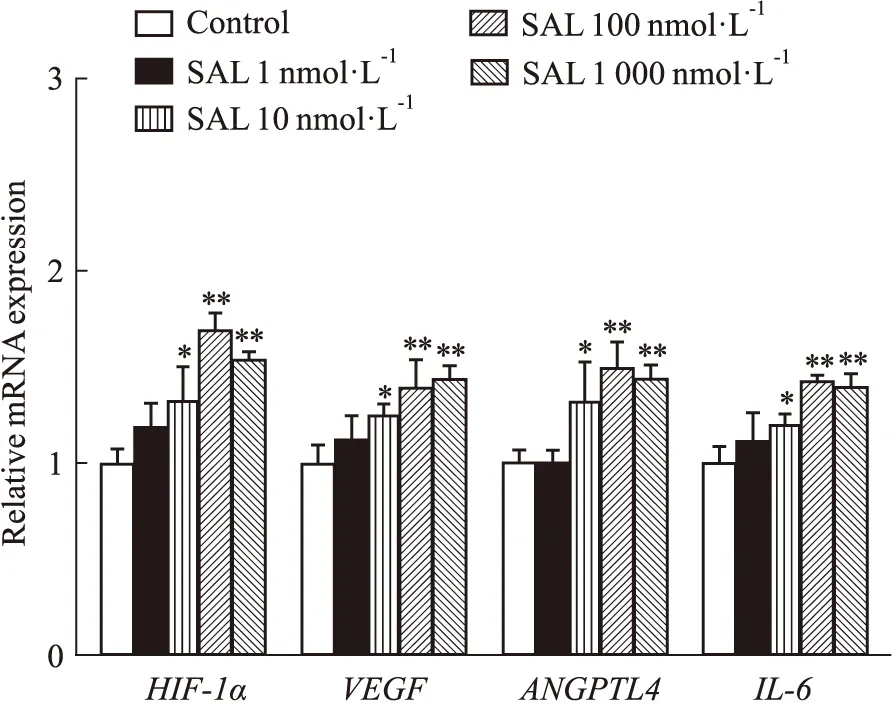
Fig 4 Effects of SAL on HIF-1α,VEGF,ANGPTL4,IL-6
3.5 SAL对HIF-1α通路相关蛋白表达的影响为进一步验证SAL对成骨细胞HIF-1α通路关键蛋白表达的影响,采用Western blot法检测了在加入SAL后HIF-1α蛋白表达的变化。结果如Fig 5显示,与Control组相比,SAL干预组HIF-1α蛋白表达水平上调,且当SAL浓度为100 nmol·L-1时最为明显(P<0.01)。在加入浓度为1~1 000 nmol·L-1的SAL后,使用ELISA法对上清液中的VEGF、ANGPTL4、IL-6检测结果显示,与Control组相比,SAL干预组VEGF、ANGPTL4及IL-6的分泌含量均有不同程度增加。
3.6 HIF-1α阻断剂YC-1对SAL作用后HIF-1α通路相关蛋白表达的影响在加入SAL前使用HIF-1α阻断剂YC-1提前处理MOB 1 h,选用100 nmol·L-1浓度的SAL同时设立阻断剂对照组,检测HIF-1α及VEGF、ANGPTL4及IL-6的蛋白表达情况。实验结果如Fig 6显示,与Control组相比,YC-1对相关蛋白表达无明显影响,在加入100 nmol·L-1SAL后蛋白表达显著上调(P<0.01)。与SAL干预组相比,YC-1+SAL组HIF-1α、VEGF、ANGPTL4及IL-6的蛋白表达均下调,由此可见SAL对MOB的作用有部分经HIF-1α/VEGF、ANGPTL4、IL-6信号通路调控。
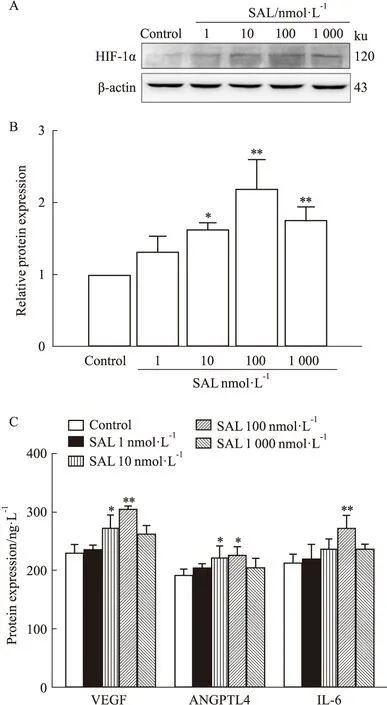
Fig 5 Effect of SAL on protein expression level of HIF-1α,*P<0.05,**P<0.01 vs control group
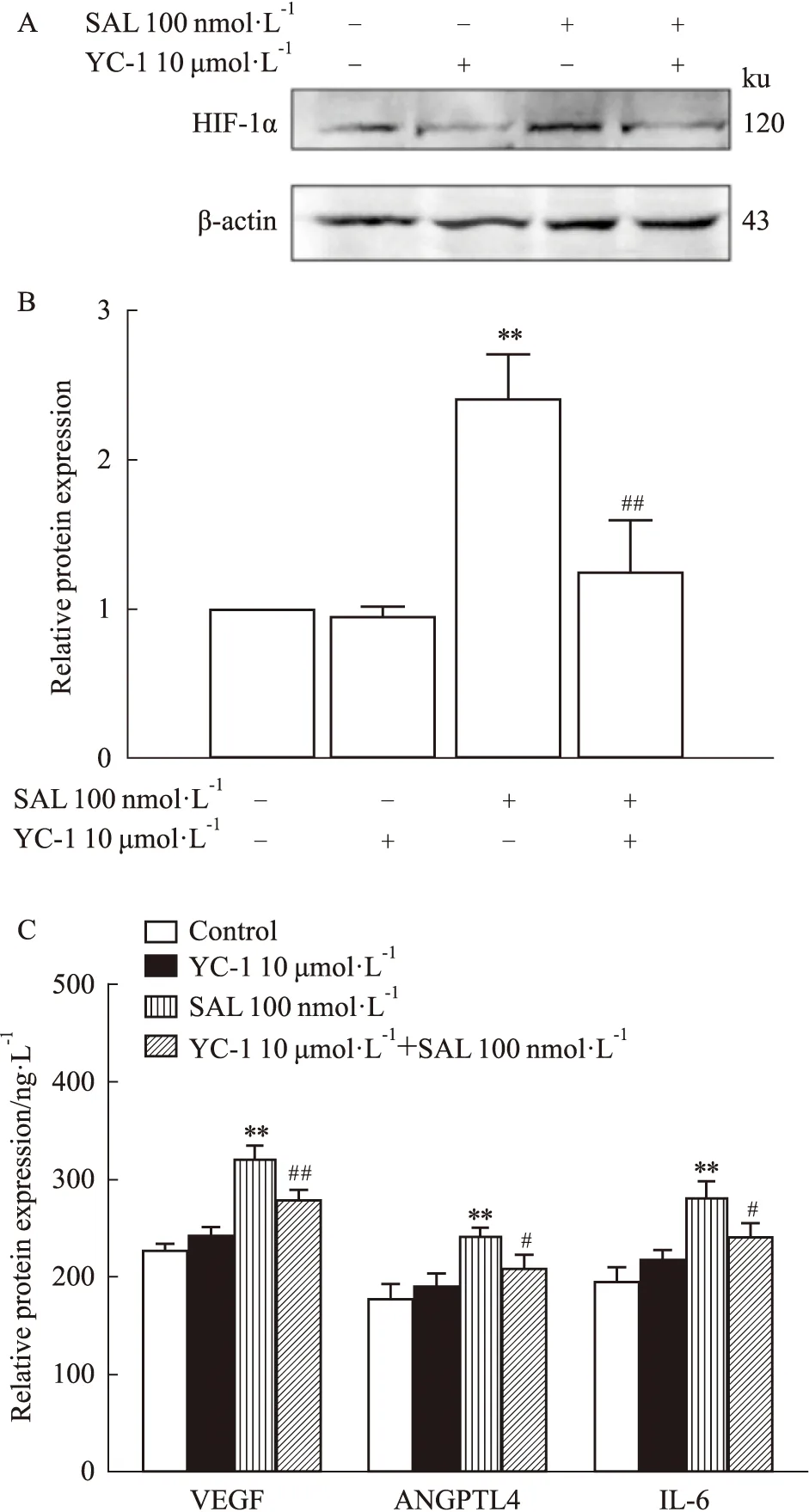
Fig 6 Effects of YC-1 on protein expression level of HIF-1α,*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs SAL group
4 讨论
骨质疏松症是一种由骨稳态失衡导致的慢性疾病,尤以老年人和绝经后妇女为高风险发病人群[12],与年龄相关的骨质流失和骨质疏松病与成骨细胞数量减少密切相关。成骨细胞来源于骨间充质干细胞,主要功能为调控骨基质的合成、分泌和矿化[13]。成骨细胞骨形成功能的低下可加速骨质流失,而促进骨形成的重要靶点在于提高对成骨细胞增殖与分化功能的调控。
HIF-1是调节细胞内氧稳态的核心转录因子,其组成包括α和β两个亚基,HIF-1α信号通路与促进成骨细胞骨形成功能密切相关,激活HIF-1a和骨生成相关基因可改善骨折愈合、增加骨矿物质密度并增加骨强度[14],小鼠骨形成能力随着特异性敲除成骨细胞HIF-1α基因后显著减弱[15]。有研究通过建立两阶段细胞谱系数学模型的方法分析HIF-1α对MSCs成骨分化的影响,结果显示,HIF-1α对MSCs的成骨分化率具有剂量依赖性刺激作用[16]。
现有研究表明,VEGF、ANGPTL4和IL-6均为HIF-1α的下游靶基因,具有促进成骨细胞增殖和骨血管生成的作用。VEGF是促进骨血管生成的因子,成骨细胞中HIF-1α/VEGF信号通路的激活,可促进成骨细胞的增殖、加速血管生成,对骨折的治疗起关键作用[8,17]。ANGPTL4是一种多功能脂肪因子,参与血管生成。Knowles等[9]应用DNA芯片分析发现ANGPTL4为HIF-1α下游的首要靶基因,且证实ANGPTL4可增强成骨细胞的增殖和分化。IL-6是由多种细胞产生的多功能细胞因子,HIF-1α过表达可显著提高成骨细胞中IL-6的水平,外源性IL-6可以显著促进成骨细胞的增殖,提示成骨细胞中的IL-6为HIF-1α下游靶基因,并通过HIF-1α途径促进血管生成-成骨耦联[10]。
本实验选用源于MOB作为研究对象,提取时采用酶消化去除大部分存在于骨膜中的软骨细胞。通过传代和差异性贴壁法对提取的细胞进行纯化后,成骨细胞为贴壁细胞的主要组成部分。通过MTT实验检测了不同浓度SAL(1~105nmol·L-1)对MOB的增殖作用,结果显示在加入SAL(1~104nmol·L-1)24、48及72 h后可不同程度地促进MOB增殖,以100 nmol·L-1的SAL增殖效果最佳。进一步采用RT-PCR、Western blot、ELISA实验检测SAL对HIF-1α/VEGF、ANGPTL4、IL-6信号通路基因和蛋白表达的影响,结果表明在加入SAL(1~1 000 nmol·L-1)后相关基因与蛋白的表达均有不同程度的上调,在加入HIF-1α阻断剂YC-1后该作用减弱,表明SAL对MOB的作用有部分经过HIF-1α/VEGF、ANGPTL4、IL-6信号通路调控。
综上所述,SAL可促进MOB的增殖,其作用机制可能是激活HIF-1α/VEGF、ANGPTL4、IL-6信号通路,促进血管生成-成骨耦联从而提高成骨细胞的增殖活性。本研究初步探索了SAL促进成骨细胞增殖及其作用机制,以期为SAL临床抗骨质疏松用药提供实验依据,为中药在临床中防治骨质疏松提供了理论基础和思路。
——题《圣山系-金巅》